|
|
Биохимия. Биохимия Прак 14. Эта реакция выполняет функцию временного обезвреживания аммиака
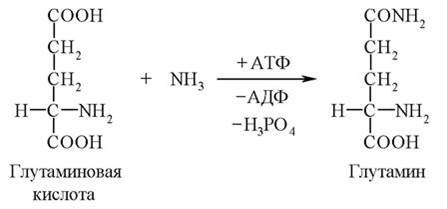
По мере возникновения (выделения в процессе косвенного дезаминирования) аммиак связывается во всех тканях с глутаминовой кислотой с образованием глутамина.
Эта реакция выполняет функцию временного обезвреживания аммиака. С током крови глутамин поступает в печень, где распадается снова на глутаминовую кислоту и аммиак (NH3). Глутаминовая кислота с кровью опять поступает в различные органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ используются в печени для синтеза мочевины.
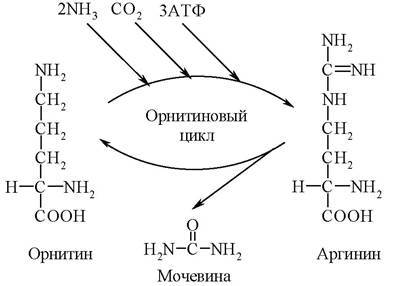
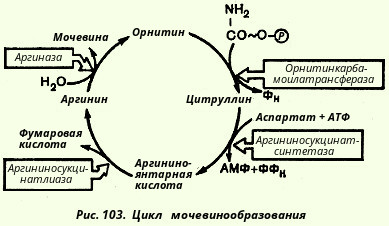
Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии. В нем участвует аминокислота орнитин. Эта аминокислота в состав белков не входит. Образуется орнитин из аргинина - аминокислоты, присутствующей в белках. В связи с важной ролью орнитина в синтезе мочевины последний получил название орнитиновый цикл. Открыл его Г. А. Кребс, протекает орнитиновый цикл в печени, суммарно на него расходуются 3 молекулы АТФ:
Орнитиновый цикл
Наряду с орнитином и аргинином в образовании мочевины участвуют аминокислоты глутамин и аспарагиновая кислота. Глутамин является поставщиком аммиака, а аспарагиновая кислота - его переносчиком.
Синтез мочевины - это реакция окончательного обезвреживания аммиака. Из печени с кровью мочевина поступает в почки и выделяется из организма с мочой. Синтез и выделение мочевины - это один из механизмов, регулирующих азотистый баланс.
В сутки образуется 25 - 30 г мочевины из 80 -100 г белка. При нарушении синтеза мочевины в печени увеличивается концентрация аммиака в тканях и крови. Выделение мочевины с мочой характеризует скорость распада белков в организме. С мочой удаляется около 90 % общего азота.
В организме человека подвергается распаду около 70 г аминокислот в сутки; при этом в результате дезаминирования, трансаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. И, действительно, уровень аммиака в норме в крови не превышает 1-2 мг/л (это почти в 1000 раз меньше концентрации сахара в крови). На кроликах показано, что концентрация аммиака 50 мг/л является летальной. Таким образом, аммиак должен подвергаться связыванию в тканях с образованием нетоксичных соединений, легко выделяемых с мочой.
Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах, является биосинтез глутамина (и, возможно, аспарагина). Поскольку глутамин и аспарагин с мочой выделяются в небольшом количестве, было высказано предположение, что они выполняют скорее транспортную функцию. Позже в тканях, в основном в почках, были открыты специфические ферменты - глутаминаза и аспарагиназа, катализирующие гидролиз соответствующих амидов на аммиак и дикарбоновые аминокислоты.
Синтез амидов требует доставки энергии в виде АТФ и присутствия глутаминовой или аспарагиновой кислоты, свободного аммиака и катализируется специфическими глутамин- и аспарагинсинтетазами в соответствии с уравнением реакций:
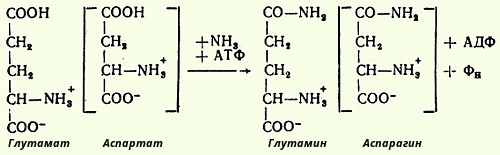
Механизм этих синтетазных реакций, подробно изученный Майстером, включает ряд стадий. Если фермент обозначить Е и принять сокращенные буквенные обозначения аминокислот, то механизм синтеза глутамина в присутствии глутаминсинтетазы может быть представлен в следующем виде:
Глу + Е + АТФ --> Е АДФ-Глу + Фн
ЕАДФ-Глу + NH3 --> Глн + Е-АДФ
Е-АДФ -> Е + АДФ
---------------------------------------------
а + b + c: Глу + АТФ + NH3 --> Глн + АДФ + Фн
Биосинтез аспарагина протекает несколько отлично и зависит от природы ферментов и донатора аммиака. Так, у микроорганизмов и в животных тканях открыта специфическая аммиакзависимая аспарагинсинтетаза, которая катализирует синтез аспарагина в две стадии:
Асп + Е + АТФ --> Е-АспартилАМФ + ФФн
Е-АспартилАМФ + NH3 --> Асн + Е + АМФ
В животных тканях содержится, кроме того, глутаминзависимая аспарагинсинтетаза, которая для синтеза во второй стадии использует амидную группу глутамина:
Е-АспартилАМФ + Глн --> Асн + Е + АМФ + Глу
Суммарная ферментативная реакция синтеза аспарагина может быть представлена в следующем виде:
Асп + АТФ + NH* + (Глн) -> Асн + АМФ + ФФн + (Глу)
Часть аммиака легко связывается с α-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции; если еще учесть синтез глутамина, то нетрудно видеть, что в организме имеется хорошо функционирующая система, связывающая две молекулы аммиака:

Глутамин, кроме того, используется почками в качестве резервного источника аммиака, необходимого для нейтрализации кислых продуктов обмена при ацидозе, защищая тем самым организм от потери с мочой ионов Na+, которые в противном случае использовались бы для поддержания физиологического значения pH крови и мочи при ацидозе.
Орнитиновый цикл мочевинообразования
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. Долгое время решалась проблема, связанная с локализацией сиитеза мочевины. Однозначно эта проблема была решена в лаборатории И. П. Павлова, в которой были получены убедительные доказательства роли печени в этом процессе. Оказалось, что при наложении фистулы Экка - Павлова, выключающей печень из кровотока, наблюдается резкое повышение количества свободных аминокислот в крови и падение количества мочевины в крови и моче. Эти данные, а также клинические наблюдения над больными с органическими поражениями печени (гепатиты, острые некрозы и др.), у которых также было отмечено увеличение концентрации аминокислот в крови и снижение содержания мочевины в крови и моче, позволили считать, что печень является главным, если не единственным, местом биосинтеза мочевины в организме. Нерешенным оставался вопрос о механизме синтеза мочевины.
Для объяснения механизма образования мочевины было предложено множество теорий. Одной из них является разработанная М. В. Ненцким схема синтеза мочевины, основанная на допущении, что непосредственными источниками углерода и азота в молекуле мочевины являются аммиак и углекислота (в форме угольной кислоты). Это положение подтвердилось позже, хотя в связи с открытием аргиназы механизм синтеза мочевины оказался другим.
Кребс и Гензелейт в 1932 г. в опытах со срезами печени измеряли образование мочевины при добавлении в среду различных аминокислот и аммонийных солей. Было показано, что добавление к срезам печени аммонийных солей и каталитических количеств орнитина (но не какой-либо другой аминокислоты) приводило к образованию значительно большего количества мочевины, чем стехиометрическое его количество (одна молекула орнитина способствовала синтезу 20 молекул мочевины; поскольку источником азота мочевины были ионы аммония, орнитин действительно оказывал каталитическое действие). К этому времени уже была открыта в печени аргиназа, которая катализировала распад аргинина на орнитин и мочевину: аргинин-oрнитин + мочевина. Кребс полагал, что каталитическую роль орнитина можно было бы объяснить, если бы существовал некий механизм для регенерации аргинина из орнитина, согласно уравнению:
Орнитин + СO2 + 2NH3 --> Аргинин + 2H2O
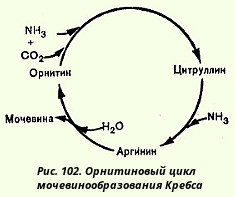
Это предположение стимулировало поиск возможных промежуточных продуктов между орнитином и аргинином и в качестве кандидата была теоретически предсказана аминокислота цитруллин, который до этого был изолирован из столового арбуза (Citrullus). И действительно, в опытах на срезах печени цитруллин оказывал такой же каталитический эффект в присутствии аммонийных солей на выход мочевины, как и орнитин. На основании этих данных. Кребс вывел уравнения реакций синтеза мочевины, которые представлены ниже в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса (рис. 102).
Следует указать, что в биохимии это была первая циклическая система метаболизма, почти на 5 лет опередившая открытие Кребсом другого метаболического цикла трикарбоновых кислот.
Дальнейшие исследования в основном подтвердили циклический механизм биосинтеза мочевины в печени, однако благодаря исследованиям Коена и Ратнер были уточнены промежуточные этапы, природа других участников и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть более детально представлен следующими уравнениями реакций. На первом этапе синтезируется высокоэртическое соединение карбамоилфосфат из СO2 и NH3 (или глутамина в качестве донатора аммиака); этот синтез требует участия двух молекул АТФ:
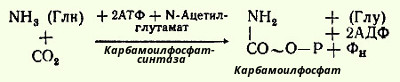
Фермент содержит биотин в качестве кофермента и сначала реагирует с одной молекулой АТФ, образуя комплекс активная СO2-Е, который затем реагирует с молекулой аммиака (или амидной группой глутамина) и со второй молекулой АТФ (в качестве донатора фосфата). N-Ацетилглутамат является специфическим активатором реакции и его роль сводится, очевидно, к стабилизации активной формы фермента.
На втором этапе имеет место конденсация карбамоилфосфата и орнитина с образованием цитруллина - реакцию катализирует орнитинкарбамоилтрансфераза (карбамоилфосфат: L-орнитин-карбамоилтрансфераза):
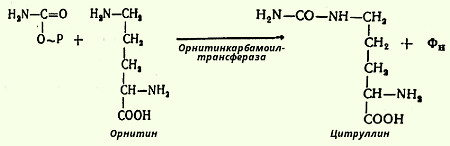
В следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспарагиновой кислоты с образованием аргининоянтарной кислоты (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининоянтарная кислота распадается в следующей реакции на аргинин и фумаровую кислоту при участии другого фермента - аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
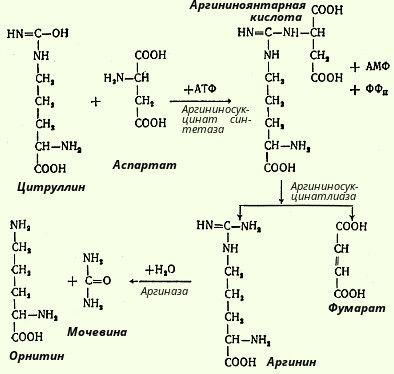
Необходимо учесть, что аргиназа содержится в печени тех животных, которые экскретируют мочевину как основной и конечный продукт азотистого обмена с мочой; в печени птиц, например, аргиназа отсутствует, поскольку птицы выделяют мочевую кислоту вместо мочевины. Таким образом, орнитиновый цикл мочевинообразования с учетом новых данных может быть представлен в следующем виде (рис. 103).
Ниже приведена, кроме того, суммарная реакция синтеза мочевины без учета промежуточных продуктов:
СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн
ΔG° = - 40 кДж
Поскольку имеет место снижение свободной энергии, процесс всегда протекает в направлении синтеза мочевины.
Из представленных выше уравнений нетрудно видеть, что один из атомов мочевины имеет своим источником свободный аммиак или амидную группу глутамина (через карбамоилфосфат); второй атом азота мочевины имеет своим источником аспарагиновую кислоту, а не свободный аммиак, образующийся главным образом в процессе глутаматдегидрогеназной реакции. Что касается пополнения запасов аспарагиновой кислоты, то в этом процессе участвуют три сопряженные реакции: сначала фумаровая кислота под действием фумаразы, катализирующая присоединение молекулы Н2O, превращается в яблочную кислоту, которая подвергается окислению при участии специфической малатдегидрогеназы с образованием щавелевоуксусной кислоты; последняя трансаминируется с глутаминовой кислотой, давая аспарагиновую кислоту.
Суммируя известные фактические данные о механизмах обезвреживания аммиака в организме, можно прийти к следующему заключению. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования α-кетокислот или реакции трансреаминирования. Аммиак используется в биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата (см. ниже), выделяется из организма значительная часть азота аминокислот. Однако наибольшее количество аммиака идет на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет 15 г азота; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина - около 5% (строго постоянная величина), аммонийных солей - 3%, мочевой кислоты - 1% и на другие формы - около 6%.
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Аммонийтелический тип, когда главным конечным продуктом азотистого обмена служит аммиак, свойственен преимущественно рыбам. Уротелический тип обмена, когда основным конечным продуктом обмена белков является мочевина, характерен для человека и животных. И, наконец, урикотелический тип, когда главным конечным продуктом обмена является мочевая кислота, имеет место у птиц и рептилий.
лицин и серин являются источниками одноуглеродных радикалов.
Глицин – заменимая аминокислота. Он широко используется в тканях в следующих процессах:
синтез гема;
синтез креатина;
синтез пуриновых нуклеотидов;
входит в состав глютатиона;
участвует в процессах детоксикации;
переходит в углеводы через образование пирувата;
служит источникомметиленового радикала (СН2 =).
Метиленовый радикал используется для биосинтетических процессов в комплексе с активной формой фолиевой кислоты - тетрагидрофолевой кислотой (ТГФК). Основная реакция распада глицина, ведёт к образованию метилен - ТГФК

Серин– заменимая аминокислота. Используется в многочисленных биосинтетических процессах:
синтез фосфолипидов (фосфатидилсерин);
синтез сфингозина и сфинголипидов;
переходит в углеводы через стадию образования пирувата.
источникметиленового радикала;
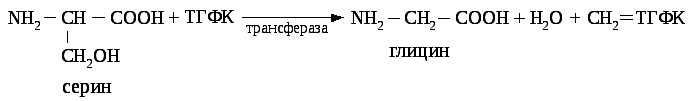
8.10. 1.1. Фолиевая кислота
Фолиевая кислота (Витамин Вс, В9,, антианемический витамин) включает в свой состав птеридин, парааминобензойную кислоту, глютаминовую кислоту. Она содержится в зелёных частях растений, в дрожжах. Суточная потребность в ней составляет до 2 мг. Биологическая роль: в виде ТГФК является переносчиком одноуглеродных радикалов от серина и глицина, использующихся для синтеза нуклеиновых кислот, аминокислот. Фолиевая кислота переходит в ТГФК при участии фермента фолатредуктазы с присоединением 4-х атомов водорода. В клинической практике в качестве противоопухолевых препаратов используют антивитамииы фолиевой кислоты, которые имеют структуру, близкую к птеридину и являются ингибиторами фолатредуктазы, вследствие чего блокируют синтез нуклеиновых кислот в опухолях. В качестве бактериостатических препаратов применяют сульфаниламидные соединения, имеющие структуру, сходную с парааминобензойной кислотой. В силу этого сульфаниламиды блокируют в микроорганизмах синтез фолиевой кислотой, которая является фактором роста микроорганизмов. Авитаминоз фолиевой кислоты проявляется в виде анемии.
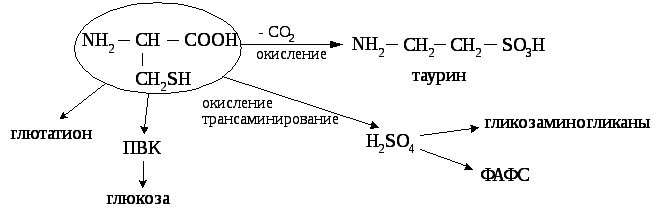
Цистеин и метионин являются источником: серы и метильных групп.
Цистеинпри окислении, декарбоксилировании, трансаминировании переходит в таурин и серную кислоту, входит в состав глютатиона, через стадию пирувата может использоваться для синтеза углеводов.
Таурин используется на синтез парных жёлчных кислот и участвует в развитии нейросетчатки, головного мозга у плода и в раннем детском возрасте. Образующаяся серная кислота используется на синтез кислых гликозаминогликанов. В активной форме в виде ФАФС она участвует в обезвреживании токсичных продуктов в печени
Обмен цистеина
Метионин - незаменимая аминокислота, донатор метильных групп в реакциях метилирования.
В реакциях трансметилирования метионин участвует в активной форме – S+-(СН3) - аденозилметионин (SАМ), образующийся при взаимодействии метионина с АТФ.
Общая схема реакции метилирования различных веществ (R) с участием фермента метилтрансферазы имеет вид:
S+(СН3) - аденозилметионин +R→R-СН3 + аденозилгомоцистеин.
Примеры:
Метионин используется в многочисленных биосинтетических процессах:
синтез холина;
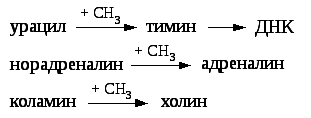
синтез тимина, с последующим включением его в ДНК;
синтез адреналина;
синтез карнитина – переносчика жирных кислот при их β - окислении;
синтез креатина – азотистого вещества мышц;
реакции обезвреживания;
донор серы.
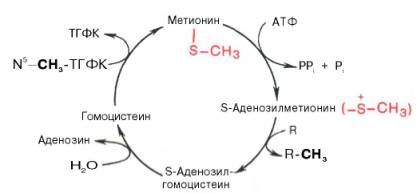
В реакции метилирования аденозилметионин, отдавая СН3–радикал, превращается в аденозилгомоцистеин, который затем распадается на аденозин и гомоцистеин. В последующем гомоцистеин может дальше превращаться двумя способами: при взаимодействии с серином переходит вцистеинили при участии ТГФК и вит. В12 реметилируется вметионин.
Обмен серосодержащих аминокислот
В молекулах белка обнаружены три серосодержащие аминокислоты (ме-тионин, цистеин и цистин), метаболически тесно связанные друг с другом. Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином.
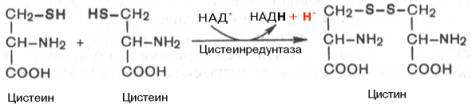
Дисульфидная связь часто образуется между двумя остатками цистеина внутри одной полипептидной цепи или между двумя полипептидными цепями, способствуя тем самым стабилизации молекулы белка. Цистеин является составной частью трипептида глутатиона, сокращенно обозначаемого Г—SH, что подчеркивает функциональную значимость его тио-группы и возможность образования дисульфидной связи окисленного глу-татиона (Г—S—S—Г).
Известно, что многие ферменты содержат в активном центре SH-груп-пы, абсолютно необходимые для каталитической реакции. При их окислении ферменты теряют свою активность. Предполагают, что одной из главных функций глутатиона является сохранение этих ферментов в активной восстановленной форме. Окисленный глутатион может восстанавливаться под действием глутатионредуктазы, используя НАДФН. Кроме того, глутатион может оказывать ингибирующее действие на некоторые белки. В частности, известная реакция инактивации инсулина под действием глутатионинсулинтрансгидрогеназы, в которой SH-глутатион является донором водородных атомов, разрывающих дисульфидные связи между двумя полипептидными цепями молекулы инсулина. Установлена также коферментная функция глутатиона, в частности для глиоксилазы I. Ранее обсуждалось участие глутатиона в транспорте аминокислот через клеточную мембрану.
В процессе катаболизма сера метионина в тканях в основном переходит в серу цистеина, а взаимопревращение цистина в цистеин осуществляется легко. Поэтому проблема окисления серы всех аминокислот практически сводится к окислению цистеина. Главным путем оказался окислительный, включающий окисление цистеина в цистеинсульфиновую кислоту, транс-аминирование последней с α-кетоглутаратом и образование пирувата и сульфита по схеме:
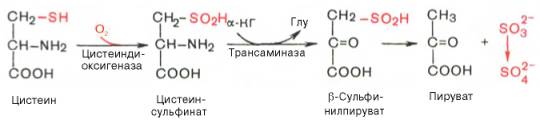
Сульфит затем быстро окисляется в тканях и выводится с мочой в виде нетоксичных сульфатов и эфиросерных кислот. Использование цистеина и продуктов его окисления – цистеинсульфиновой и цистеиновой кислот – в образовании таурина рассмотрено ранее.
Метаболические пути превращения метионина в тканях значительно разнообразнее, чем пути превращения других серосодержащих аминокислот; тем не менее катаболизм метионина осуществляется через цистеин. Это превращение метионина в цистеин оказалось необратимым процессом. Выяснилось также, что углеродный скелет цистеина происходит из другой аминокислоты, а именно серина. Фактическим донором метильных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин – S-аденозилметионин, который образуется в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой.
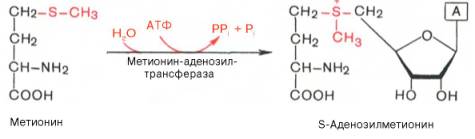
Своеобразие данной реакции заключается в том, что СН3-группа ме-тионина активируется под действием положительного заряда соседнего атома серы. S-аденозилметионин участвует во всех реакциях, где метильная группа используется в биосинтетических реакциях: например, в синтезе адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Образовавшийся после отщепления метильной группы S-аденозилгомоцистеин подвергается гидролизу на аденозин и гомоцистеин; последний используется в синтезе серина (это основной путь превращения) или служит акцептором метильной группы от N5—СН3—ТГФК в синтезе метионина (эту реакцию катализирует гомоцистеинметилтрансфераза), завершая, таким образом, своеобразный цикл активирования метильной группы.
В качестве примера приводим схему биосинтеза креатина, в котором принимают участие три аминокислоты: аргинин, глицин и метионин. Реакция синтеза протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицин-амидинотранс-феразы (КФ 2.1.4.1):
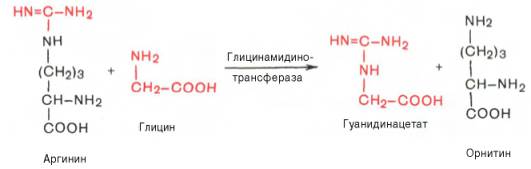
Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы (КФ 2.1.1.2):
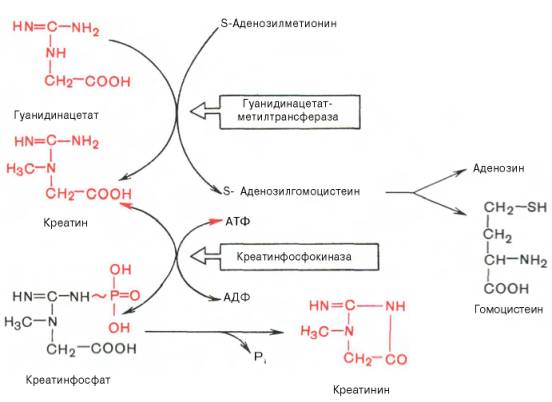
Креатин подвергается фосфорилированию с образованием креатин-фосфата, который после дефосфорилирования (необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Гомоцистеин может вновь превращаться в метионин путем метилирования. Однако основной путь дальнейшего превращения гомоцистеина связан с его использованием в синтезе цистеина, который может быть представлен в виде двух последовательных ферментативных реакций.
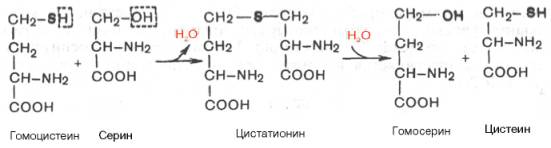
Ферменты, катализирующие синтез и распад цистатионина (циста-тионин-β-синтаза и цистатионаза), содержат ПФ. Цистеин далее подвергается окислению по описанному ранее пути, а гомосерин после транс-аминирования с α-кетоглутаратом превращается в α-кетомасляную кислоту; последняя может также образоваться из цистатионина непосредственно, минуя стадию гомосерина.
Предыдущая страница | Следующая страница |
|
|
 Скачать 292.61 Kb.
Скачать 292.61 Kb.