Химия чт. Это многоатомные спирты содержащие оксогруппу. Являются основными поставщиками энергии. По своему строению углеводы являются многоатомными спиртами с альдегидной или кетоновой группой полигидроксиальдегиды
 Скачать 0.7 Mb. Скачать 0.7 Mb.
|
7. Распад гликогена в тканях. Ферменты, участвующие в этих процессах, лимитирующие стадии. Особенности строения ферментов. Регуляция процесса.РАСПАД ГЛИКОГЕНА (ГЛИКОГЕНОЛИЗ) Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена (рис. 7-25) происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Глико-зидная связь расщепляется с использованием 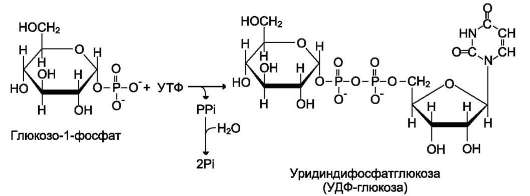 Рис. 7-24. Образование УДФ-глюкозы. неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликоген-фосфорилазой. Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца поли-сахаридной цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением её активного центра.
Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвления глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидроли- 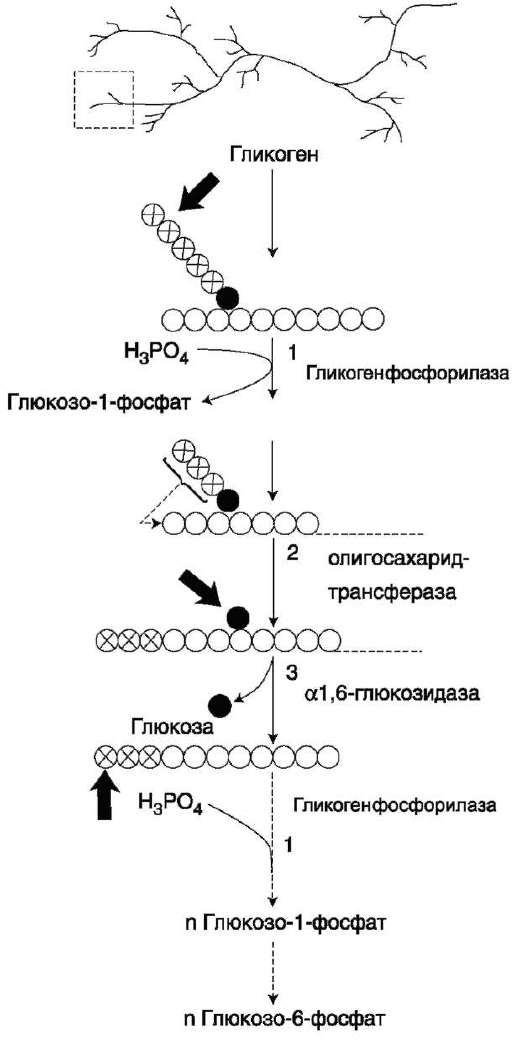 Рис. 7-25. Распад гликогена. В рамке - фрагмент гликогена с точкой ветвления. Закрашенный кружок - глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки - глю-козные остатки в линейных участках и боковых ветвях, связанные а-1,4-гликозидной связью. 1 - гликоген-фосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза. тически отщепляется с помощью а-1,6-глюко-зидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Считают, что перенос трёх остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют «деветвящим» ферментом (от англ. debranching enzyme). Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глю-козо-6-фосфат фосфоглюкомутазой. Далее глю-козо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизо-ваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в про- свете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем. 8. Особенности запасания и мобилизации глюкозы в печени и скелетной мускулатуре. Сопряженность этих процессов с питанием и физическими нагрузками.РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА В ПЕЧЕНИ Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона - изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на пос-табсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «ин-сулин-глюкагоновый индекс». В постабсорбтивном периоде инсулин-глюкагоновый индекс сни-
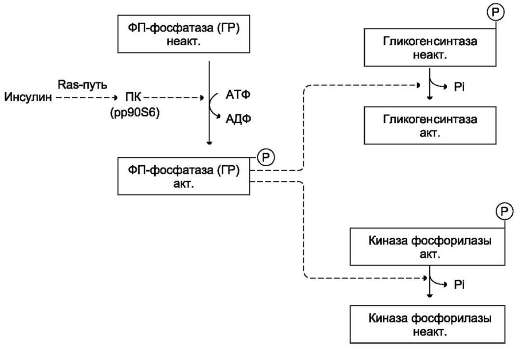 Рис. 7-28. Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) фосфопротеинфосфатаза гранул гликогена. ПК (рр90S6) - протеинкиназа, активируемая инсулином. жается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона. Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогено-лиза) или синтеза глюкозы из других веществ - глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфос-форилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне. Адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) «топливом» в экстремальной ситуации. Эффект адреналина в печени обусловлен фосфорилированием (и активацией) гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия (рис. 7-29). Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени (рис. 7-30). Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с а1-рецепторами «включает» инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем - фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин вли- 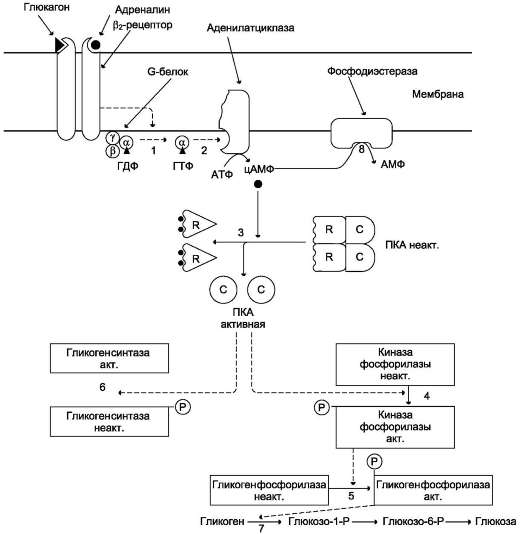 Рис. 7-29. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в a-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6 - протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс а-субъединица-ГТФ затем распадается, а-, β- и γ-субъединицы G-белка реассоциируются. 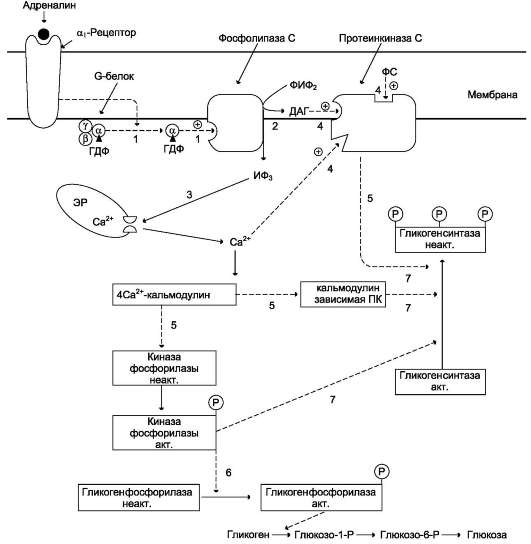 Рис. 7-30. Регуляция синтеза и распада гликогена в печени адреналином и Са2+. ФИФ2 - фосфатидили-нозитолбисфосфат; ИФ3 - инозитол-1,4,5-трифосфат; ДАГ - диацилглицерол; ЭР - эндоплазматический ретикулум; ФС - фосфодитилсерин. 1 - взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 - фосфолипаза С гидроли-зует ФИФ2 на ИФ3 и ДАГ; 3 - ИФ3 активирует мобилизацию Са2+ из ЭР; 4 - Са2+, ДАГ и фосфодитилсерин активируют протеинкиназу С. 5 - протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулинзависимые протеинкиназы; 6 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 - активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеин-киназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
яет на обмен гликогена противоположно глюка-гону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом: • снижает уровень цАМФ в клетках, фосфо-рилируя (опосредованно через Ras-путь) и тем самым активируя фосфодиэстеразу цАМФ - фермент, гидролизующий цАМФ с образованием АМФ. Механизм влияния инсулина на уровень цАМФ в клетке подробнее будет изложен в разделе 11; • активирует (через Ras-путь) фосфопроте-инфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фос-фопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фос-форилазы и гликогенфосфорилазу; • индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке. Следует напомнить, что регуля-торным фактором в метаболизме гликогена является также величина Кт глюкокиназы, которая много выше, чем Кт гексокиназы. Смысл этих различий понятен: печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы. Всё это вместе приводит к тому, что инсулин одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, переключая процесс мобилизации гликогена на его синтез. В печени существует и аллостерическая регуляция гликогенфосфорилазы, обеспечивающая внутриклеточные потребности в глюкозе, но гормональные сигналы имеют приоритет над внутриклеточными и преследуют другие физиологические цели. Ранее (см. раздел 6) рассматривалось значение изменения в клетке уровней АТФ, АДФ и АМФ как показателя, отражающего потребности клетки в энергии. Замедление утилизации АТФ сопровождается снижением активности гликогенфосфорилазы и уменьшением скорости распада гликогена. Напротив, увеличение расходования АТФ ведёт к повышению уровня АМФ, активации гликогенфосфорилазы и ускорению распада гликогена. АТФ и АМФ являются ал-лостерическими эффекторами по отношению к гликогенфосфорилазе. Существует также и мета-
болический контроль активности гликогенфос-форилазы. Так, при повышении концентрации глюкозо-6-фосфата активность этого фермента в клетках печени снижается. РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА В МЫШЦАХ Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц (бег или борьба), так и энергозатраты в состоянии покоя. В экстремальных ситуациях в мышечных клетках мобилизация гликогена ускоряется адреналином. Связывание адреналина с β-рецептора-ми, ассоциированными с аденилатциклазной системой, приводит к образованию цАМФ в клетке, а затем фосфорилированию и активации киназы фосфорилазы и гликогенфосфорилазы (рис. 7-31). Образование цАМФ, стимулированное адреналином, служит сигналом к увеличению производства энергии в результате ускорения расщепления гликогена. Именно в ходе распада, образованного из гликогена глюкозо-6-фосфата, синтезируется АТФ. Инактивация гликогенсинтазы под влиянием адреналина в мышечных клетках проходит так же, как и в печени. В состоянии покоя при низких концентрациях адреналина в крови гликогенфосфорилаза мышц находится в дефосфорилированном - неактивном состоянии (форма В), но распад гликогена всё-таки происходит. Это объясняется тем, что гликогенфосфорилаза активируется способом, не связанным с её фосфорилированием, так как уровень цАМФ в клетке низкий. В данной ситуации происходит аллостерическая активация гликогенфосфорилазы В. Активаторами фермента служат АМФ и Н3РО4, образующиеся в клетке при распаде АТФ (рис. 7-31, путь 1). При умеренных мышечных сокращениях, т.е. в ситуации, не требующей участия в регуляции цАМФ, аллостерическим способом активируется киназа фосфорилазы (рис. 7-31, путь 2). В данном случае аллостерическими эффекторами служат ионы Са2+, концентрация которых резко возрастает при сокращении мышц в ответ на сигнал от двигательного нерва. Активность фермента снижается сразу же, как только кон-
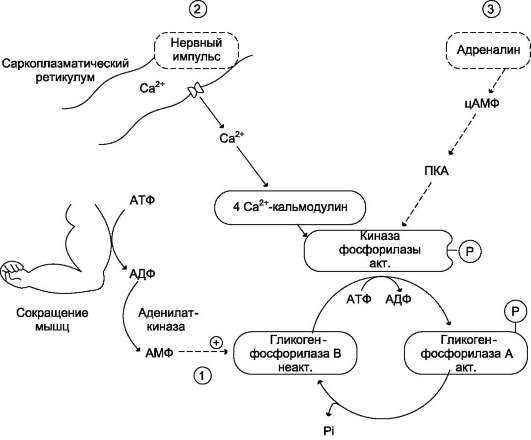 Рис. 7-31. Активация гликогенфосфорилазы мышц. 1 - аллостерическая активация гликогенфосфорилазы В. В процессе мышечного сокращения происходит разрушение АТФ с образованием АМФ, который является аллостерическим активатором гликогенфосфорилазы В; 2 - нервный импульс инициирует освобождение Са2+ из саркоплазматического ретикулума. Са2+ образует комплекс с кальмодулином, способный активировать киназу фосфорилазы; 3 - активация гликогенфосфорилазы адреналином через аденилатциклазную систему. центрация Са2+ в клетке уменьшается после поступления сигнала к расслаблению мышц. Таким образом, роль ионов Са2+ заключается не только в инициации мышечного сокращения, но также в обеспечении его энергозатрат. Активация киназы фосфорилазы с помощью ионов Са2+ опосредована кальмодулином. Каль-модулин в данном случае - прочно связанная субъединица фермента (рис. 7-32). Мышечная киназа фосфорилазы состоит из субъединиц 4 типов: α, β, γ и δ, объединённых в комплекс. Фермент включает 4 таких комплекса. Каталитической активностью обладает γ-субъединица. Субъединицы α и β выполняют регуляторную функцию. Они содержат остатки серина, фос-форилируемые ПК А. δ-Субъединица связывает 4 иона кальция; она идентична белку кальмо- дулину. Связывание ионов кальция вызывает конформационные изменения, что приводит к активации каталитического центра γ-субъеди-ницы, хотя молекула остаётся в дефосфорили-рованном состоянии. В мышцах в период пищеварения, если он совпадает с состоянием покоя, происходит стимуляция синтеза гликогена. Мышечная работа во время пищеварения замедляет процесс синтеза гликогена, так как при этом мышцы используют для окисления глюкозу крови, поступающую из кишечника. В переключении мобилизации гликогена на запасание глюкозы участвует инсулин. Как уже говорилось, глюкоза поступает в мышечные и жировые клетки с помощью глюкозо-транс-портёров ГЛЮТ-4. Транспортёры в отсутствие
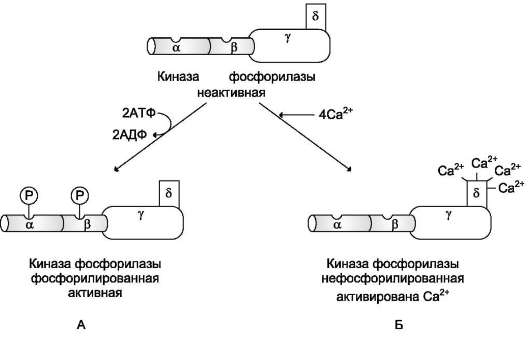 Рис. 7-32. Регуляция активности киназы фосфорилазы. Фермент состоит из 4 идентичных белковых комплексов. Каждый комплекс содержит 4 разных субъединицы α, β, γ, δ. На рисунке показан один из тетрамеров. Каталитической активностью обладает γ-субъединица. а- и β- протомеры выполняют регуляторную функцию, они фосфорилируются при участии ПК А. Кальмодулин - δ-субъединица, прочно связанная с ферментом. А - активация киназы фосфорилазы в результате фосфорилирования; Б - активация киназы фосфорилазы после присоединения Са2+ к кальмодулину. инсулина находятся в цитоплазме клеток, и глюкоза клетками не используется, так как в мембране нет белков-переносчиков. Инсулин стимулирует перемещение ГЛЮТ-4 и встраивание их в мембрану клеток. Механизм подобного влияния инсулина изучен недостаточно, но определены его основные этапы. Цепь событий при стимуляции инсулином потребления глюкозы мышцами и жировыми клетками выглядит следующим образом: • рецептор инсулина (IR) - инсулинстимули-руемая тирозиновая протеинкиназа - обязательный посредник всех действий инсулина (см. раздел 5); • активированный инсулином IR фосфори-лирует специфические цитоплазматические белки - субстраты инсулина (IRS); • фосфорилированный субстрат (в основном IRS-1) соединяется с фосфатидилинозитол-3-киназой (ФИ-3-киназа) и активирует этот фермент; • активная ФИ-3-киназа катализирует фосфо-рилирование по позиции 3 ряд компонентов инозитолфосфатной сигнальной системы, приводящей к стимуляции транслокации ГЛЮТ из цитозоля в плазматическую мембрану; • глюкоза с помощью ГЛЮТ-4 поступает в мышечные клетки и включается в синтез гликогена. Влияние инсулина на скорость синтеза гликогена в мышцах осуществляется посредством изменения активности гликогенсинтазы и гли-когенфосфорилазы - ключевых ферментов, о чём уже говорилось при обсуждении влияния инсулина на метаболизм гликогена в печени. |
