Фагоцитоз. Характеристика клеток, участвующих в реакциях фагоцитоза
 Скачать 108 Kb. Скачать 108 Kb.
|
Процессинг и презентациия эндогенных (синтезируемых на рибосомах клетки) пептидных антигенов.Процессинги презентация эндогенных (синтезированных на рибосомах клетки) антигенов. вирусный или опухольассоциированный белок синтезируется на рибосомах клетки организма человека. Синтезированный полипептид покидает рибосому и подвергается процессингу. Первым этапом процессинга является убиквитированние полипептидов. Убиквитин- низкомолекулярный термостабильный белок, который присоединяется в строго определенных участках полипептида, образуя «метки» для протеолиза. Протеолиз убиквитированных белков происходит в протеасоме (мультипротеиновый ферментный комплекс, содержащий протеолитические ферменты и находящийся в цитоплазме. Кодируется генами локуса LMP, который располагается на б-ой хромосоме рядом с генами MHC II). Процессированные в протеосоме пептиды с помощью транспортных белков ТАР-Гены локуса ТАР находятся на 6-ой хромосоме рядом с генами MHCII. Они кодируют белки (TAP1, TAP2), транспортирующие процессированные белкиз протеосомы в шэр. поступают в ШАР. На рибосомах в ШЭР синтезируются а-цепь и в2-микроглобулин, которые с помощью белков- шаперонов( Молекулярные шапероны регулируют сворачивание синтезированных белков, препятствуют их агрегации.калнексин, калретикулин, тапасин) формируют молекулу МНС класса. В ШЭР пептиды «загружаются» в пептидсвязывающую бороздку молекулы МНС и транспортируются через комплекс Гольджи на поверхность клетки для презентации цитотоксическим CD8 - Т-лимфоцитов. Строение и классы иммуноглобулинов.Антитела - иммуноглобулины, продуцируемые В-лимфоцитами (плазматическими клетками). Мономеры иммуноглобулинов состоят из двух тяжелых (Н-цепи) и двух легких (L-цепи) полипептидных цепей, связанных дисульфидной связью. цепи имеют константные (С) и вариабельные (V) участки. Папаин расщепляет молекулу иммуноглобулина на дв одинаковых антигенсвязывающих фрагмента - Fab (Fragment anligen binding) и Fc (Fragmenl crislalhzable). По типу тяжелой цепи различают 5 классов иммуноглобулинов IgG, IgM, IgA, IgD, IgE. Они состоят из полипептидных цепей. В молекуле иммуноглобулина различают четыре структуры: 1) первичную – это последовательность определенных аминокислот. Она строится из нуклеотидных триплетов, генетически детерминируется и определяет основные последующие структурные особенности; 2) вторичную (определяется конформацией полипептидных цепей); 3) третичную (определяет характер расположения отдельных участков цепи, создающих пространственную картину); 4) четвертичную. Из четырех полипептидных цепей возникает биологически активный комплекс. Цепи попарно имеют одинаковую структуру. Большинство молекул иммуноглобулинов составлено из двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными связями. Легкие цепи состоят или из двух k-цепей, или из двух l-цепей. Тяжелые цепи могут быть одного из пяти классов (IgA, IgG, IgM, IgD и IgE). Каждая цепь имеет два участка: 1) постоянный. Остается постоянным в последовательности аминокислот и антигенности в пределах данного класса иммуноглобулинов; 2) вариабельный. Характеризуется большой непостоянностью последовательности аминокислот; в этой части цепи происходит реакция соединения с антигеном. Каждая молекула IgG состоит из двух соединенных цепей, концы которых формируют два антигенсвязывающих участка. На вариабельном участке каждой цепи имеются гипервариабельные участки: три в легких цепях и четыре в тяжелых. Разновидности последовательности аминокислот в этих гипервариабельных участках определяют специфичность антитела. При определенных условиях эти гипервариабельные области могут также выступать в роли антигенов (идиотипов). В молекуле иммуноглобулина меньше двух антигенсвязывающих центров быть не может, но один может быть завернут внутрь молекулы – это неполное антитело. Оно блокирует антиген, и тот не может связаться с полными антителами. При энзиматическом расщеплении иммуноглобулинов образуются следующие фрагменты: 1) Fc-фрагмент содержит участки обеих постоянных частей; не обладает свойством антитела, но имеет сродство с комплементом; 2) Fab-фрагмент содержит легкую и часть тяжелой цепи с одним антигенсвязывающим участком; обладает свойством антитела; 3) F(ab)Т2-фрагмент состоит из двух связанных между собой Fab-фрагментов. Другие классы иммуноглобулинов имеют такую же основную структуру. Исключение – IgM: является пентамером (состоит из пяти основных единиц, связанных в области Fc-концов), а IgA – димер. 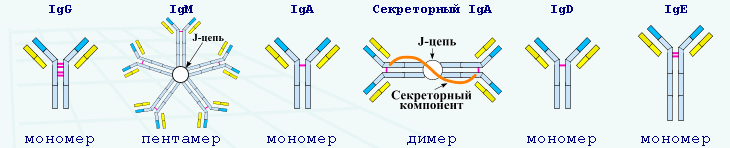 Иммуноглобулины Существует пять классов иммуноглобулинов у человека. 1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент. Свойства иммуноглобулинов G: 1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях; 2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных; 3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации. 2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2. Свойства иммуноглобулинов М: 1) не проникают через плаценту; 2) появляются у плода и участвуют в антиинфекционной защите; 3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент; 4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза; 5) образуются на ранних сроках инфекционного процесса; 6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий. 3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов. Свойства иммуноглобулинов А: 1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче; 2) участвуют в местном иммунитете; 3) препятствуют прикреплению бактерий к слизистой; 4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент. 4. Иммуноглобулины Е – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов. Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа. 5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани. Свойства иммуноглобулинов D: 1) участвуют в развитии местного иммунитета; 2) обладают антивирусной активностью; 3) активируют комплемент (в редких случаях); 4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа; 5) участвуют в аутоиммунных процессах. |
