Расчетная работа по химии. Расчётная работа по химии. Федеральное государственное бюджетное образовательноеучреждение высшего образования
 Скачать 40.16 Kb. Скачать 40.16 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕУЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е.АЛЕКСЕЕВА» Кафедра «Производственная безопасность, экология и химия» Расчётная работа по «Химии» «Вариант №1» Выполнил: Александров А.С. Группа:20-САУЗ Проверил: Профессор Борисов А.В. Нижний Новгород 2022 Часть первая. 1. Напишите термохимическое уравнение, соответствующее табличному значению H0обр(NH3). Сколько тепла выделится, если в результате реакции образуется 2 моль NH3? Решение: Дано: n(NH3)=2 моль Q - ? Решение: Табличному значению H0обр(NH3) соответствует термохимическое уравнение реакции образования аммиака из простых веществ: 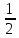 N2(г)+ N2(г)+ 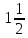 H2(г)= NH3(г); H0х.р.= -46,2 кДж H2(г)= NH3(г); H0х.р.= -46,2 кДжНаходим сколько теплоты выделится, если в результате реакции образуется 2 моль аммиака: 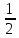 N2(г)+ N2(г)+ 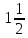 H2(г)= NH3(г); H0х.р.= -46,2 кДж H2(г)= NH3(г); H0х.р.= -46,2 кДжПо уравнению реакции 1 моль 46,2 кДж По условию задачи 2 моль х кДж 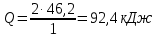 Следовательно, при образовании 2 моль аммиака будет выделяться 92,4 кДж теплоты. Ответ: Q=92,4 кДж. 40. На основании табличных значений G0обр реагентов определить возможность самопроизвольного протекания реакции при стандартных условиях. Укажите знак S0х.р. Ответ обоснуйте. а) С(графит) + СО2(г) = 2СО(г). Решение: G0обр(СО2(г))=-394,4 кДж/моль G0обр(СО(г))=-137,1 кДж/моль ∆G0х.р.=(2∙∆G0обр.(СO(г)))-(1∙(∆G0обр.(СO2(г)))=(2∙(-137,1)-(1∙(-394,4)=120,2 кДж ∆G0х.р. > 0, поэтому реакция при стандартных условиях не протекает самопроизвольно в прямом направлении. Изменение стандартной энтропии реакции будет иметь положительный знак, так как в ходе реакции увеличивается количество газа (до реакции 1 моль, а послее реакции 2 моль), поэтому беспорядок в системе возрастает и, как следствие, энтропия увеличивается. Также можем изменение энтропии подтвердить произведя соответствующий расчёт: S0(СO2(г))=213,7 Дж/моль∙K S0(СO(г))=197,5 Дж/моль∙K S0(С(графит))=5,7 Дж/моль∙K ∆S0х.р.=(2∙∆S0(СO(г)))-(1∙(∆S0(СO2(г))+1∙S0(С(графит)))= =(2∙197,5)-(1∙213,7+1∙5,7)=175,6 Дж/К=0,1756 кДж/моль. 41. Равновесие в гетерогенной системе С(графит) + 2 Cl2(г) = CCl4(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Cl2] = 0,8, [CCl4] =0,3. Рассчитать начальную концентрацию хлора. В каком направлении сместится равновесие в данной системе при увеличении давления? Решение: Дано: [Cl2]равн.=0,8 моль/л [CCl4]равн.=0,3 моль/л [Cl2]нач. - ? Решение: Находим изменение концентрации хлора к моменту установления химического равновесия: Из уравнения реакции С(графит) + 2 Cl2(г) = CCl4(г) видим, что на образование 1 моль ССl4 расходуется 2 моль хлора. Следовательно, на образование 0,3 моль ССl4 расходуется 0,6 моль хлора. Таким образом, изменение концентрации хлора составило ∆[Cl2]=0,6 моль/л. Находим начальную концентрации хлора: [Cl2]нач.=[Cl2]равн.+∆[Cl2]=0,8+0,6=1,4 моль/л. Ответ: [Cl2]нач.=1,4 моль/л. Согласно принципу Ле Шателье при увеличении давления равновесие будет смещаться в сторону уменьшения количества вещества газа, то есть вправо (слева 2 моль газа, а справа 1 моль газа). 63. Для реакции 2Fe(к) + 3 H2O(г) = Fe2O3(к) + 3H2(г), H0х.р. = 35,4 кДж. 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) указать, как влияют на концентрацию водорода в равновесной смеси: а) увеличение давления; б) увеличение концентрации водяного пара? Решение: 1) Запишем математические выражения константы равновесия для реакции 2Fe(к) + 3H2O(г) = Fe2O3(к) + 3H2(г), H0х.р. = 35,4 кДж а) выражение через равновесные концентрации реагентов и продуктов: 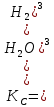 б) через парциальные давления реагентов и продуктов: 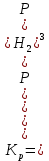 Взаимосвязь Кр и Кс устанавливается согласно уравнению Кр = Кс(RT)∆n, где ∆n- разность сумм стехиометрических коэффициентов продуктов реакции и исходных веществ, находящихся в газообразном состоянии Для реакции 2Fe(к) + 3H2O(г) = Fe2O3(к) + 3H2(г), ∆n=3– 3 =0. Следовательно, взаимосвязь будет иметь вид Кр=Кс(RT)0, то есть Кс и Кр будут иметь одинаковые значения. 2) Согласно принципа Ле Шателье: а) при увеличении давления равновесие не смещается, так как слева и справа в уравнении химической реакции одинаковые количества газов (слева 3 моль H2O(г) и справа 3 моль H2(г)), поэтому концентрация водорода не будет изменяться в связи со смещением равновесия, но она будет увеличиваться, так как система сжимается и, следовательно, увеличиваются концентрации газов, в том числе и водорода; б) при увеличении концентрации водяного пара равновесие смещается в сторону его расходования, то есть в сторону протекания прямой реакции и, следовательно, образования водорода, поэтому концентрация водорода будет возрастать. 77. Будут ли протекать реакции между растворами следующих электролитов: 1) K2CO3 и HCl; 2) KNO3 и Na2S; 3) CdSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. Решение: 1) K2CO3+2HCl=2KCl+H2O+CO2↑ 2K++CO32-+2H++2Cl-=2K++2Cl-+H2O+CO2↑ 2H++CO32-=H2O+CO2↑ Реакция протекает до конца, так как образуется газ СО2 и слабый электролит H2O. 2) KNO3+Na2S≠ реакция не протекает до конца, так как все вещества сильные электролиты. 3) CdSO4+2NaOH=Cd(OH)2↓+Na2SO4 Cd2++SO42-+2Na++2OH-=Cd(OH)2↓+2Na++SO42- Cd2++2OH-=Cd(OH)2↓ Реакция протекает до конца, так как образуется осадок Cd(OH)2. 91. Составить молекулярные уравнения к следующим ионно-молекулярным уравнениям:
Решение: Для образования слабого электролита Н2О к нерастворимому гидроксиду железа (ІІ) необходимо прилить раствор кислоты. Fe(OH)2+2HCl=FeCl2+2H2O 92. Рассчитать рН 0,001 М раствора NaOH. Решение: Дано: С(NaOH)=0,001 M рН - ? Решение: Гидроксид натрия – сильный электролит, поэтому в водном растворе диссоциирует полностью. Находим концентрацию ионов ОН- в растворе щелочи: NaOH↔Na++OH- По уравнению диссоциации 1 моль 1моль По условию задачи 0,001 моль х моль 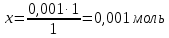 Следовательно, [OH-]=0,001 моль/л. Находим рОН раствора щелочи: рОН=-lg[OH-] рОН=-lg0,001 рОН=3 Находим рН раствора гидроксида натрия: рН+рОН=14 рН=14-рОН рН=14-3=11 Ответ: рН раствора гидроксида натрия равен 11. 111. Определить растворимость в моль/л и г/л следующих труднорастворимых соединений:
Решение: ПР(BaSO4)=1,1∙10-10 S(BaSO4) в моль/л и в г/л - ? Решение: В насыщенном растворе BaSO4 устанавливается гетерогенное равновесие осадок-раствор: BaSO4 (к) ↔ Ba2+ (р-р) + SO42- (р-р). Обозначим растворимость BaSO4 через S моль/л. Тогда в насыщенном растворе данной соли концентрация ионов составит [Ba2+]=[SO42-]=S моль/л. Отсюда ПР(BaSO4)=[Ba2+][SO42-]=S∙S=S2. Находим растворимость сульфата бария: 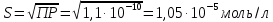 Зная, что молярная массу сульфата бария равна 233 г/моль находим растворимость в г/л: 1,05∙10-5∙233=2,45∙10-3 г/л Ответ: S(BaSO4)= 1,05∙10-5 моль/л; S(BaSO4)= 2,45∙10-3 г/л. 112.Образуется ли осадок труднорастворимого соединения при смешивании равных объемов растворов следующих электролитов указанной концентрации:
Решение: Дано: ПР(AgNO3)=1,78∙10-10 С(AgNO3)=C(NaCl)=0,004 M Образуется ли осадок ? Решение: В растворе протекает реакция ионного обмена, которая может привести к образованию осадка: AgNO3+ NaCl = AgCl ↓+NaNO3 Ag++ Cl-= AgCl↓ Находим концентрации ионов Ag+ и Cl- в исходных рас творах: AgNO3 ↔ Ag+ + NO3- По уравнению реакции 1 моль 1 моль По условию задачи 0,004 моль 0,004 моль Следовательно, [Ag+]=0,004 моль/л. NaCl ↔ Na++ Cl- По уравнению реакции 1 моль 1 моль По условию задачи 0,004 моль 0,004 моль Следовательно, [Cl-]=0,004 моль/л. При смешивании равных объёмов растворов концентрации ионов уменьшаются в два раза: 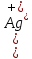 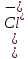 Находим произведение концентраций в образовавшемся растворе: 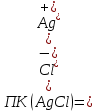 Сравним произведение растворимости и произведение концентраций AgCl: ПК(AgCl) > ПР(AgCl), поэтому при смешивании равных объёмов 0,004 М растворов AgNO3 и NaCl образуется осадок. Часть вторая 1. Окислительно-восстановительная реакция выражается ионным уравнением. Укажите, какой ион является окислителем, какой – восстановителем. Составьте электронные и молекулярные уравнения. 48. Cu2O + H+ + NO3- Cu2+ + NO + H2O Решение: Составим уравнения полуреакций окисления и восстановления для данной химической реакции:
3Cu2O + 14HNO3→ 6Cu(NO3)2 + 2NO + 7H2O HNO3 – окислитель, ион NO3- присоединяет три электрона и восстанавливается до NO. Cu2O – восстановитель, медь отдаёт два электрона (каждый атом меди по одному) и окисляется до иона Cu2+. 2. Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов. 36. Al| Al+3 (2 моль/л ) || Cr+2 (0,01 моль/л )|Cr Решение: Сравним стандартные электродные потенциалы электродов: E0Al3+/Al=-1,663 B E0Cr2+/Cr=-0,913 B Алюминий имеет стандартный электродный потенциал равный -1,663 В. Он меньше, чем стандартный электродный потенциал хромового электрода, поэтому алюминий выступает в роли анода, а хромовый электрод в роли катода. Схема гальванического элемента имеет вид: A(-) Al| Al+3 (2 моль/л ) || Cr+2 (0,01 моль/л )|Cr (+)K Следовательно, на электродах протекают следующие процессы: А(-): Al0 - 3 e- = Al3+ 2 окисление 6 К(+): Cr2+ + 2 e- = Cr0 3 восстановление Суммарная токообразующая реакция: 2Al0+3Cr2+→ 2Al3++ 3Cr0 Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста: Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы алюминия и хрома, опущенные в растворы их солей заданной концентрации: EAl3+/Al=E0Al3+/Al+ 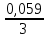 ∙lg 2=-1,663+0,02·0,3=-1,657 B ∙lg 2=-1,663+0,02·0,3=-1,657 BECr2+/Cr=E0Cr2+/Cr+ 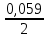 ∙lg 0,01=-0,913+0,0295·(-2)=-0,972 B ∙lg 0,01=-0,913+0,0295·(-2)=-0,972 BДля определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим: ЭДС=Eкатода- Eанода=ECr2+/Cr - EAl3+/Al=(-0,972)-(-1,657)=0,685 В 3.Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на анде при электролизе растворов электролитов, если время электролиза 20 минут, а сила тока I=2А. Какие вещества будут выделяться на электродах при замене инертного анода на металлический, указанный в задании?
Решение: Рассмотрим электролиз водного раствора хлорида кобальта (II) с нерастворимым анодом. Рассчитает электродные потенциалы выделения водорода и кислорода на электродах с учётом перенапряжения: Выделение водорода протекает в перенапряжением, для графита оно равно 0,78 В, поэтому 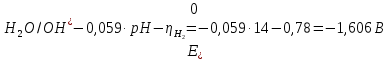 . .Выделение кислорода протекает также с перенапряжением, для графита оно равно 1,17 В, поэтому 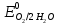 =1,23-0,059∙рН+ =1,23-0,059∙рН+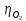 =1,23-0,059∙0+1,17=2,4 В). =1,23-0,059∙0+1,17=2,4 В).СoCl2↔Co2++ 2Cl- K(-): Co2+, Н2О A(+): Cl-, Н2О 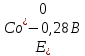 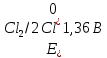 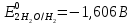 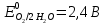 Так как 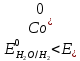 , Так как , Так как 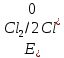 < <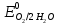 , то , топроисходит восстановление ионов протекает окисление ионов Cl-: Co2+: Co2++2e-→Co 2Cl- -2e-→Cl2 Суммарное уравнение электролиза: CoCl2→ Co + Cl2 Рассмотрим электролиз водного раствора хлорида кобальта (II) c кобальтовым анодом. Рассчитает электродные потенциалы выделения водорода и кислорода на электродах с учётом перенапряжения: Выделение водорода протекает в перенапряжением, для графита оно равно 0,78 В, поэтому 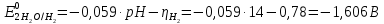 . .Выделение кислорода на кобальте протекает с нулевым перенапряжением, поэтому потенциал будет равен 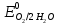 =1,23-0,059∙рН=1,23-0,059∙0=1,23 В) =1,23-0,059∙рН=1,23-0,059∙0=1,23 В)СоCl2↔Со2++ 2Cl- K(-): Co2+, Н2О Со(+): Cl-, Н2О 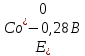 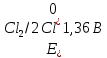 ; ; 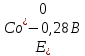 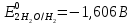 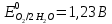 Так как 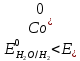 , Так как , Так как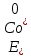 < < 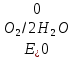 , то , топроисходит восстановление протекает процесс окисления кобальтового ионов Co2+: анода: Co2++2e-→ Co Co0-2e-→ Co2+ Cледовательно, кобальтовый анод растворяется. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: 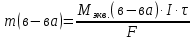 , , 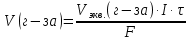 m - масса образовавшегося вещества, г; V – объём образовавшегося газа, л; Мэкв.- молярная масса эквивалента вещества, г/ моль; Vэкв. – эквивалентный объём газа, л/моль; I - сила тока, А; t - время электролиза, с; F - константа Фарадея (96500 Кл/моль). Находим массу кобальта, которая выделится на катоде и объём хлора, который выделится на аноде в течении 20 минут (1200 секунд) при пропускании тока силой 2 А с выходом по току 100%: 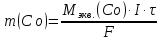 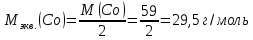 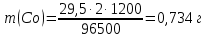 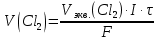 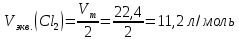 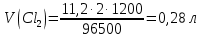 7. Объясните, почему железо, менее активный металл, чем алюминий, в атмосферных условиях корродирует с большей скоростью? Решение: Наличие на поверхности металла тонких пленок малорастворимых соединений - оксидов, гидроксидов, солей или их смесей влияет на скорость и устойчивость их к коррозии. Эти пленки блокируют поверхность металла, приводя его в пассивное состояние. Например, скорость коррозии алюминия (Е0=-1,663 В) в атмосферных условиях значительно меньше скорости коррозии железа (Е0=-0,44 В), хотя стандартный электродный потенциал алюминия более отрицателен, чем у железа. Это связано с тем, что на поверхности алюминия имеется плотная, хорошо сцепленная с поверхностью алюминия оксидная пленка Al2O3, препятствующая переносу электронов, а у железа оксидная пленка рыхлая и непрочная. Следовательно, в нейтральной среде (чистая вода с растворённым в ней кислородом) алюминий не будет подвергаться коррозии, а железо будет корродировать. Таким образом, скорость коррозии железа будет больше. 25. В чем заключается сущность протекторной защиты? Приведите примеры защиты железа в электролите, содержащим растворенный кислород. Составьте уравнения катодного и анодного процессов. Решение: Протекторная защита – это соединение металлического изделия с более активным металлом, который имеет меньший стандартный электродный электродный потенциал. E0Fe2+/Fe=-0,44 B Для железа протекторами могут быть металлы, которые соответствуют условию E0Ме2+/Ме<-0,44 B Например, цинк (E0Zn2+/Zn=-0,762 B), алюминий (E0Al3+/Al=-1,663 B), магний (E0Mg2+/Mg=-2,363 B) и т.д. Рассмотрим коррозионные процессы железного изделия при контакте с магниевым протектором в нейтральной среде с растворенным кислородом. Чтобы определить какой металл выступает в роли анода, а какой в роли катода сравним стандартные электродные потенциалы металлов E0Mg2+/Mg=-2,363 B E0Fe2+/Fe=-0,44 B Поскольку E0Mg2+/mg < E0Fe2+/Fe, то магний – анод, а железо – катод. Схема коррозионного гальванического элемента с кислородной деполяризацией в нейтральной среде: A(-) Mg|H2O, O2 |Fe (+)K Электродные процессы, протекающие в морской воде с доступом кислорода: А(-): Mg0 – 2ē → Mg2+ 2 процесс окисления 4 K(+): 2Н2О + О2 + 4ē → 4ОН– 1 процесс восстановления Суммарная реакция коррозии: 2Mg+2Н2О + О2 → 2Mg(ОН)2 Образующиеся ионы магний связываются с гидроксид-ионами, с образованием гидроксида магний: Mg(ОН)2 – продукт коррозии в нейтральной среде с доступом кислорода. | |||||||||||||||||||||||
