Биохимия. Ферменты. реферат биохимия ферменты. Ферменты. Активаторы. Регуляция активности ферментов Миразова А. А. 162 группа 1 курс
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования "Тюменский Государственный Медицинский Университет" Министерства Здравоохранения Российской Федерации (ФГБОУ ВО Тюменский ГМУ Минздрава России) Реферат Дисциплина: Биологическая химия-Биохимия полости рта Тема: Ферменты. Активаторы. Регуляция активности ферментов Выполнила: Миразова А.А. 162 группа 1 курс Стоматологический факультет Проверила: Болдырева Ю.В. Тюмень 2021 СОДЕРЖАНИЕ: СВОЙСТВА ФЕРМЕНТОВ КАК БИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ ВИДЫ АКТИВАТОРОВ РЕГУЛЯЦИЯ ДЕЙСТВИЯ ФЕРМЕНТОВ ОСНОВНЫЕ СПОСОБЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ ЗАКЛЮЧЕНИЕ ИСТОЧНИКИ Свойства ферментов как биологических катализаторов Фермент - от лат. fermentum - закваска; знзим - от греч. эн - внутри, зиме - закваска. Ферменты, или энзимы, - это катализаторы белковой природы, образующиеся и функционирующие во всех живых организмах. Происхождение терминов связано с тем, что первоначально ферментативные процессы были открыты и изучены в бродильном производстве. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многие химические реакции, которые могут с большой скоростью идти при температурах, подходящих для данного организма, т.е. в пределах от 5 до 40 0 С. Чтобы эти реакции с той же скоростью протекали вне организма, потребовались бы высокие температуры и резкие изменения некоторых других условий. Для клетки это означало бы гибель, так как вся работа клетки строится таким образом, чтобы избежать любых сколько-нибудь заметных изменений в нормальных условиях ее существования. Следовательно, ферменты можно определить как биологические катализаторы, т.е. как вещества, ускоряющие реакции. Они абсолютно необходимы, потому что без них реакции в клетках протекали бы слишком медленно и не могли поддерживать жизнь. Совокупность биохимических реакций, катализируемых ферментами, составляет сущность обмена веществ, являющегося отличительной чертой всех живых организмов. Через ферментативный аппарат, регуляцию его активности происходит и регуляция скорости метаболических реакций, их направленности. Являясь катализаторами, ферменты имеют ряд общих с небиологическими катализаторами свойств: 1. Ферменты не входят в состав конечных продуктов реакции и выходят из нее, как правило, в первоначальном виде, т.е. они не расходуются в процессе катализа (в настоящее время доказано, что некоторые ферменты в конце химической реакции подвергаются модификации и даже распаду, а не освобождаются в неизменном виде, как постулировал Л.Михаэлис). 2. Ферменты не могут возбудить те реакции, протекание которых противоречит законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них. 3. Ферменты не смещают положения равновесия, а лишь ускоряют его достижение. Специфические свойства: 1. Конечно же, по своему химическому строению все ферменты являются белками. 2. Эффективность ферментов намного выше, чем небиологических катализаторов (скорость протекания реакции при участии фермента выше на несколько порядков). 3. Ферменты обладают узкой специфичностью, избирательностью действия на субстраты, т.е. на вещества, превращение которых они катализируют. Высокая специфичность ферментов обусловлена конформационной и электростатической комплиментарностью между молекулами субстрата и фермента и уникальной структурой активного центра фермента, обеспечивающими “узнавание”, высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках. В зависимости от механизма действия различают ферменты с относительной (или групповой) специфичностью и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут существенно отличаться друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет углеводы или жиры. Объясняется это тем, что местом действия пепсина является пептидная -СО-NH- связь. Для действия липазы, катализирующей гидролиз жиров на глицерин и жирные кислоты, таким местом является сложноэфирная связь. Аналогичной относительной специфичностью обладают также некоторые внутриклеточные ферменты, например гексокиназа, катализирующая в присутствии АТФ фосфорилирование почти всех гексоз, хотя одновременно в клетках имеются специфические для каждой гексозы ферменты, выполняющие такое же фосфорилирование. Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые модификации в структуре субстрата делают его недоступными для действия фермента. Стереохимическая специфичность ферментов обусловлена существованием оптически изомерных L- и D-форм или геометрических (цис- и транс- ) изомеров химических веществ. “Так, известны оксидазы L- и D-аминокислот, хотя в природных белках обнаружены только L-аминокислоты. Каждый из видов оксидаз действует только на свой специфический стереоизомер. Наглядным примером стереохимической специфичности является бактериальная аспартатдекарбоксилаза, катализирующая отщепление СО 2 только от L-аспаргиновой кислоты с превращение ее в L-аланин” [1]. 4. Регулируемость ферментов как биокатализаторов. “Через регуляцию ферментативного аппарата осуществляется скоординированность всех метаболических процессов во времени и пространстве, направленное на воспроизведение живой материи, поддержание постоянства внутриклеточной среды, на приспособление к меняющимся внешним условиям” [2]. 5. Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Таким образом, термолабильность, или чувствительность к повышению температуры является одним из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. При 100 0 С почти все ферменты утрачивают свою активность (исключение составляют, очевидно, только один фермент мышечной ткани - миокиназа, которая выдерживает нагревание до 100 0 С). При низких температурах (0 0 С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля. Во всех случаях имеет значение время воздействия соответствующей температуры. В настоящее время для пепсина, трипсина и ряда других ферментов доказано существование прямой зависимости между скоростью инактивации фермента и степенью денатурации белка. На термолабильность ферментов определенное влияние оказывают концентрация субстрата, рН среды и другие факторы. 6. Зависимость активности ферментов от рН среды. Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей в основном выработанным в процессе эволюции физиологическим значением рН среды 6.0 - 8.0. рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляет пепсин, рН-оптимум которого равен 2.0. Объясняется это тем, что пепсин входит в состав желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН-оптимум аргиназы лежит в сильно щелочной зоне (около 10.0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды. Влияние изменений рН среды на молекулы фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина и др.). При разных значениях рН среды активный центр может находиться в частично ионизированной или в неионизированной форме, что сказывается на третичной структуре белка и соответственно формировании активного фермент-субстратного комплекса. Кроме того, имеет значение и состояние ионизации субстратов и кофакторов. активатор синтез фермент метаболический ВИДЫ АКТИВАТОРОВ 1. Вещества, влияющие на область активного центра. К ним относятся ионы металлов (Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ и др.). В ряде случаев ионы металлов выполняют функцию кофактора фермента. В других случаях они способствуют присоединению субстрата к активному центру фермента. Ионы металлов оказываются активаторами только в условиях дефицита их в организме. 2. Аллостерические эффекторы, которые связываются с аллостерическим (регуляторным) участком апофермента. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению структуры активного центра, что сказывается на связывании и превращении субстрата в активном центре. При этом активность фермента либо увеличивается (это аллостерические активаторы), либо уменьшается (это аллостерические ингибиторы). Аллостерическими эффекторами ферментов наиболее часто выступают различные метаболиты, а также гормоны, ионы металлов, нуклеозиды - АТФ, АДФ, АМФ. 3. Вещества, вызывающие модификации, не затрагивающие активный центр фермента. Возможно несколько вариантов таких модификаций: - активация путём присоединения специфической модифицирующей группы к молекуле фермента. Пример: регуляция активности липазы, этом случае фосфатная группа присоединяется к гидроксильным группам аминокислот, находящихся в белковой части фермента. Отрицательно заряженные фосфатные группы могут разрывать слабые водородные и ионные связи в третичной структуре белка-фермента и влиять на конформационное состояние его активного центра. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакции присоединения фосфатной группы катализируют ферменты протеинкиназы, а отщепления – фосфатазы. Активность этих ферментов в свою очередь находится под контролем гормональной системы. - активация путёмперехода неактивного предшественника - профермента в активный фермент за счёт частичного протеолиза. Некоторые ферменты синтезируются в клетке первоначально неактивными и после секреции из клетки переходят в активную форму. Неактивные предшественники называются проферменты (зимогены). Под действием активатора происходит частичный гидролиз профермента с отщеплением от него неактивного пептида, в результате чего открывается активный центр. Так происходит активация ферментов желудочно-кишечного тракта, переваривающих белки пищи. Например, фермент пепсиноген, синтезированный в клетках желудка, затем в просвете желудка под действием соляной кислоты превращается в активный пепсин путём удаления неактивного участка полипептидной цепи. -активатор вызывает диссоциацию субъединиц фермента, имеющего четвертичную структуру(отщепление одной из субъединиц фермента). РЕГУЛЯЦИЯ ДЕЙСТВИЯ ФЕРМЕНТОВ В живой клетке скорость ферментативных реакций находится под строгим контролем, что позволяет каждой метаболической цепочке реакций постоянно изменяться, приспосабливаясь к меняющимся потребностям клетки в продукте.
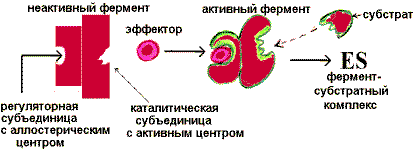
В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом. Существует несколько способов регуляции действия ферментов: 1) изменение активности фермента при его постоянной концентрации; 2) изменение концентрации фермента, обычно в результате ускорения (индукции) или торможения (репрессии) синтеза фермента. ОСНОВНЫЕ СПОСОБЫ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ Активность ферментов в реакции определяется также присутствием в среде активаторов и ингибиторов, которые соответственно повышают или тормозят реакцию. Многие ферменты синтезируются в организме в неактивном состоянии. В частности, это относится к протеолитическим ферментам, синтез которых непосредственно в активном состоянии вызывал бы расщепление белков синтезирующего эти ферменты органа. Активаторы увеличивают скорость ферментативной реакции, способствуя образованию активного центра, и наиболее часто эту роль выполняют металлы, такие, как Mn2+, Mg2+,Zn2+, Co2+. Активация аллостерических ферментов, которые состоят из субъединиц, является важнейшим процессом контроля полиферментных систем. Обычно она достигается за счет их взаимодействия с различными органическими соединениями. 1. Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей. 2. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации.
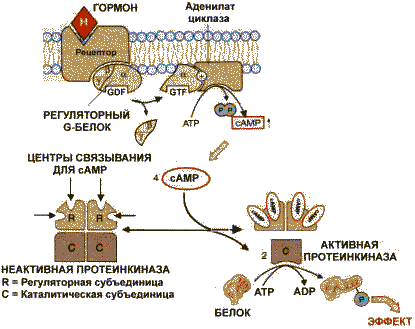
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы. 3. Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТРс АМР + Н4Р2О7 Аденилатциклазная система. Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую регуляторную систему.
С помощью этой системы в клетку передаются сигналы из внеклеточной среды, и в нужном направлении изменяется метаболизм клетки. Внеклеточным вестником сигнала могут быть разные молекулы, в том числе и гормоны. Эти молекулы не проникают внутрь клетки, но «узнаются» мембранными рецепторами. При активации аденилатциклазы происходят следующие этапы:
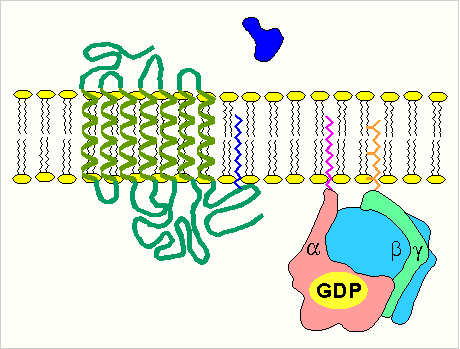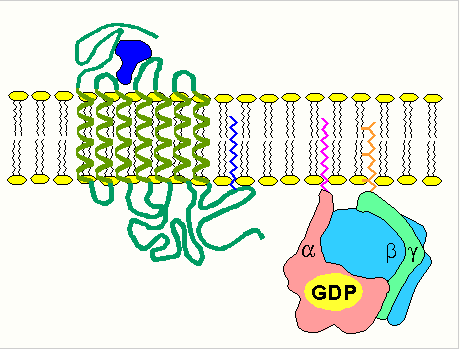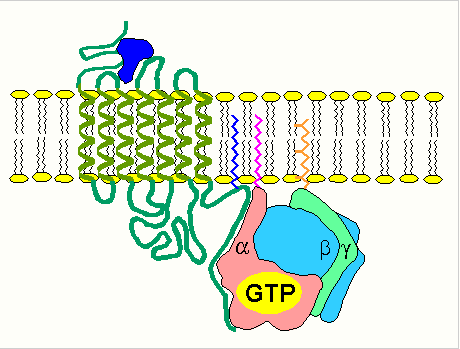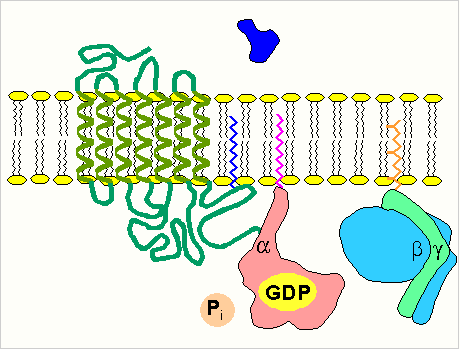
изменение конформации рецептора после присоединения к нему сигнальной молекулы и увеличение его сродства к регуляторному G-белку. В результате образуется комплекс рецептора и протомеров G-белка; образование этого комплекса приводит к изменению конформации a -протомера G-белка, который теряет сродство к GDP и происходит замена GDP на GTP. В результате комплекс протомеров G-белка распадается; a -протомер взаимодействует с аденилатциклазой, что ведет к изменению ее конформации и как следствие этого - активации; после этого аденилатциклаза катализирует синтез cAMP, который в свою очередь активирует cAMP-зависимую протеинкиназу. Активация последней связана с диссоциацией комплекса входящих в нее протомеров после присоединения cAMP. Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке. 4. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца: энтеропептидаза трипсиногентрипсин + Val-(Acn) -Lys Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент. ЗАКЛЮЧЕНИЕ Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути (последовательного превращения одних веществ в другие), достаточно регулировать количество молекул фермента или их активность. Во многих ситуациях действие ферментов становится необходимым увеличить, т. е. совершить активацию ферментов. Активаторы — разнообразные вещества органической и неорганической природы, которые повышают скорость ферментативных реакций. ИСТОЧНИКИ: https://referatbank.ru/referat/preview/9091/referat-opredelenie-aktivnosti-fermentov.html https://otherreferats.allbest.ru/chemistry/00732894_0.html https://studfile.net/preview/4028609/page:8/ АА |