Ферменты Сходства и различия ферментов и катализаторов небиологической природы
 Скачать 1.11 Mb. Скачать 1.11 Mb.
|
  Ферменты Сходства и различия ферментов и катализаторов небиологической природы Ферменты по ряду свойств напоминают катализаторы небиологической природы.
 Ферменты обладают рядом свойств, отличающих их от катализаторов небиологической природы (специфические свойства ферментов)
(Т = 40–50С; нейтральный pH, атмосферное давление и др.), в жестких условиях не могут работать из-за денатурации их молекул
Номенклатура и классификация ферментов
Окисление янтарной кислоты (сукцинат) под действием фермента Сукцинатдигидрогеназа образуется тумаровая кислота и ФАДН2 Атомы водорода переносятся на восстановление ФАД 
Субстрат: субстрат – характер реакции +аза (субстраты, которые участвуют в реакции (сукцинат и ФАД), характер реакции произошла оксидоредукция – окисление и восстановление) Н-р: Сукцинат: ФАД – оксидоредуктаза Международная классификация ферментов по типу катализируемой реакции

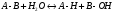


 Международная классификация ферментов Классы Подклассы - уточнение типа катализируемой реакции Подподклассы – с дальнейшим уточнением характера катализируемой реакции Индивидуальные ферменты,имеющие индивидуальный порядковый номер 1 пример:  2 пример: 1.1.1.27 – Лактатдегидрогеназа (ЛДГ) Катализирует реакцию: Химическая природа ферментов Белки – в основном РНК (около 20) – рибозимы – сшивание и расщепление молекул РНК Ферменты
Совокупность апофермента и кофермента называется ХОЛОФЕРМЕНТ АПОФЕРМЕНТ не обладает каталитической активностью совсем Один КОФАКТОР может обладать слабой каталитической активностью Но в этом случае специфичность катализа очень низкая, только комплекс апофермента и кофактора обладает высокой каталитической активностью и специфичностью действия Кофакторы по природе делят:
ФМН- флавинмононуктеотид (В2), ФАД - флавинадениндинуклеотид (В2), НАД - Никотинамидадениндинуклеоти́д (PP – витамин В5), НАДФ - Никотинамидадениндинуклеотидфосфа́т (PP), HS-КоА (В3), кобамидные кофакторы (В12) – дезоксиаденозилкоболамин, митинкоболамин
Кофакторы выполняют различные ф-ии
по характеру функционирования и по прочности связывания с апоферментом белковой части кофакторы делят
например, НАД входит в состав очень многих ферментов примеры коферментов: НАД+, АТФ, ТГФК (Тетрагидрофолиевая кислота ) и др А-Х А Ко-Х Ко В-Х В Е1 Е2 принцип работы:
Липоевая кислота, биоцитин, перидоксальфосфат Схема работы:  Проферменты и изоферменты Часть ферментов синтезируется в организме человека в виде неактивных предшественников – проферментов Профермены:
Превращение профермента в фермент осуществляется путем ограниченно избирательного протеолиза, т.е. расщепляется одна пептидная связь, отщепляется ингибиторный пептид, конформация оставшейся полипептидной цепи меняется, в результате на поверхности – активный центр, который обеспечивает катализ (например, превращение протромбина в тромбин) Как правило, в виде профермента синтезируются те ферменты, которые в биологической системе постоянной не нужны, в тоже время при необходимости, они нужны в достаточно большом количестве, это касается ферментов участвующих в свертывании крови, если бы все участники свертывания крови были бы активны, у нас постоянно образовывались бы тромбы, поэтому оптимальным вариантом является наличие профермента, который при необходимости быстро превращается в фермент, и тем самым останавливается кровотечение, т.е. избегается большая кровопотеря Преобразование профермента в ферменты (касающихся свертывания крови) происходит при повреждении стенки сосудов В ряде случает в плазме крови, органах и тканях удается обнаружить 2 или более белка, способных катализировать одну и ту же реакцию, но эти белки отличаются по физико-химическим свойствам Например, фермент лактатдегидрогеназа существует в виде 5 различных белков, они названы: ЛДГ 1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5 если фермент существует в виде изоферментов, то это всегда олигомерный белок, содержащий соответствующие полипептидные цепи, У ЛДГ1 4 одинаковые полипептидные цепи (НННН), у ЛДГ 2 появляется уже новая полипептидная цепь (НННМ), у ЛДГ3 уже полипептидные цепи (ННММ), у ЛДГ4 (НМММ), ЛДГ5 (ММММ) Изоферменты - ферменты, катализирующие одни и те же химические реакции, но различающиеся генетически детерминированной структурой. 1.Оказалось, что некоторые изоферменты, работают в определенных органах и тканях, так предположим ЛДГ1 и ЛДГ2 работают в сердечной мышце, а ЛДГ5, ЛДГ 4 характерны для печени 2.Креатинкеназа (КК) Широко используется для диагностики инфаркта миокарда и диагностики повреждения мышечной ткани Существует 3 изофермента креатинкеназы : ВВ – форма КК типична для головного мозга, МВ – форма КК, характерна для сердечной мышцы ММ – форма КК, характерна для мышечной ткани и мышечной мускулатуры Определяя содержание соответствующих изоферментов в плазме крови, удается диагносцировать определенные патологии, сопровождающиеся деструкцией определенных тканей, и более того контролировать интенсивность, ход проводимого лечения. При правильно проведенном лечении, изоферменты нетипичные для плазмы исчезают из нее. Функциональные центры ферментов, механизм действия ферментов Ускорение химических реакции  Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES) Современный взгляд на механизм действия ферментов базируется на представлении о том, что в процессе своего функционирования ферменты вступают в прямое взаимодействие с субстратами, с образованием нестабильных энцим-субстратных комплексов (ES)
Наличие ES комплексов удалось подтвердить прямыми экспериментальными наблюдениями, пространственная структура некоторых ES-комплексов изучена с помощью рентгеноструктурного анализа, а так же удалось выделить некоторые ES –комплексы в чистом виде Функциональные центры
АКТИВНЫЕ ЦЕНТРЫ Осознание того, что в большинстве случаев в образовании ES –комплекса участвует макромолекула РНК-ферментов и чаще небольшая молекула субстрата, навело на мысль, что в этом белок-лигандном взаимодействии участвует сравнительно небольшой участок поверхности фермента Активный центр – участок поверхности фермента, ответственный за связывание субстрата и его дальнейшие превращения. Взаимодействие фермента с субстратом этапы:
Поверхность любого фермента представляет собой мозаику радикалов АК, Взаимодействие белка с лигандом – специфичное взаимодействие, которое базируется на принципе комплементарности. Специфичность взаимодействия фермента со своим субстратом -лигандом обеспечивается комплементарностью участка поверхности субстрата и активного центра фермента В образовании активного центра принимает участие не более 10-12 АК-ых радикалов, которые определенным образом ориентированы по отношению друг к другу, причем эти АК-ые остатки могут далеко располагаться по ходу полипептидной цепи друг от друга, но при образовании третичной структуры – нативной конформации белка-фермента, они сближаются и формируют пространственную структуру активного центра Например, при образовании активного центра химотрипсина, принимает участие всего 4 АК-ых остатка, это гистидин-57, гистидин-40, серин-195, аспартат 102 В то же время далеко не все имеющиеся в структуре химотрипсина остатки гистидина, серина и аспартата участвуют в образовании активного центра, например, в химотрипсине в образовании активного центра принимает участие только один остаток серина из 26 имеющихся. 2 элемент активного центра К составным элементам активного центра относят участки остова полипептидной цепи, которые удерживают АК-ые радикалы в определенном пространственном расположении друг к другу 3 элемент В активный центр входит кофактор, если фермент представляет собой сложный белок Исключение: ионы металлов, обычно они отличаются в стабилизации третичной или четвертичной структуры В активном центре условно выделяют 2 участка (2 центра)
В связывании субстрата, как и в катализе, важнейщая роль принадлежит функциональным группам, имеющимся в радикалах АК-т, которые образуют активные центры Функциональные группы:
важную роль в связывании субстрата могут иметь гидрофобные радикалы АК-т: валин, глицин, триптофан, метионин и фенилаланин как правило активный центр фермента часто имеет вид углубления или щели на поверхности ферментов, у ферментов имеющих доменную структуру активный центр часто располагается в щели между прилегающими друг к другу доменами, некоторые ферменты в своей структуре имеют несколько одинаковых протомеров, иногда в одном из них имеется одинаковые активные центры, в некоторых случаях в ферменте в пределах даже одной полипептидной цепи может быть несколько разных активных центров, такие ферменты получили название – Полифункциональные ферменты К ним относится фермент – пальметоилситетаза – синтез пальметиновой кислоты РЕГУЛЯТОРНЫЕ ЦЕНТРЫ
КОНТАКТНЫЕ ПЛОЩАДКИ ферменты, имеющие в своей структуре регуляторные центры, получили название регуляторные ферменты Не все ферменты имеют полный набор названных функциональных центров. Некоторые ферменты имеют всего один активный центр, есть ферменты, имеющие несколько активных центров, а некоторые ферменты вооружены несколькими активными центрами и несколькими регуляторными центрами. |

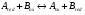 Оксидоредуктазы – катализируют ОВР
Оксидоредуктазы – катализируют ОВР