Ферменты Сходства и различия ферментов и катализаторов небиологической природы
 Скачать 1.11 Mb. Скачать 1.11 Mb.
|
|
Аллостерический центр (аллос – другой, иной) – регуляторный функциональный центр, который расположен вне активного центра Аллостерический центр – участок на поверхности молекулы белка – фермента, образованный определенным набором АК-ых радикалов, но его трехмерная структура комплементарна не субстрату, а тому или иному низкомолекулярному леганду, который выступает в качестве регулятора активности фермента Примеры аллостерических модуляторов:
Если к аллостерическому центру присоединяется аллострерический модулятор, это приводит к изменению конформации фермента, которое сопровождается изменением пространственной структуры активного центра, поэтому изменяется эффективность катализа, причем может изменяться способность активного центра связывать субстрат, может меняться способность осуществлять непосредственное химическое превращение субстрата
Например: фосфофруктокиназа – катализирует фосфолирирование фруктозо-6-фосфата (одна из реакции гликолиза, т.е. окислительного расщепления белков)  Аллостерические ингибиторы для данного фермента:
Аллостерический активатор:
Связывание лигандного модулятора осуществляется только за счет слабых взаимодействий: гидрофобные и электростатические, поэтому такое связывание обратимо, значит возможет возврат фермента в исходное состояние, в итоге суммарно-ферментативная активность будет в значительной степени определяться концентрацией аллостерического модулятора Аллостерические ферменты имеют четвертичную структуру, причем обычный регуляторный центр находится на одном протомере, а активный центр на другом В целом ряде случает один и тот же фермент имеет в своей структуре 2 и более аллостерических центра, которые комплементарны различным лигандным регуляторам В этом случае сродство фермента к конкретному аллостерическому модулятору зависит от состояния других аллостерических центров ЦЕНТР КОВАЛЕНТНОЙ МОДИФИКАЦИИ Участок на поверхности белка-фермента, расположенный вне его активного центра К центру ковалентной модификации с помощью ковалентной связи присоединяется группировка модуляторов, это сопровождается изменением конформации белка-фермента, причем изменение конформации захватывает структуру активного центра, а значит сопровождается изменением эффективности катализа, причем каталитическая активность одних ферментов может увеличиваться, а других уменьшаться В качестве группировок – модуляторов присоединяемых к центру ковалентной модификации наиболее часто выступают остатки фосфорной кислоты, иногда остатки адениловой кислоты Данный регуляторный механизм требует участия 2-х дополнительных ферментов, один фермент обеспечивает образование ковалентной связи между группировкой модулятора и центром ковалентной модификации, а другой отвечает отщепление группировки модулятора от регулятогного центра Н-р: Фосфорилирование – наиболее часто встречающийся вариант регуляции активности фермента Более 40 ферментов регулируется с помощью фосфорилирования По гидроксильной группе, содержащейся в центре ковалентной модификации в гидроксильной группе серина, треонина и тирозина, присоединяется остаток фосфорной кислоты. Катализирует эту реакцию ПРОТЕИНКЕНАЗА фосфопротеинфосфотаза отщепляет фосфорилированный остаток, что обеспечивает возврат фермента в исходное состояние примером фермента, активность которого регулируется с помощью механизма ковалентной модификации, является гликогенфосфорилаза и гликогенсинтетаза гепатоцитов – печеночных клеток, причем активность гликогенфосфорилазы при ее фосфорилировании повышается, а фосфорилирование гликогенсинтетазы сопровождается снижением ее каталитической активности ЦЕНТР БЕЛОК-БЕЛКОВОГО ВЗАИМОДЕЙСВИЯ Обеспечивает взаимодействие ферментов с белками-модуляторами Участок поверхности фермента комплементарный участку поверхности белка-модулятора, Связывание белка-модулятора с ферментом изменяет конформацию фермента, конформационная волна затрагивает активный центр, т.е. сопровождается изменением эффективности катализа Например, белок-модулятор кальмодулин может взаимодействовать с различными ферментами, такими как киназа фосфорилазы в миоцитах или фосфодиэстераза в клетках головного мозга. Кроме этого белки-модуляторы присутствуют во внеклеточной фазе организма, например, в плазме крови присутствует белок, получивший название антитромбин-3, специфической функцией такого белка является связывание и инактивация фермента системы свертывания крови - тромбина В конечном итоге после такого связывания обеспечивается локализация образования тромба в районе поврежденного ____, т.е. этот белок входит в антисвертывающую систему крови КОНТАКТНЫЕ ПЛОЩАДКИ. Участки, ответственные за взаимодействие фермента с другими белками или внутриклеточными структурами. Контактные площадки комплементарны контактным площадкам, имеющимся на поверхности других белков или других ферментов, подобного рода взаимодействия встречаются при формировании надмолекулярных белковых комплексов Ферменты, катализирующие определенный метаболический путь, например, синтез пуриновых, пиримидиновых и др. Клетка входит в состав метаболона – мулльтиэнзимные белковые комплексы, которые обеспечивают соответствующий метаболический путь, связи между ними обычно электростатические или гидрофобные, МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ Почему в присутствии фермента возрастает скорость химических реакции? 2 аспекта
Термодинамический Каждая молекула любого вещества обладает уровнем энергии, причем этого уровня энергии явно недостаточно, чтобы вещество вступало в реакцию с другими окружающими его веществами, только мы имеем дело с относительно стабильными окружающими предметами. Но достаточно поднять уровень внутренней энергии молекулы вещества, как оно начинает реагировать, взаимодействовать со своим окружением Превращение субстратов в продукт реакции Молекулы вещества субстрата обладают недостаточным уровнем внутренней энергии, для того чтобы вступить в реакцию, только отдельные молекулы за счет соударений или внешних воздействий могут повысить внутреннюю энергию, перейти в реакционноспособное состояние Минимальный уровень внутренней энергии, необходимый для перехода молекулы вещества в реакционноспособное состояние - энергетический барьер реакции Количество энергии, которое нужно сообщить одному молю вещества субстрата, для их перехода в реакционноспособное состояние - энергия активации Ккал/моль или КДж/моль Чем больше энергия активации, чем выше энергетический барьер реакции, тем медленнее пойдет эта реакция Величину энергии активации можно уменьшить путем увеличения температуры Произвольную температуру биологических объектов менять мы не можем ввиду тепловой нестабильности белков Можно попытаться снизить энергетический барьер реакции, но для это нужно воздействовать на структуру вещества Нужно направить реакцию по обходному пути, добавив в реакционную смесь катализатор Речь идет о 2 реакциях: 1.Субстрат соединяется с энзимом, с образованием энзим-субстратного комплекса 2.Расщипление с образованием продукта реакции Каждая из этих реакций имеет свой энергетический барьер и свою энергию активации Мы будем наблюдать ускорение реакции, если энергия активации этих реакций в присутствии ферментов будет ниже, чем энергия активации прямой реакции Вывод: ферменты ускоряют ход химических реакций в организме за счет проведения реакции по обходному пути, включающего образование энзим-субстратных комплексов При этом энергетический барьер, а значит и энергия активации каждой из промежуточных реакции ниже соответствующих значений для прямой реакции Запись 51 Структурно-кинетический аспект Ферменты ускоряют ход химической реакции за счет снижения энергии активации, причем энергия активации падает в результате снижения энергетического барьера реакции. В свою очередь снижение энергетического барьера реакции говорит о том, что при взаимодействии молекул субстрата с ферментами происходит изменение структуры реагирующих молекул, которые и способствуют возникновению определенных реакции. Реакции – перестройка одной, реже 2-3 связей в реагирующей молекуле, поэтому ослабление прочности перестраиваемой связи будет, несомненно, способствовать протеканию р-ии Ферменты, взаимодействующие с субстратами, так изменяют структуру молекул субстрата, определенные связи становятся менее прочными, т.е. более уязвимыми для действия реагентов Ослабление прочности связей достигается или за счет изменения пространственной структуры молекулы субстрата, а так же путем перераспределения электронной плотности в молекуле В этом плане принято выделять несколько эффектов, которые отвечают за ускорение хода реакции ферментами:
Существенный вклад в формировании напряженных структур вносит изменение конформации фермента, особенно это касается ферментов, активный центр у которых расположен в щели между доменами (участки полипептидной цепи, которые обладают определенной автономностью, т.е. подвижны по отношению др к др).
Активный центр фермента напоминает углубление в виде щели на поверхности фермента, причем среда здесь с более низкой диэлектрической постоянной, по сравнению с водной фазой дегидратация, изменение диэлектрической постоянной обычно меняет реакционную способность и молекулы субстрата и каталитических группировок активного центра среды К ускорению химической р-ии имеет отношение 2 кинетических момента
эти 2 кинетических эффекта получили названия: Эффект сближения, что эквивалентно локальному увеличению концентрации реагирующих соединений Эффект принудительной пространственной ориентации Далеко не все из перечисленных структур и кинетических эффектов действуют при функционировании каждого фермента, но тем не менее, нужно отчетливо представлять, что объяснить ускорение под действием того или иного фермента можно лишь на основе совокупности из названных эффектов В настоящие время мы располагаем довольно правдоподобными моделями работы более десятка ферментов, т.е. известен механизм действия протеиназ, некоторых дегидрогеназ и т.д. Св-ва ферментов как биокатализаторов Общим св-вом всех ферментов является их способность ускорять ход р-ии – их каталитическая активность Скорость ферментативной р-ии измеряют :
Абсолютное количество фермента в том или ином биологическом материале определить практически невозможно, поэтому для количественной характеристики активности фермента обычно используют условные единицы За единицу фермента (Е) принимают такое его количество в исследуемом объекте, которое катализирует превращение одного микромоля субстрата за одну минуту Обычно расчет ведется на 1 грамм ткани или на один миллилитр исследуемой биологической жидкости, т.е. международная единица – это количество превращенного субстрата деленное на навеску ткали и умноженное на время инкубации. 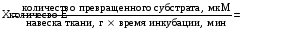 С этой целью используется еще одна единица – катал - количество фермента, которое обеспечивает превращение 1 моля субстрата в 1 секунду. 2 св-во фермента: Специфичность действия – способность катализировать вполне определенные р-ии. Все ферменты обладают высокой специфичностью действия, эта специфичность обусловлена принципом комплементарности, которая реализуется при взаимодействии субстрата с активным центром фермента Пространственная структура фермента – динамична, и в процессе взаимодействия фермента с субстратом она претерпевает изменения, которая регистрируется современными методами исследования Структура активного центра лишь приблизительно комплементарна структуре субстрата, полная подгонка осуществляется в ходе образования фермент-субстратного комплекса В ходе этой подгонки изменяется структура акт центра и структура субстрата Данная концепция получила название: Теория индуцированного соответствия Кошланда Ферменты различаются по уровню своей специфичности, есть ферменты, которые обладают абсолютной специфичностью, т.е. они катализируют только одну р-ию одного определенного соединения Например: Действие аргининазы которая катализирует расщепление аргинина на оргинин и мочевину Фермент уреаза – расщепляет мочевину на CO2 и аммиак Карбоангидраза – катализирует р-ю расщепления угольной к-ты на СО2 и воду Большая часть ферментов обладают относительной специфичностью действия, т.е. они способны катализировать превращение нескольких субстратов. Обычно в структуре таких субстратов есть единый тип химической связи, который подвергается перестройке в ходе р-ии Ферменты протеиназы – ферменты, расщепляющие белки: Пепсин расщиплет пептидную связь, образованную с участием аминогруппы ароматической АК (фенилаланин, тирозин, триптофан) Трипсин катализирует гидролитическим путем расщепление пептидной связи, образованной с участием карбоксильной группы лизина и аргинина, за исключением случаев, когда она не следует за пролином α-амилаза катализирует расщепление α1,4гликозидной связи 3 полимеров: амилаза, амилопектине, гликогене Ферменты обладают стереоспецифичностью, т.е. они катализируют р-ии с участием лишь одного из стереоизомеров только одного из стереоизомеров, в основе лежит многоцентровое взаимодействие активного центра фермента с комплементарным ему субстратом, что и позволяет активному центру различать стереоизомеры Например: Оксидаза АК D-ряда катализирует окислительное дезаминирование только D-стереоизомеров АК Оксидаза АК L-ряда катализирует окислительное дезаминирование только L-стереоизомеров АК Исключение – ферменты из класса изомераз, эти ферменты катализируют изомеризацию соединений D-ряда с соединения L-ряда или ускоряют взаимное превращение цис и транс-изомеров, т.е. действуют на оба стереоизомера Зависимость активности ферментов от температуры При повышении температуры от 0 до 60 градусов, активность ферментов возрастает примерно в 2-3 раза на каждые 10 градусов Обычно так ведут себя ферменты и катализаторы небиологической природы Однако у ферментов при дальнейшем повышении температуры активность резко снижается, причем падение каталитической активности ферментов обусловлено тепловой денатурацией белковой части фермента Оптимальной температурой, при которой ферменты проявляют высокую активность и в то же время стабильны – 37-40 градусов – температура организма животных, для растений температура будет другая Активность ферментов зависит также от рН среды, каждый фермент проявляет свою максимальную активность при определенном значении рН среды, которая получила название - оптимум рН Если рН среды увеличивать или уменьшать по отношению к значению оптимума, то активность фермента будет снижаться, при рН меньше 4 и более 10, в большинстве случаев, каталитическая активность ферментов полностью исчезает Причины: Исчезновение активности ферментов в сильнокислой и сильнощелочной зоне обусловлено денатурацией белковой части ферментов в этих условиях Изменение активности фермента в зоне рН от 4 до 10 обусловлено изменением концентрации протонов Концентрация протонов влияет на:
|

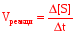 По убыли субстрата
По убыли субстрата