Ферменты Сходства и различия ферментов и катализаторов небиологической природы
 Скачать 1.11 Mb. Скачать 1.11 Mb.
|
|
Оптимум рН для большинства ферментов лежит в диапазоне от 6 до 8 Хотя известны ферменты с аномально низкими значениями оптимумами рН: пепсин (рН = 1,5-2,5), Так же есть ферменты, оптимум рН для которых лежит в щелочной зоне: аргиназа (рН = 9-10) рН крови человека составляет 7,36 ± 0,04 резкие изменение рН в кислую или щелочную сторону сопровождается дезорганизацией работы многочисленных ферментов, поэтому ацитоз и анколоз некомпенсированный – это опасное для жизни человека состояние. Обычно люди, находящиеся в таком состоянии, дезориентированы в окружающем, развиваются коматозное состояние 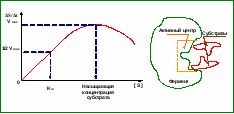 Скорость катализируемой ферментами реакции зависит от концентрации субстрата Скорость катализируемой ферментами реакции зависит от концентрации субстрата Известно 2 типа зависимости Вначале по мере увеличения концентрации субстрата скорость катализируемой ферментом реакции возрастает, а затем после достижения определенной концентрации субстрата она остается постоянной, не смотря на продолжающиеся увеличение концентрации субстрата, Концентрация субстрата, при достижении которой скорость катализируемой ферментом реакции ( Регистрируемая скорость р-ии на участке прямой от 0 до В зависит от каталитической мощности фермента и от частоты соударений молекул субстрата с активным центром фермента. Увеличивая концентрацию субстрата, мы увеличиваем частоту соударений, но при насыщении фермента субстратом 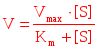 Скорость катализируемой ферментом реакции при заданной концентрации субстрата обычно рассчитывают на уравнению Михаэлиса – Мэнтон , если известна максимальная скорость Vmax Скорость катализируемой ферментом реакции при заданной концентрации субстрата обычно рассчитывают на уравнению Михаэлиса – Мэнтон , если известна максимальная скорость Vmax Кm - константа Михаэлиса Константа Михаэлиса характеризует сродство фермента к субстрату, она численно равна концентрации субстрата, при при которой скорость реакции равна половине от максимальной скорости Km=1/2 V max При дальнейшем увеличении концентрации субстрата иногда активность фермента снижается, данный эффект получил название субстратного торможения  Принято считать, что данный эффект встречается у ферментов, связывание субстрата в активном центре которых идет по нескольким участкам, В условиях избытка субстрата с активным центром могут связываться сразу несколько молекул субстрата, и фермент временно выходит из строя Скорость ферментативной реакции зависит от концентрации фермента в реагирующей смеси. Причем эта зависимость прямо пропорциональна. Наконец, скорость катализируемой ферментом реакции постепенно снижается при увеличении времени инкубации реакционной смеси Скорость снижается за счет действия 2 факторов:
Влияние активаторов и ингибиторов Наличие в к-ке или в реакционной смеси определенных соединений (активаторов и ингибиторов) оказывает выраженное влияние на скорость катализируемых ферментом р-ий. Активаторы – соединения, повышающие каталитическую активность фермента Механизм действия активатора
Например, АТФ, который образует комплекс с ионами магния. В настоящее время считают, что субстратом для многих ферментов является не АТФ сам по себе, а магниевая соль АТФ, вот почему магний или калий имеют достаточно широкое применение в качестве лекарственных препаратов.
Активатор соединяется с аллостерическим центром, это сопровождается изменением конформации фермента, конформационная волна затрагивает структуру активного центра, и повышение активности фермента связано с изменением структуры активного центра Ингибиторы – соединения снижающие, а иногда полностью подавляющие каталитическую активность ферментов В качестве ингибиторов выступают самые различные по структуре вещества:
Механизм ингибирования
Ингибирование
Необратимое ингибирование При нем происходит или разрушение пространственной структуры элемента или образование недиссоциирущего комплекса Е+У ЕУ В ряде случаев необратимое ингибирование ферментов под действием того или иного соединения вызывает образование ковалентных связей между ингибитором и кокой-либо группировкой в активном центре, в этом случае структура активного центра не просто изменяется, а иногда разрушается, поэтому фермент перестает работать 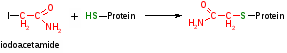 Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп Например, иодоацетат (ICH2-COOH) или иодоацетамид (ICH2-CONH2) являются необратимыми ингибиторами тиоловых ферментов – ферменты, активность которых зависит от SH-групп, т.е. от сульфгиринных групп Деизопропилфторфосфат является необратимым ингибитором ферментов, активность которых зависит от гидроксильных групп серина в их активном центре, такие ферменты как трипсин, фосфорилазы и др. В большинстве своем необратимые ингибиторы являются сильными ядами, поскольку, выводя из строя ферменты, они несомненно дезорганизуют обмен в-в Исключение: Аспирин – лекарственный препарат или ацетилсалициловая к-та – необратимый ингибитор фермента циклооксигеназы, который участвует в синтезе простогландина в биорегуляторах, в этом качестве аспирин нашел широкое применение в медицине При обратимом ингибировании который делится:
Образовавшийся энзим-ингибиторный комплекс нестойкий, поэтому происходит диссоциация энзим-ингибиторного комплекса, возврат фермента в исходное состояние, Е+У <-> ЕУ В этом случае фермент восстанавливает свою активность Различают 2 вида обратимого ингибирования
При конкурентном ингибировании ингибитор по своей структуре подобен, но не идентичен субстрату, поэтому он может связываться с активным центром фермента, но не подвергается в нем дальнейшим превращениям и фермент на время выводится из строя Из-за непрочности связывания, ингибитор через некоторое время покидает активный центр, и фермент может взаимодействовать с субстратом Если в к-ке или в реакционной смеси одновременно присутствуют и субстрат и ингибитор, то параллельно работают 2 системы, т.е. часть молекул фермента связываются с субстратом, образуют энзим-субстратный комплекс, превращается субстрат в продукты р-ии, регенерация энзима и продукта р-ии, а часть молекул фермента связывается с ингибитором с образованием ингибиторного комплекса 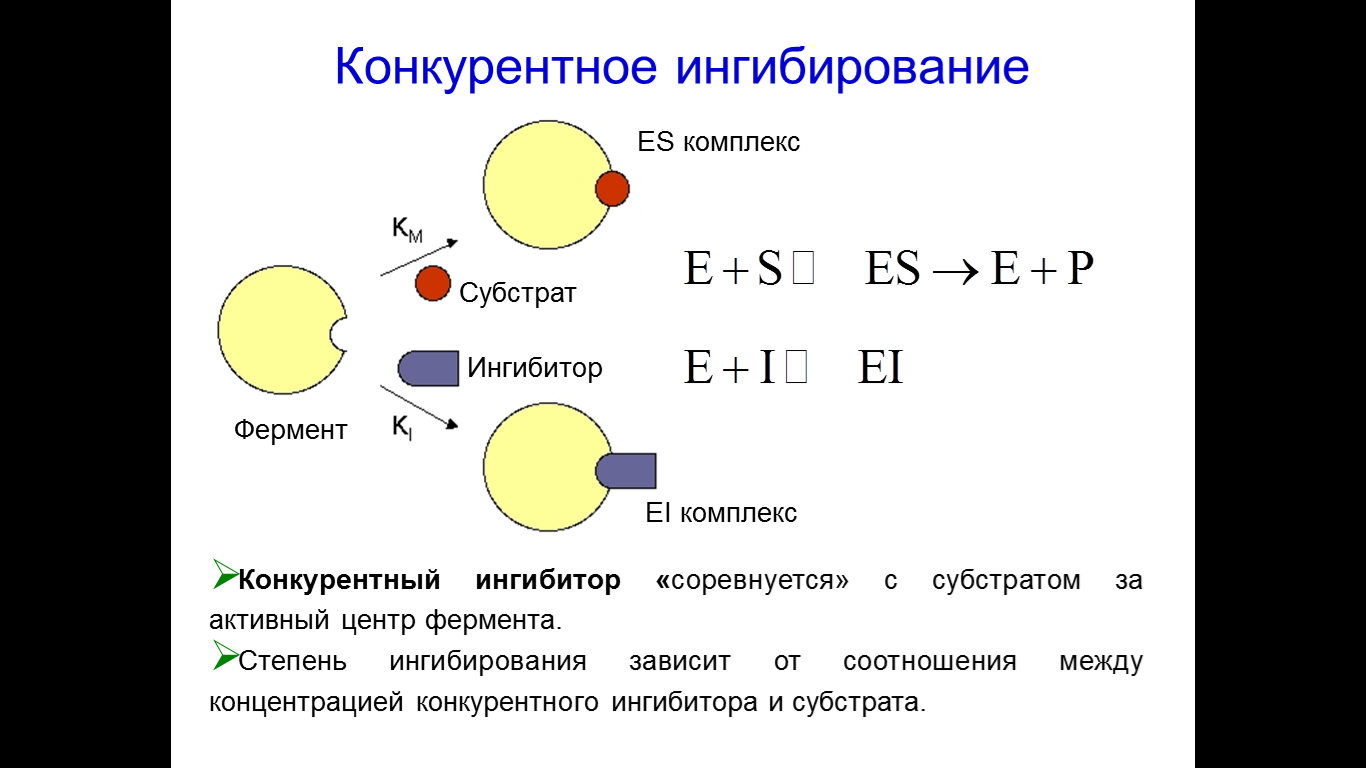 Ингибирование зависит
Например: ингибирование и угнетение активности фермента сукцинатдегидрогеназы, (р-я из цикла трикарбоновых к-т)  Сукцинат – янтарная к-та (широко используется в качестве лекарственного препарата). Он окисляется, теряя 2 атома водорода путем дегидрирования, под действием сукцинатдегидрогеназы, превращается в непредельную тумаровую к-ту, атомы водорода передаются на ФАД. Конкурентные ингибиторы сукцинатдегидрогеназы: 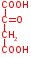 Малоновая к-та Оксалоацетат малат Малоновая к-та Оксалоацетат малат 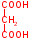 Характерной чертой этого типа ингибирования является то, что ингибитор связывается только со свободным ферментом, поскольку взаимодействие идет по активному центру При воздействии на фермент конкурентного ингибитора происходит увеличение константы Михаэлиса ингибируемого фермента, а V max не претерпевает изменений При неконкурентном ингибировании, ингибитор не похож по структуре на субстрат, он реагирует с той или иной функциональной группой фермента, которая может быть или в активном центре, или вне его. Степень такого ингибирования зависит только от концентрации ингибитора и его сродства к ферменту, т.е. чем больше концентрация ингибитора и чем больше сродство ингибитора к ферменту, тем больше степень угнетения активности фермента Поскольку ингибитор реагирует с функциональной группой на поверхности фермента, он может воздействовать как на свободный фермент, так на весь фермент в составе ES-комплекса, причем повышение концентрации субстрата несомненно не оказывает влияние на степень ингибирования 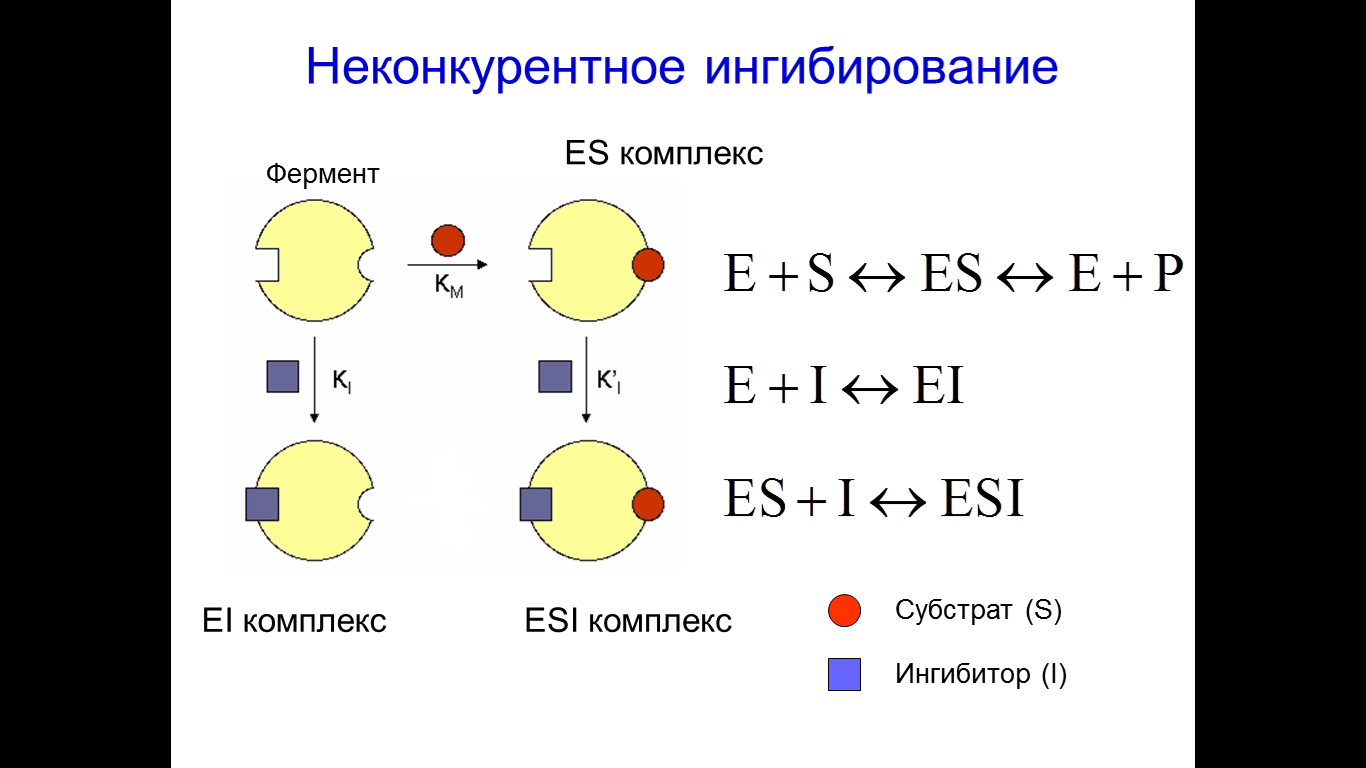 Например: Угнетение некоторых ферментов ионами серебра, они связывают сульфгидрильные группы фермента, но это связывание обратимо Отравление цианидами – солями синильной к-ты Цианиды – связываются с ферментом цитохромоксидазы, причем это связывание обратимо При неконкурентном ингибировании значение константы Михаэлиса для ингибированного фермента не изменяется, а значение V max падает В виду особой важности в регуляции клеточного метаболизма обычно отдельно рассматривают аллостерическое ингибирование ферментов, аллостерического ингибирование- частный случай неконкурентного ингибирования, с одной очень важной особенностью: связывание аллостерического ингибитора происходит в аллостерическом центре на основе принципа комплементарности, присоединение аллостерического ингибитора к аллостерическому центру приводит к изменению пространственной структуры фермента, затрагивается при этом структура активного центра, при этом связывание и эффективность катализа падают, и мы регистрируем падение активности фермента Многие лекарственные препараты являются ингибиторами тех или иных ферментов в организме человека Н-р: Сердечный гликозид – строфантин, который используется для лечения некоторых заболеваний сердца, является неконкурентным ингибитором _____ независимой АТФ-азы в миокардиоцитах Аллопуринол (алло – другой, иной, пуринол – спирт) используется для лечения подагры, является конкурентным ингибитором фермента сантинокиназы Регуляция активности ферментов в живых системах Интенсивность метаболизма не должна быть монотонной, она зависит от функционального состояния клеток, поскольку скорость химических реакций в к-ках в значительной мере определяется эффективностью работы ее каталитических систем, активность ферментов к-ки должна регулироваться и регулируется. Принято выделять 2 типа регуляции суммарной ферментативной активности в живых системах
Общая черта работы этих механизмов – обратимость, обеспечивающая возврат каталитических систем к исходному состоянию В процессах срочного регулирования активности ферментов важнейшая роль принадлежит следующим основным механизмам :
Медицинская энзимология Сведения, которые получили энзимологи, нашли широкое применение в медицинской практике, в настоящие время сформировалось 3 основных направления мед энзимологии
Энзимопатология Выясняются варианты отклонения активности ферментов по сравнению с нормой, стремятся выяснить первопричину этих отклонений, а так же выяснить связь изменения активности ферментов с патогенезом, т.е. механизмов появления и развития тех или иных заболеваний Нарушение активности ферментов, выявляемое при тех или иных патологических состояниях, получили собирательное название энзимопатии Энзимопатии могут проявляться либо в виде:
По происхождению энзимопатии можно разделить на:
Первичные энзимопатии Нарушение активности ферментов, обусловленные тем или иным генетическим дефектом Варианты нарушения могут быть различными
В любом из этих вариантов происходит нарушение обменных процессов, которые проявляются как заболевание Н-р:
Вторичные (приобретенные) энзимопатии – нарушение активности ферментов, развивающиеся вследствие того или иного патологического состояния Н-р
Н-р, поступление цианида блокирует работу фермента цитохромоксидазы, поступление в организм фосфоорганических соединений (то, что травили тараканов), блокируется активность фермента холиностеразы ????? поступление в организм диоксина (образуется при большом сжигании всякого г***) повышает активность фермента цитохром-(РилиВ)450 ?????????
Н-р, в гепатоцитах (основная ф-я – детоксиказия) работает огромное кол-во ферментов, При заболеваниях печени, резко увеличивает активность ферментов в плазме крови, поскольку при этом наблюдается гибель печеночных к-к.
Изменение активности фермента, т.е. тот или иной вариант энзимопатий, должно своевременно выявляться. Выявление энзимопатий является основной задачей энзимодиагностики В основе энзимодиагностики лежит простой прием: определяя активность одного из ферментов в крови, а иногда и в других биологических жидкостях, включая слюну, иногда определяют в биоптатах, т.е. взятых в стерильных условиях кусочках ткани у большого количества здоровых людей И тем самым выясняет количественное значение нормальной активности ферментов, и активности ферментов в норме человеческой популяции , далее активность фермента определяют у больных теми или иными заболеваниями. В целом ряде случает удается установить, что активность фермента при патологии при некоторых заболеваниях меняется закономерно, т.е. активность некоторых ферментов повышается, других понижается. Поэтому определение активности ферментов можно и используют в качестве диагностического теста на ряду с другими методами диагностики Н-р, повышение активности креатинкеназы используется очень широко в биодиагностике инфаркта миокарда Активность каталазы в крови снижается при раке или туберкулезе В клинической практике определяют активность более 100-ни ферментов в плазме крови, наиболее часто определяют активность аминотрансферраз, щелочных и кислых фосфотаз, креатикеназы, лактатдегидрогеназы, гистидазы, урокониназы и др Используют энзимные диагностические тесты - определение активности нескольких ферментов в одной группе крови Так же используются изоэнзимные диагностические тесты – определение изоферментов, н-р, ЛДГ, которая существует в виде 5 изоферментов, креатинкеназы которая существует в виде 3 изоферментов, щелочной фосфотазы, которая существует в виде 3 изоферментов Энзимотерапия - использование препаратов ферментов, а так же ингибиторов и активаторов ферментов в лечебных целях Чаще всего в клинике используется заместительно-ферментная терапия – искусственное введение в организм препарата, содержащего фермент при его недостатке в организме Н-р, при нарушении функций панкреатической поджелудочной железы, назначается панкреатин или другие комплексы ферментов препаратов, выпускаемых под различными названиями различными фирмами При нарушении деятельности желудка, назначают препараты, содержащие пепсин При ранениях, особенно обширных, часть тканей вокруг раны некротизируется, эти омертвевшие ткани мешают, препятствуют заживлению раны, как правило, всегда инфицируются, для удаления некротизированных участков, мешающих процессам заживления ран, используются ферменты, расщепляющие белки, причем используется трипсин, его пришивают с помощью ковалентных связей к перевязочному материалу, он расщепляет белки некротизированной зоны и способствует очищению раны. Наиболее перспективным направлением использования ферментов для очистки ран является использование иммобилизованных ферментов(трипсин, пришитый к перевязке) получается олеиназы из присосок щупальцев кальмара Вполне возможны другие варианты использования ферментов: Фермент гиалуронидаза (ладаза) используется для увеличения проницаемости кожи или слизистых, что способствует лучшему всасыванию других лекарственных в-в с поверхности этих тканей При вирусном конъюнктивите достаточно широко используется фермент дезоксирибонуклеаза При лечении некоторых форм лейкозов, используют в последнее время фнмент – аспорагиназа Для ускорения растворения тромбов при тромбофлибитах, при инфаркте миокарда используют фермнт урокеназа Лечение врожденных энзимопатий – отсутствие фермента, работающего внутри к-к, или даже внутри органелл к-к; введение фермента в кровь, мало что дает, поскольку фермент моментально выводится, в настоящее время разрабатываются способы введения фермента в к-ки с помощью рибосом, но это пока на стадии изучения Энзимопатия относится к использованию ингибиторов и активаторов ферментов, Н-р, при панкреатитах кровь поступает большое кол-во трипсина, и для устранения его неблагоприятного действия на белки плазмы крови назначают препарат просилол, фантрикал, фантрипин – мощные ингибиторы трипсина При угнетении крови, данные ингибиторы протеиназ используется в стоматологии для лечения периодонтитов, дело в том что при пародонтитах резко повышается активность протеиназ, что явно формирует порочный круг, поэтому используют или электрофорез, или местное _____ Большинство лекарственных препаратов так или иначе вмешиваются в ход обменных процессов в организме, выступая в большинстве своем или как активаторы, или как ингибиторы ферментов Еще одним направлением использования ферментов является их применение в качестве реагентов при проведении клинических лабораторных исследований: определение мочевины, лактата и ряда других констант, которые используются в лабораторной практике |
