Блок ферменты. 9 занятие ферменты. Ферменты, строение и свойства. Изучение кинетических свойств, специфичности действия ферментов и модификаторов их активности
 Скачать 325.98 Kb. Скачать 325.98 Kb.
|
|
ОТВЕТЫ НА БИЛЕТ № 14. Изоферменты - это изомеры ферментов-мультимеров, составленных как правило, из субъединиц двух типов. В зависимости от соотношения этих субъединиц в мультимере, последний может существовать в виде нескольких изомеров. Скорость реакции при низкой концентрации субстрата зависит от концентрации его и пропорциональна ей. При высоких концентрациях субстрата скорость реакции зависит только от концентрации фермента. Вещества, понижающие активность ферментов, называются ингибиторами; вещества, повышающие активность - активаторами. Свойство ферментов катализировать один тип реакции (например, дегидрогеназы). Энергия, необходимая для запуска химической реакции, без которой реакция не начинается, несмотря на термодинамическую вероятность. БИЛЕТ № 15. Как изменяется активность ферментов? Назовите единицу активности ферментов. В чем заключается аллостерическое ингибирование ферментов? Чем объясняется снижение энергии активации в ферментативной реакции? Что называется коферментом и простетической группой в ферменте-протеиде? Как применяются антиметаболиты? ОТВЕТЫ НА БИЛЕТ № 15. 1. Наличие фермента обычно распознается по проявлениям катализируемой им химической реакции; количество фермента можно определить путем измерения скорости этой реакции, т.е. о количестве фермента судят по его активности. За единицу активности фермента принят, катал (кат.) - количество фермента, которое катализирует превращение одного моля субстрата в секунду при 250 С в оптимальных условиях. 2. Аллостерические ингибиторы присоединяются по аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого субстратный, каталитический центры приобретают наименее выгодную для осуществления своих функций конфигурацию. 3. Путем образования фермент-субстратного комплекса, что приводит к ослаблению определенных связей в субстрате, и одновременно к активированию субстрата и повышению его реакционной способности. 4. Под коферментом подразумевают добавочную группу, легко отделяющуюся от апофермента (белковой части молекулы), обслуживающую два или несколько ферментов и способную к самостоятельному существованию. Простетическая группа - добавочная группа, прочно связанная с апоферментом. 5. Антиметаболиты широко используются в терапии ряда заболеваний. Так, аналоги пуриновых и пиримидиновых оснований (2-аминоаденин, 5-фторурацил) или аминокислот (фторфенилаланин) будучи введены в организм, могут приводить к синтезу таких нуклеиновых кислот и белков, метаболизм которых блокируется из-за нарушения структуры или отсутствия ферментов в организме, способных катализировать их обмен. Эти антиметаболиты применяют при злокачественных новообразованиях. БИЛЕТ № 16. Что понимается под аллостерическим центром фермента? К какой группе ингибиторов относятся соли тяжелых металлов? Укажите виды специфичности ферментов. Охарактеризуйте абсолютную специфичность действия ферментов. Приведите примеры соединений, которые могут выполнять роль кофакторов. Дайте определение катала - единицы каталитической активности. ОТВЕТЫ НА БИЛЕТ № 16. Аллостерический центр представляет собой участок молекулы фермента, пространственно отделенный от активного центра, присоединение к которому определенного низкомолекулярного вещества ведет к изменению третичной структуры молекулы. Неконкурентных ингибиторов. Абсолютная, абсолютная групповая, относительная групповая, стереохимическая специфичность. Абсолютная - когда фермент катализирует только одну реакцию превращения определенного вещества. Например, уреаза. Никотинамидадениндинуклеотид (НАД), флавинадениндинуклеотид (ФАД), тиаминпирофосфат (ТПФ), тетрагидрофолиевая кислота (ТГФК), карбоксибиотин и др. Катал есть каталитическая активность, способная осуществлять реакцию со скоростью равной 1 молю в секунду. Занятие №10 Тема: Механизм действия ферментов. Номенклатура и классификация ферментов. Количественное определение активности альфа-амилазы в сыворотке крови унифицированным методом. Вопросы для самоконтроля усвоения основных понятий темы БИЛЕТ № 1. Приведите классификацию ферментов. На чем она основана? Какие ферменты катализируют реакции разрыва связей в субстрате без присоединения воды или окисления? Приведите пример реакции, катализируемой гидролазой. Приведите примеры использования ингибиторов ферментов в медицине. Напишите формулу кофермента, образованного витамином В3. Какие реакции катализируются с участием данного кофермента? БИЛЕТ № 2. Каковы особенности ферментов – оксидоредуктаз? Перечислите подклассы ферментов – трансфераз. Приведите пример реакции, катализируемой изомеразой. Приведите примеры использования ферментов для лечения заболеваний суставов. Напишите формулу кофермента, образованного витамином В6. Какие реакции катализируются с участием данного кофермента? БИЛЕТ № 3. Какие реакции катализируют аэробные и анаэробрные дегидрогеназы? Как зависит скорость ферментативной реакции от концентрации фермента и субстрата? Приведите пример реакции, катализируемой ферментом класса трансфераз. На чем основано применение ферментов для лечения вирусных заболеванией? Напишите формулу кофермента А. Какой витамин входит в состав этого кофермента? БИЛЕТ № 4. Какие реакции катализируют ферменты класса трансфераз? Как образуется название фермента? Приведите пример реакции, катализируемой ферментом класса лигаз? Что представляет собой иммобилизованные ферменты? Как они применяются? Напишите формулу коферментов витамина В5. В состав ферментов какого класса входят эти коферменты? БИЛЕТ № 5. На чем основана современная классификация ферментов? Какие реакции катализируют ферменты - лиазы? Приведите пример реакции, катализируемой ферментом класса гидролаз. Приведите примеры использования иммобилизованных ферментов. Напишите формулу кофермента, образованного витамином В2. БИЛЕТ № 6. Охарактеризуйте класс оксидоредуктаз. Перечислите факторы, влияющие на скорость ферментативной реакции. Приведите пример реакции, катализируемой ферментом класса изомераз. Охарактеризуйте понятие энзимодиагностика. Напишите формулу кофермента, образованного витамином В1. В состав ферментов какого класса входит данный кофермент? БИЛЕТ № 7. Охарактеризуйте класс трансфераз. Перечислите классы ферментов. Какой тип реакции определяет каждый класс ферментов? Приведите пример реакции, катализируемой ферментом класса оксидоредуктаз. Приведите примеры использования ферментов для лечения заболеваний желудочно-кишечного тракта. Напишите формулу кофермента биотина. Какие реакции катализируют данный кофермент в составе фермента? БИЛЕТ № 8. Охарактеризуйте класс гидролаз. Как образуется систематическое название фермента? Приведите пример реакции, катализируемой ферментом класса трансфераз. Приведите примеры использования ингибиторов ферментов в качестве лекарственных препаратов. Напишите формулу НАД. В состав какого фермента входит этот кофермент? БИЛЕТ № 9. Охарактеризуйте класс изомераз. Из чего складывается рабочее название ферментов? Приведите пример реакции, катализируемой ферментом класс лиаз. Приведите примеры использования ферментов как лекарственных препаратов. Напишите формулу УДФ-глюкозы. В состав какого класса входит этот кофермент? БИЛЕТ № 10. Охарактеризуйте класс лигаз. Какие ферменты катализируют окислительно-восстановительные реакции? Назовите представителей этого класса ферментов. Приведите примеры использования коферментов в качестве лекарственных препаратов. Приведите пример реакции, катализируемой ферментом класса гидролаз. Напишите формулу ТГФК. В состав какого класса входит этот кофермент? БИЛЕТ № 11. На чем основана современная классификация ферментов? Перечислите классы ферментов. Назовите особенности ферментов-оксиредуктаз. Приведите пример реакции, катализируемой ферментом класса трансфераз Перечислите коферменты лигаз. Напишите формулу ФАД. БИЛЕТ № 12. Какие ферменты катализируют реакции изомеризации? Перечислите подклассы ферментов класса трансфераз. Приведите пример реакции, катализируемой ферментом класса лиаз. Перечислите коферменты оксиредуктаз. Напишите формулу глутатиона. БИЛЕТ № 13. Какие реакции катализируют ферменты-лигазы? На какие группы делятся пептидгидролазы? Приведите пример реакции, катализируемой изомеразой. Перечислите коферменты трансфераз. Напишите формулу ФАФС. БИЛЕТ № 14. Какие реакции катализируют ферменты-гидролазы? Как образуется рабочее название фермента? Приведите примеры реакции, катализируемой гидролазой амидиназой. Приведите примеры использования коферментов в качестве лекарственных препаратов. Напишите формулу ЦДФХ. Коферментом каких ферментов он является? БИЛЕТ № 15. Охарактеризуйте класс лиаз. Назовите представителей оксиредуктаз. Приведите пример реакции, катализируемой гликозидазой. Назовите ферменты, используемые для лечения заболеваний желудочно-кишечного тракта. Напишите формулу карбоксибиотина. В состав ферментов какого класса входит данный кофермент? БИЛЕТ № 16. Какие принципы положены в основу современной классификации ферментов? Перечислите основные подклассы ферментов гидролаз. Приведите пример реакции, катализируемой аминотрансферазой. Приведите примеры использования ферментов как лекарственных препаратов. Напишите формулу кофермента, образованного витамином В6. Ответы на контрольные вопросы ОТВЕТЫ НА БИЛЕТ № 1. Систематическая классификация ферментов основана на типе катализируемой реакции и согласно этому ферменты подразделяются на 6 классов: Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы. Ферменты класса лиаз. Пример реакции, катализируемой гидролазой – карбоксиэстеразой. 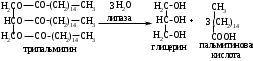 Теофиллин, дибазол, папаверин являются конкурентными ингибиторами фосфодиэстеразы цикло-АМФ; антидепресанты – ингибиторы моноаминооксидазы и др. 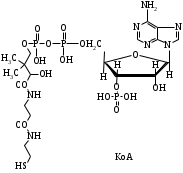 HS-КоА является коферментом ацилтрансфераз, переносит ацильные группы; в его состав входит витамин В3. ОТВЕТЫ НА БИЛЕТ № 2 а). Ферменты оксидоректазы образуют ферментативные системы. б). Многочисленность этих ферментов при ограниченном числе коферментов объясняется возможностью сочетания коферментов с различными апоферментами. в).оксидоредуктазы ускоряют реакции окисления, которые сопровождаются образованием АТФ. Фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, метилтрансферазы и др. Гиалуронидаза (в виде препаратов лидазы или ринидазы). 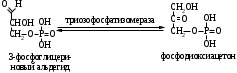 Пиридиксальфосфат является коферментом аминотрансфераз и декарбоксилаз аминокислот, участвующих в реакциях переаминирования и декарбоксилирования аминокислот. 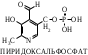 ОТВЕТЫ НА БИЛЕТ № 3. Аэробные дегидрогеназы ускоряют перенос водорода или электронов на кислород. Анаэробные дегидрогеназы переносят водород или электроны от одного промежуточного продукта на другой, но не на кислород. При низкой концентрации субстрата скорость реакции зависит от концентрации субстрата и пропорциональна ей. При высоких концентрациях субстрата скорость реакции зависит только от концентрации фермента. 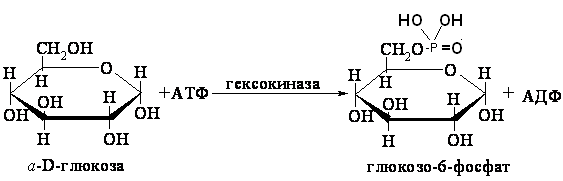 Ферменты, ускоряющие распад нуклеиновых кислот, например, дезоксирибонуклеаза, применяются в лечении вирусных заболеваний. Коэнзим А является коферментом ацилтрансфераз. Переносит ацильные группы; в его состав входит витамин В3 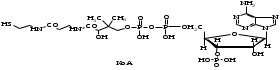 ОТВЕТЫ НА БИЛЕТ № 4 Ферменты, ускоряющие перенос различных атомных групп или остатков молекул от одного субстрата к другому. Для индивидуального фермента в названии субстрата указывается тип химический реакции и прибавляется окончание «аза»; например, лактатдегидрогеназа. Если это система ферментов, то название основывается на катализируемой ею суммарной реакции и включается слово «система»; например, пирувадегидрогидрогеназная система. Иммобилизованные, т.е. связанные на различных носителях (стекло, целлюлоза, полиакриламид и др.). В результате создаются нерастворимые катализаторы, которые превышают стойкостью и длительностью действия обычные ферменты. Применяются в химической промышленности, медицине и др. областях. Пример – стрептодеказа, для лечения инфаркта миокарда, афинная хроматография - в химии. 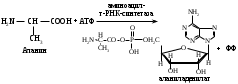 НАД является коферментом оксиредуктаз. 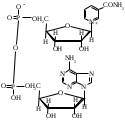 ОТВЕТЫ НА БИЛЕТ № 5. Оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Классификация ферментов основана на типе реакции, катализируемых ферментами. Ферменты – лиазы ускоряют реакции расщепления органических веществ без участия воды. В медицине: для лечения тромбозов (ферменты, иммобилизированные на антителах к коллагену, на гепарине); инфаркт миокарда (стрептодеказа). В химико-фармацевтической промышленности: синтез и анализ ЛП. 4. 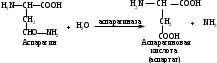 5.ФМН является коферментом дегидрогеназ. Переносит атомы водорода. 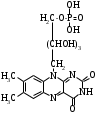 ОТВЕТЫ НА БИЛЕТ № 6. Оксидоредуктазы ускоряют окислительно-восстановительные реакции, то есть переносят атомы водорода или электроны от окисляемого субстрата на восстанавливаемый. Температура, рН среды, наличие активаторов или ингибиторов. 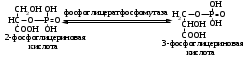 Это применение ферментов в диагностике болезней. Основывается либо на применении ферментных препаратов для определения содержания различных веществ в биологическом материале (крови, моче), либо на прямом определении самого фермента в биоматериале. Т 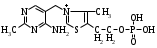 иаминпирофосфат входит в состав декарбоксилаз кетокислот. ОТВЕТЫ НА БИЛЕТ № 7. Ферменты, ускоряющие перенос атомных групп или остатков молекул от одного субстрата на другой. Оксидоредуктазы (окислительно-восстановительные реакции), трансферазы (перенос атомных групп), гидролазы (реакции гидролиза), лиазы (негидрилитический распад молекул), изомеразы (внутримолекулярные превращения), лигазы (синтез соединений). 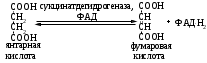 Пепсин, трипсин, панкреатин, химопсин. Карбоксибиотин входит в состав ферментов, ускоряющих реакции карбоксилирования и перекарбоксилирования. 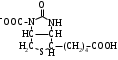 |
