Физические основы молекулярнокинетической теории строения вещества
 Скачать 211.84 Kb. Скачать 211.84 Kb.
|
|
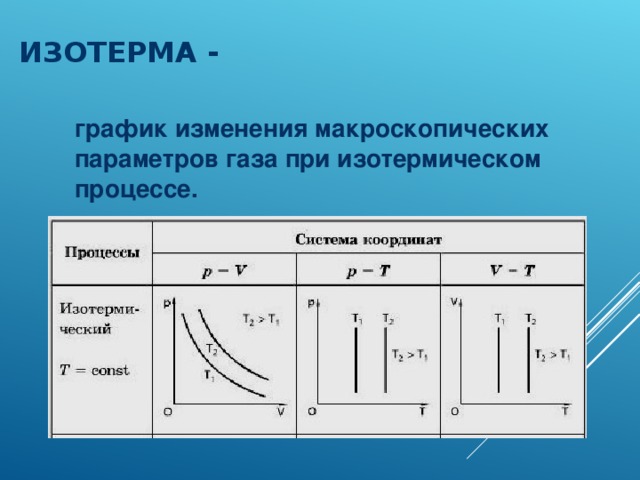
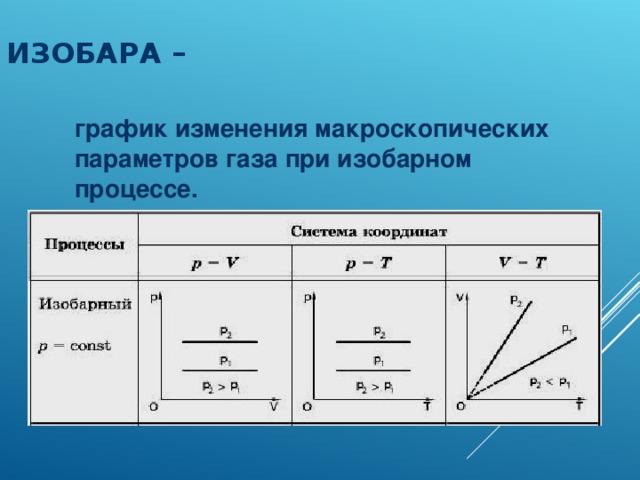
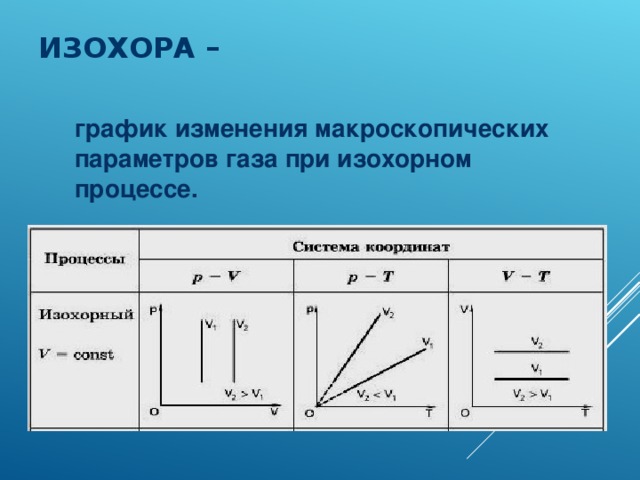
Физические основы молекулярно-кинетической теории строения вещества. Вещество может находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Молекулярная физика - раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения. Тепловое движение - беспорядочное (хаотическое) движение атомов или молекул вещества. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ: Молекулярно-кинетическая теория - теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения. Основные положения молекулярно-кинетической теории: 1.вещество состоит из частиц - молекул и атомов, разделённых промежутками 2.эти частицы хаотически движутся 3.частицы взаимодействуют друг с другом МАССА И РАЗМЕРЫ МОЛЕКУЛ Массы молекул и атомов очень малы. Например, масса одной молекулы водорода равна примерно 3,34*10 -27 кг, кислорода - 5,32*10 -26 кг. Масса одного атома углерода m0C=1,995*10 -26 кг. Относительной молекулярной (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:(атомная единица массы). 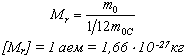 Количество вещества - это отношение числа молекул N в данном теле к числу атомов в 0,012 кг углерода NA: Моль - количество вещества, содержащего столько молекул, сколько содержится атомов в 0,012 кг углерода. Число молекул или атомов в 1 моле вещества называют постоянной Авогадро: Молярная масса - масса 1 моля вещества: Молярная и относительная молекулярная массы вещества связаны соотношением: М = Мr*10^ -3 (кг/моль). СКОРОСТЬ ДВИЖЕНИЯ МОЛЕКУЛ Несмотря на беспорядочный характер движения молекул, их распределение по скоростям носит характер определённой закономерности, которая называется распределением Максвелла. 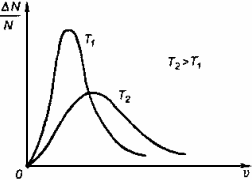 График, характеризующий это распределение, называют кривой распределения Максвелла. Она показывает, что в системе молекул при данной температуре есть очень быстрые и очень медленные, но большая часть молекул движется с определённой скоростью, которая называется наиболее вероятной. При повышении температуры эта наиболее вероятная скорость увеличивается. ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ Идеальный газ - это упрощённая модель газа, в которой: 1.молекулы газа считаются материальными точками 2.молекулы не взаимодействуют между собой 3.молекулы, соударяясь с преградами, испытывают упругие взаимодействия Иными словами, движение отдельных молекул идеального газа подчиняется законам механики. Реальные газы ведут себя подобно идеальным при достаточно больших разрежениях, когда расстояния между молекулами во много раз больше их размеров.  Основное уравнение молекулярно-кинетической теории можно записать в виде: 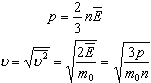 Скорость ТЕМПЕРАТУРА Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой. Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия. Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру. 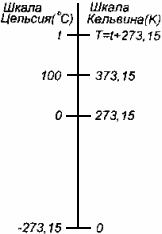 Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объёме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении. Термометр - прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре её кипения - 100°С. Кельвин ввёл абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин). Связь температуры в энергетических единицах и температуры в градусах Кельвина: где k = 1,38*10 ^-23 (Дж/К )- постоянная Больцмана. Связь абсолютной шкалы и шкалы Цельсия: T = t + 273 где t - температура в градусах Цельсия. Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре: 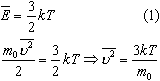 Средняя квадратичная скорость молекул: Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так: p=nkT УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Пусть газ массой m занимает объем V при температуре Т и давлении р, а М- молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N-число молекул. Подставим это выражение в основное уравнение молекулярно-кинетической теории: 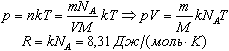 Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде называют уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Нормальные условия - давление газа равно атмосферному ( р = 101,325 кПа) при температуре таяния льда ( Т = 273,15 К ). 1. Изотермический процесс Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим. Если Т =const, то Закон Бойля-Мариотта Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const График процесса, происходящего при постоянной температуре, называется изотермой. 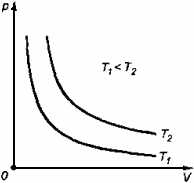 2. Изобарный процесс Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. Закон Гей-Люссака Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре: Если газ, имея объем V0 находится при нормальных условиях: Обозначив получим V=V0 Коэффициент 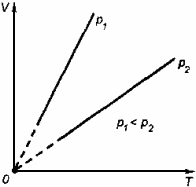 3. Изохорный процесс Процесс изменения состояния термодинамической системы при постоянном объёме называют изохорным. Ecли V = const , то Закон Шарля Давление данной массы газа при постоянном объёме прямо пропорционально абсолютной температуре: Если газ, имея объем V0,находится при нормальных условиях: а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать График процесса, происходящего при постоянном объёме, называется изохорой. 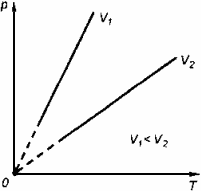 Термодинамический и статистический методы исследования термодинамических систем. Для исследования физических свойств макроскопических систем, связанных с огромным числом содержащихся в них атомов и молекул, применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (или молекулярно-кинетический) и термодинамический. Статистический метод — это метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними (усреднёнными) значениями физических величин, характеризующих всю систему. Этот метод лежит в основе молекулярной физики — раздела физики, изучающего строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из атомов, молекул или ионов находящихся в непрерывном хаотическом движении. В дальнейшем мы будем использовать термин "молекула" имея ввиду мельчайшую структурную единицу (элемент) данного вещества. Термодинамический метод — это метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (например, давление, объем, температура) при различных превращениях энергии, происходящих в системе, не учитывая при этом внутреннего строения изучаемых тел и характера движения отдельных частиц. Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика имеет дело с термодинамической системой — совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Термодинамические системы, не обменивающиеся с внешней средой ни энергией, ни веществом, называются замкнутыми. Основа термодинамического метода — определение состояния термодинамической системы. Состояние системы задаётся термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и объем. Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из её термодинамических параметров, называется термодинамическим процессом. Если для данной системы внешние условия не изменяются и состояние системы с течением времени не меняется, то эта система находится в термодинамическом равновесии. Микро- и макропараметры системы. Система, состоящая из большого числа молекул, называется макросистемой. Макросистема, отделённая от внешних тел стенками с постоянными свойствами, после длительного промежутка времени приходит в равновесное состояние. Это состояние можно описать рядом параметров, называемых Параметрами состояния. Различают Микропараметры и Макропараметры состояния. К микропараметрам состояния можно отнести следующие физические величины: массу M0 молекул, их скорость, среднюю квадратичную скорость молекул, среднюю кинетическую энергию молекул, среднее время между соударениями молекул, длину их свободного пробега и др. Это такие параметры, которые можно отнести и к одной молекуле макросистемы. Макропараметры состояния характеризуют только равновесную систему в целом. К ним относятся объем V, давление P, температура T, плотность ρ, концентрация N, внутренняя энергия U, электрические, магнитные и оптические параметры. Значения этих параметров могут быть установлены с помощью измерительных приборов. Микропараметры состояния:
Макропараметры состояния:
   |
