Физические свойства фтористого водорода
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Введение Данная курсовая работа посвящена производству газообразного фтористого водорода. Широкое применение находят плавиковая кислота и газообразный НF как в неорганических, так и в органических синтезах. Плавиковая кислота используется для производства различных фторидов, применяемых в качестве катализаторов (фториды серебра, марганца, цезия, бора и др.); НF является исходным сырьем для получения фторидов урана. Безводный НF - основной реагент при производстве фторорганических соединений (пластмассы, фреоны, теплоносители и т.п.). В настоящее время фтористый водород в Свердловской области производится на ОАО «Полевском криолитовом заводе». Строительство цеха производства HF осуществлено в 1970-1974 гг. по проекту, разработанному Уралгипрохимом в соответствии с проектным заданием реконструкции и расширения завода, утвержденным Минцветметом 14 июня 1967 года. Технологическая схема производства разработана Уралгипрохимом совместно со специалистами завода и УНИХИМа. Генеральный проектировщик - ИФ ВАМИ, проектная мощность цеха - 79800 т в год 100% фтороводородной кислоты-полуфабриката, 4000 т/год 30% технической марки Б (1 сорт), 5000 т/год марки Б (2 сорт). В основе способа получения фтороводородного газа лежит процесс разложения плавикового шпата серной кислотой. Целью данной курсовой работы является систематизация и обобщение известных знаний по получению фтороводорода и побочных продуктов из флюоритового концентрата и серной кислоты, используя опыт организации комплексной переработки флюоритового концентрата на Полевском криолитовом заводе. А также изучение влияния одного из параметров процесса на его характеристики и расчёт термодинамики основных и побочных реакций. В данном курсовом проекте рассмотрено производство газообразного фтористого водорода в печах с наружным обогревом. Характеристика химического продукта Физические свойства фтористого водорода Фтористый водород, HF, соединение фтора с водородом. Плотность 0,98 г./см3 (12°С), tпл - 83,37°С, tkип 19,43°С. Выше 19,43°С - бесцветный газ с резким запахом, раздражающим дыхательные пути, ниже этой температуры - бесцветная легкоподвижная жидкость; tkpит 230,2°С, ркрит 94,5 кгс/см2, энтальпия образования - 271 кдж/моль (-64,8 ккал / моль). Критическая температура фтористого водорода равна 188°С, критическое давление 64 атм. Теплота испарения жидкого НF в точке кипения составляет лишь 7,5 кДж/моль. Столь низкое значение (примерно в 6 раз меньшее, чем у воды при 20°С) обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (в отличие от воды). Подобно плотности (0,99 г./см3), диэлектрическая проницаемость жидкого фтористого водорода (84 при 0°С) очень близка к значению ее для воды. Молекулы фтористого водорода ассоциированы, степень ассоциации зависит от агрегатного состояния, температуры и давления. В газообразном фтористом водороде ассоциаты включают три или четыре молекулы HF. Фтористый водород смешивается с водой в любых соотношениях. Его водный раствор - фтористоводородная или плавиковая кислота, которая представляет собой бесцветную, подвижную и легколетучую жидкость. Содержание HF в газовой фазе для 20%-ной плавиковой кислоты при различных температурах:
Химические свойства фтороводорода. В водных растворах HF сильно диссоциирован: Н2О + 2HF = H3O+ + HF2- HF = H+ + F- F- + HF = HF2- В отличие от свободного фтора фтористый водород (НF) и многие его производные используются уже с давних пор. Совершенно безводный или близкий к этому состоянию фтористый водород почти мгновенно обугливает фильтровальную бумагу. Этой пробой иногда пользуются для контроля степени его обезвоживания. Более точно такой контроль осуществляется определением электропроводности у безводного фтористого водорода она ничтожно мала, но даже следы воды (как и многих других примесей) резко ее повышают. Многие неорганические соединения хорошо растворимы в жидком НF, причем растворы являются, как правило, проводниками и электрического тока. Жидкий фтористый водород является лучшим из всех известных растворителем белков. Растворы воды и солей в жидком фтористом водороде хорошо проводят электрический ток. Химическая активность НF существенно зависит от отсутствия или наличия воды. Сухой фтористый водород не действует на большинство металлов. Не реагирует он и с оксидами металлов. Однако если реакция с оксидом начнется хотя бы в ничтожной степени, то дальше она некоторое время идет с самоускорением, так как в результате взаимодействия по схеме МО + 2 НF = МF2 + Н2О количество воды увеличивается. На взаимодействии НF и SiO2 основано применение фтористого водорода для травления стекла. При этом вследствие удаления частичек SiO2 его поверхность становится матовой, что и используют для нанесения на стекло различных меток, надписей и т.п. В водном растворе НF ведет себя как одноосновная кислота средней силы. Продажный раствор этой фтористоводородной (иначе, п л а в и к о в о й) кислоты содержит обычно 40% НF. Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59 кДж/моль). Весьма характерно для фтористого водорода образование продуктов присоединения к фторидам наиболее активных металлов. Соединения эти, как правило, хорошо кристаллизуются и плавятся без разложения. Примером могут служить производные калия - КF·НF (т. пл. 239°С), КF·2НF (62°С), КF·3НF (66°С) и КF·4НF (72°С). Строение этих продуктов присоединения отвечает, вероятно, формулам вида К [F(НF) n] с водородными связями между ионом F- и молекулами HF. Разбавленные растворы гидродифторида калия (КНF2) применяются иногда для удаления пятен от ржавчины. Атом, молекула гидрофторида. Связь Н-F характеризуется ядерным расстоянием 0,92 А. По отношению к нагреванию фтористый водород очень устойчив: его термическая диссоциация становится заметной лишь около 3500°С. Молекула НF весьма полярна (m = 1,74). С наличием на атомах значительных эффективных зарядов хорошо согласуется резко выраженная склонность фтороводорода к ассоциации путем образования водородных связей по схеме ···Н-F···Н-F···. Энергия такой связи составляет около 33,4 кДж/моль, т.е. она прочнее, чем водородная связь между молекулами воды. Кристаллы твердого фтористого водорода слагаются из зигзагообразных цепей ···Н-F···Н-F···Н-F···, образованных при посредстве водородных связей. Фтористый водород ядовит. Хроническое отравление фторидами может быть вызвано как повышенным их содержанием в питьевой воде, так и вдыханием их с воздухом в виде пыли. В результате подобного отравления наблюдается разрушение зубной эмали. Существенно увеличивается также хрупкость костей, что создает предпосылки для их переломов. Применение фтористого водорода. Практическое применение НF довольно разнообразно. Безводный используется главным образом при органических синтезах, а плавиковая кислота - для получения фторидов, травления стекла, удаления песка с металлического лития, при анализах минералов и т.д. Безводный фтористый водород реагирует с металлами, стоящими в ряду напряжений до водорода (за исключением Al, Mg, Pb, Fe, Ni). Ф. в. взаимодействует со многими окислами, например SiO2 + 4HF = SiF4 + 2H2O (реакция травления стекла). Фтористый водород присоединяется к органическим соединениям по кратной связи, а в ряде случаев вызывает полимеризацию этих соединений. При действии фтористый водород в присутствии катализатора на полигалогеналканы фтор замещает в них галоген. Фтористый водород служит хорошим растворителем неорганических и органических соединений; при этом, в отличие от водных растворов, электролитической диссоциации подвергается сам фтористый водород, а не растворённое вещество. Фтористый водород токсичен; попадание на кожу вызывает ожоги, пары HF раздражают верхние дыхательные пути. Предельно допустимая концентрация паров Ф. в. в воздухе 0,0005 мг/л. Первая помощь - вдыхание кислорода; при попадании на кожу - погружение обожжённого участка в ледяной насыщенный раствор сернокислой магнезии или 70%-ный этиловый спирт. Методы получения Получение HF из плавикового шпата и концентрированной серной кислоты в печи газ химический сырье технологический Получение фтористого водорода основано на обработке тонкоизмельченного плавикового шпата 90-92%-ной серной кислотой: СаF2 + H2SO4 = 2НF + СаS04 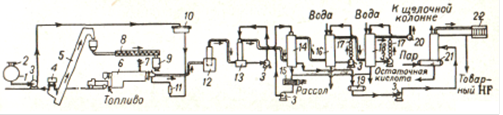 Рис. 1. Схема производства безводного фтористого водорода: 1 - резервуар для серной кислоты; 2 -воздушный клапан; 3-насос; 4 -вагонетка для плавикового шпата; 5 -элеватор; 6 -печь; 7 - дымовая труба; 8 -шнек; 9 -бункер для шпата; 10-напорный бак для серной кислоты; 11 - ротаметр; 12 - пылеуловитель; 13-скруббер для промывки газа серной кислотой; 14-абсорбционная колонна, выпускающая 80%-ную плавиковую кислоту; 15-холодильник для кислоты; 16 - абсорбционная колонна, выпускающая 60%-ную плавиковую кислоту; 17-холодильник; 18-абсорбционная колонна, выпускающая 30%-ную плавиковую кислоту; 19-приемник для 80%-ной плавиковой кислоты; 20 - вентилятор; 21- ректификационная колонна; 22-дефлегматор. На рис. 1 показана схема производства безводного фториcтого водорода. Плавиковый шпат, содержащий не менее 97% СаF2 и не больше 1% SiO2 и 1% СаСО3, проходящий через сито 6400 отв/см2, поступает через автоматический питатель в печь, где разлагается при 230° 99%-ной серной кислотой. Цилиндрическая печь из мягкой стали диаметром 1,82 м, длиной 12,2 м, с наклоном 1:48, делает 1 об/мин. Сульфат кальция выгружается непрерывно. Газ промывается в скруббере серной кислотой и поступает в две параллельно работающие стальные абсорбционные колонны, где образуется 80%-ная плавиковая кислота, затем проходит последовательно еще две пластмассовые абсорбционные колонны, в которых образуется 60%- и 30%-ная плавиковая кислота. Циркулирующие кислоты охлаждаются в рассольных холодильниках. Перед выпуском в атмосферу газ промывают щелочью в колонне с коксовой насадкой. 80%-ная плавиковая кислота подвергается ректификации в медной колпачковой колонне; отбираемый дистиллят представляет собой товарный продукт - жидкий фтористый водород, а кубовый остаток - 60%-ная плавиковая кислота - поступает в стальные, гуммированные неопреном резервуары и оттуда на питание абсорбционных колонн, где укрепляется до 80% НF. Для удаления из жидкого фтористого водорода небольших количеств воды, которые невозможно отделить простой дистилляцией, его обрабатывают 90-100%-ной серной кислотой в экстрактивно-дистилляционной колонне. В верхнюю часть колонны подают серную кислоту, в середину колонны - жидкий НF. Избыточное давление в колонне 0,35-0,7 атм; температура вверху 27-50°, внизу 150-180°. С верха колонны отводится безводный НF, а снизу - 80%-ная серная кислота. Повышенная температура внизу колонны и разбавление серной кислоты обусловливают гидролиз образующейся в небольшом количестве фторсульфоновой кислоты. Получение HF из кремнефтористоводородной кислоты через фторид аммония и бифторид натрия Такой процесс разработан фирмой Гановер (Goulding Chemical Ltd., of Dublin, Eire, and ISC Chemical). Принципиальная схема процесса представлена на рис. 2.  Рис. 2. Схема получения безводного фтористого водорода, разработанная фирмой Hanover: 1,6 - реакторы аммонизации; 2 - фильтр для отделения SiO2; 3 - реактор; 4 - кристаллизатор; 5 - центрифуги; 7 - реактор разложения; 8 - сушилка; 9 - барабанная печь; 10 - охладительная башня; 11 - конденсатор; 12 - ректификационная колонна; 13 - емкость для хранения безводного HF; 14 - насосы. Нейтрализация H2SiF6 аммиаком осуществляется в реакторе с мешалкой 1. Образующийся SiO2 затем отделяют на фильтре 2. На второй стадии раствор NH4F взаимодействует с рециркулирующим раствором КF при 125°С: NH4F + KF = KHF2 + NH3 Выделяющийся аммиак подают на стадию нейтрализации, а раствор КНF2 поступает на кристаллизацию. Кристаллы бифторида калия отделяют на центрифуге 5, промывают и подают в следующий реактор 7, где с помощью суспензии NaF бифторид калия разлагается согласно уравнению: KHF2 + NaF = KF + NaHF2 Далее раствор КF отделяют от кристаллического NaHF2 и он поступает на рециркуляцию. Бифторид натрия сушат и направляют во вращающуюся барабанную печь на разложение. Здесь при температуре 300°С протекает реакция: NaHF2 = NaF + HF Выделяющийся НF охлаждают, очищают от пыли, конденсируют и после ректификации он поступает на склад. Маточный раствор после кристаллизации КHF2 содержит примесь P2O5, которую необходимо удалить с целью его дальнейшего использования. Для этого маточник обрабатывают аммиаком; образующийся триаммонийфосфат отделяют на центрифуге. Выбор такого метода получения безводного НF обусловлен тем, что непосредственное разложение бифторида калия затруднено вследствие его плавления, а получение бифторида натрия из фторида аммония невозможно вследствие его высокой растворимости, что не позволяет выделять его из раствора путем кристаллизации; применение упарки для этих целей неэкономично. Разработанный процесс основан на использовании 20% - ной H2SiF6; применение менее концентрированных растворов требует внесения в схему процесса некоторых изменений. Получение HF основано на одновременном осаждении фторида кальция и оксида кремния при нейтрализации кремнефтористоводородной кислоты известью Метод разработан Bureau of Mines. В результате которого протекают следующие реакции при температуре 1050 оС: H2SiO3 + Ca(OH)2 + 2SiO2 + 2H2O(п.) = 3СaSiO3 + (6HF + 3H2O)газ Затем при температуре 400оС: 6HF + 6NaF = 6NaF HFтв = 6NaF + 6HF Бифторид натрия, содержащийся в растворе, утилизируют путем превращения его в криолит. 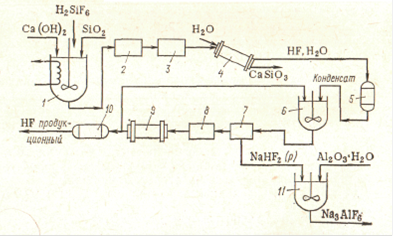 Рис. 3. Схема получения HF и криолита с использованием кремнефтористоводородной кислоты: 1,6 - реакторы; 2,7 - фильтры; 3 - гранулятор; 4 - печь обжига; 5,10 - конденсаторы; 8 - сушилка; 9 - печь отгонки HF; 11 - реактор получения креолита. Нейтрализацию H2SiF6 проводят в реакторе 1до рН = 9 - 9,5. Одновременно в реактор 1 добавляют диоксид кремния в количестве 2 моль на 1 моль H2SiF6. Далее смесь гранулируют и обжигают в печи 4при температуре 1000-1050°С. Пары НF в смеси с Н2О конденсируются, образуя разбавленный раствор НF, который взаимодействует с NaF в реакторе с мешалкой 6. Суспензию бифторида отделяют на фильтре 7, твердый бифторид натрия сушат и обжигают при температуре 400°С. Выделяющийся НF конденсируется, а фторид натрия направляют на рециркуляцию. Осуществление данного способа на практике связано с большими трудностями. В первую очередь, это высокая коррозионная активность реакционной смеси (смесь НF с водяным паром). Кроме того, использование высокой температуры при обжиге шихты (СаF2 + SiO2) ведет к значительному потреблению энергии. Получение HF термическим разложением кремнефтористоводородной кислоты  Рис. 4. Схема получения HF из H2SiF6 по методу BUSS: 1 - концентрированная колонна; 2 - испаритель H2SiF6; 3 - абсорбционная колонна; 4 - фильтр кремнегеля; 5 - десорбционная колонна; 6 - водяной конденсатор; 7 - холодильник - конденсатор; 8,9 - ректификационная колонна. Процесс состоит из следующих стадий: 1. Концентрирование и разложение кремнефтористоводородной кислоты на НF и SiF4. На этой стадии вначале H2SiF6 упаривается, затем ее подают в испаритель, где она испаряется при 150°С. 2. Абсорбция НF. Фтористый водород извлекается из смеси Н2О-НF-SiF4 органическими растворителями (полиэфиры или полигликоли). Небольшие количества абсорбированных Н2О и SiF4 десорбируют путем продувки растворителя чистым НF снизу абсорбционной колонны. 3. Десорбция и очистка НF. Насыщенный органический абсорбент поступает в вакуум-испаритель, где происходит десорбция НF. Абсорбент возвращают на стадию абсорбции, а пары НF конденсируют и затем подвергают двухстадийной очистке от примесей H2O и SiF4 в ректификационных колоннах. Тетрафторид кремния гидролизуется, SiO2 отделяется на фильтре, а кремнефтористоводородная кислота поступает в голову процесса. Этот метод отличается тем, что в процесс не вовлечены вспомогательные материалы, органический абсорбент рециркулирует в системе. Получение HF из плавикового шпата и концентрированной серной кислоты в печи наиболее современный и эффективный процесс. И в настоящее время этот метод получения используется в Свердловской области на ОАО «Полевском криолитовом заводе». Так как целью данного курсового проекта: получение HF - газа, то будем рассматривать часть схемы рис. 1: подвод исходного сырья, печь, отвод продуктов, обогрев печи. Печь с наружным обогревом, так как это позволяет получить газообразный фтористый водород с наименьшим количеством примесей. |
