Физиологические эффекты глюкокортикоидов. 19лл2 Евсеева Альбина ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ГЛЮКОКОРТИКОИДОВ. Физиологические эффекты глюкокортикоидов
 Скачать 149.37 Kb. Скачать 149.37 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра «Физиология человека» Курсовая работа по дисциплине «Нормальная физиология» на тему «Физиологические эффекты глюкокортикоидов» Специальность – 31.05.01 Лечебное дело
Руководитель: Работа защищена с оценкой Преподаватель Дата защиты Пенза-2020 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ «УТВЕРЖДАЮ» Зав. кафедрой ФЧ, д.м.н., проф., Н.И. Микуляк ЗАДАНИЕ на курсовую работу по дисциплине «Нормальная физиология» Тема: «Физиологические эффекты глюкокортикоидов» Необходимо: 1.Провести изучение источников литературы по заданной теме 2.Исследовать строение гормонов 3.Проанализировать эффекты глюкокортикоидов 4.Исследовать синтез, регуляцию, транспорт в крови и механизм действия гормонов 5.Рассмотреть последствия нарушения регуляции глюкокортикоидов Старший преподаватель Гусева Г. В. Содержание Введение. 4 Строение глюкокортикоидов……………………………………………………..5 Эффекты глюкокортикоидов………………………………………………..……6 Синтез глюкокортикоидов……………………………………...…………..……14 Регуляция глюкокортикоидов в крови………………………………….……….15 Транспорт в крови и механизм действия……………………………………......19 Нарушение регуляции глюкокортикоидов в крови. Гипо- и гиперфункция. .20 Заключение……………………………………………………………………...25 Список используемой литературы 26 Введение В коре надпочечников синтезируются около 59 различных гормонов, называемых кортикостероидами, или кортикоидами. Кортикостероиды включают две большие группы гормонов - глюкокортикоиды и минералокортикоиды. Глюкокортикоиды секретируются в пучковой зоне коры надпочечника и вовлечены в регуляцию широкого спектра функций поддержания гомеостаза. Глюкокортикоиды названы так потому, что их наиболее существенным влиянием является повышение концентрации глюкозы в крови. Кроме того, глюкокортикоиды влияют и на белковый, и на жировой обмены, что является столь же важной функцией, как и регуляция обмена углеводов с помощью этой группы гормонов. Более 30 стероидов выделены из коры надпочечников.Основным глюкокортикоидом является кортизол(объём секреции от 15 до 20 мг/сут, концентрация кортизола в крови около 12мкг/100 мл), другие глюкокортикоиды: кортизон, 11-дезоксикортизол, 11-дезоксикортикостерон, в меньших количествах секретируется также кортикостерон (примерно в 10 раз меньше, чем кортизола).Последний преобладает в коре надпочечников крыс. Особенно важно: кортизол, обладающий слабой минералокортикоидной активностью, ввиду громадной его продукции при некоторых синдромах может вызывать минералокортикоидные ответы наряду с более выраженными глюкокортикоидными влияниями. 1.Строение глюкокортикоидов В основе структуры кортизола, так же как и в основе строения холестерина, эргостерина, желчных кислот, витаминов группы D, половых гормонов и ряда других веществ, лежит конденсированная кольцевая система цикло-пентанпергидрофенантрена. Для всех биоактивных гормонов коркового вещества надпочечников характерны следующие структурные признаки: наличие двойной связи между 4-м и 5-м углеродными атомами, кетонной группы (С=О) у 3-го углеродного атома, боковая цепь (-СО-СН2-ОН) у 17-го углеродного атома(рис.1). Химические свойства кортикостероидов определяются наличием б, в-ненасыщенной кетонной группировки в кольце А и б-кетольной группировки в боковой цепи кольца D. Кетогруппа и гидроксил в положении 11 из-за стерических препятствий довольно инертны (не образуют гидразонов, семикарбазонов, не ацилируются) [1]. 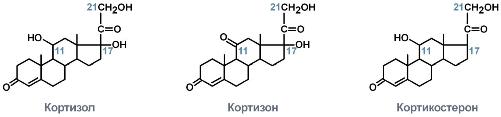 Рис.1 Строение глюкокортикоидов 2.Эффекты глюкокортикоидов Утрата кортикоидной функции надпочечников ведет (в отсутствие заместительной терапии) к летальному исходу. Критически важными в этом состоянии являются, очевидно, глюкокортикоиды. Избыточное либо недостаточное содержание в крови глюкокортикоидов (независимо от причин сдвига) вызывает ряд серьезных осложнений, непосредственно обусловленных воздействием этих гормонов на обмен веществ [1]. Глюконеогенез. Само название «глюкокортикоиды» связано со способностью гормонов этой группы стимулировать образование глюкозы. Стимуляция обеспечивается координированным гормональным воздействием на разные ткани и разные метаболические последовательности и включает как катаболические, так и анаболические эффекты. Глюкокортикоиды способствуют повышению выработки глюкозы в печени посредством 1) увеличения скорости глюконеогенеза; 2) стимуляции высвобождения аминокислот – субстратов глюконеогенеза – из периферических тканей (мышечной, лимфоидной) через активацию катаболических процессов; 3) «пермиссивного действия», позволяющего другим гормонам стимулировать ключевые метаболические процессы, в том числе глюконеогенез, с максимальной интенсивностью. Таким образом, глюкокортикоиды необходимы для проявления максимального эффекта других гормонов. Кроме того, глюкокортикоиды тормозят потребление и использование глюкозы во внепеченочных тканях, происходит уменьшение потребления глюкозы внутренними органами (кроме головного мозга). В итоге результат их действия состоит в повышении уровня глюкозы в плазме. У здоровых животных это влияние уравновешивается инсулином. Сбалансированность этих двух воздействий обеспечивает нормальный уровень глюкозы в крови; если же имеет место инсулиновая недостаточность, то введение глюкокортикоидов вызывает гипергликемию; в противоположном случае – при недостаточности глюкокортикоидов – снижается выработка глюкозы, уменьшаются запасы гликогена и резко возрастает чувствительность к инсулину. Чувствительность тканей к инсулину глюкокортикоиды снижают, а контринсулярные метаболические эффекты могут вести к развитию стероидного сахарного диабета. Глюкокортикоидные гормоны усиливают глюконеогенез путем повышения количества и активности ряда ключевых ферментов в печени. Подробно изучена индукция отдельных ферментов, которые катализируют скорость-лимитирующие этапы деградации аминокислот. Было показано, как глюкокортикоиды регулируют транскрипцию генов. Ферментом, лимитирующим скорость глюконеогенеза, является фосфоенолпируват- карбоксикиназа (ФЕПКК). Синтез этого фермента усиливается глюкагоном и в меньшей степени глюкокортикоидами. Сочетание этих гормонов дает аддитивный эффект. Инсулин тормозит синтез ФЕПКК, оказывая более сильное действие, чем оба индуктора вместе взятые. Все эти эффекты проявляются на уровне транскрипции генов. Подавление внепеченочного синтеза белков и стимуляция печеночного синтеза ферментов отражает действие глюкокортикоидов на обмен нуклеиновых кислот. Гормоны подавляют синтез нуклеиновых кислот (ДНК и РНК) во всем организме, кроме печени, где усиливается РНК. Синтез гликогена. Глюкокортикоиды увеличивают запасы гликогена в печени как голодных, так и сытых животных (на этой основе был разработан метод определения эффективности глюкокортикоидных гормонов). Это осуществляется посредством превращения неактивной формы гликогенсинтазы в активную, вероятно, путем активации фосфатазы, которая способствует этому превращению. Липидный обмен. Избыточные количества глюкокортикоидов стимулируют липолиз в одних частях тела (конечности) и липогенез – в других (лицо и туловище). Сами гормоны стимулируют катаболизм триглицеридов и подавляют синтез жира из углеводов. Однако из-за гипергликемии и повышения секреции инсулина синтез жира повышается, и уменьшение жировой ткани конечностей нередко сочетается с увеличением отложения жира на брюшной стенке, шее, лице («луноподобное лицо») и между лопатками («бизонов горб»). У людей, получающих глюкокортикоиды, возрастает уровень свободных жирных кислот в плазме крови. Частично это можно объяснить прямой стимуляцией липолиза, поскольку в опытах на изолированных гепатоцитах эти гормоны действительно способствуют высвобождению свободных жирных кислот. Кроме того, глюкокортикоиды снижают потребление и использование глюкозы жировой тканью и тем самым уменьшают образование глицерола; поскольку глицерол необходим для этерификации жирных кислот, снижение его содержания приводит к их высвобождению в плазму. В итоге повышение концентрации свободных жирных кислот и сопряженное с этим усиление их превращения в кетоны способствуют развитию кетоза, особенно при инсулиновой недостаточности. Функции сердечно-сосудистой системы. Глюкокортикоиды необходимы для поддержания нормального кровяного давления и минутного объема сердца. При этом они, видимо, не оказывают прямого физиологического действия, но требуются для проявления максимального эффекта катехоламинов (хороший пример «пермиссивного действия» глюкокортикоидов в отношении других гормонов). Глюкокортикоиды повышают чувствительность гладких мышц сосудов к катехоламинам, усиливают прессорные эффекты ангиотензина II, уменьшают проницаемость капилляров, поэтому на фоне глюкокортикоидов повышается спазм сосудов, особенно мелкого калибра, и возрастает артериальное давление. Это свойство лежит в основе таких явлений, как язвы желудка и двенадцатиперстной кишки, нарушение микроциркуляции в сосудах миокарда и как следствие – развитее аритмий, нарушение физиологического состояния кожных покровов – экземы, псориаз. В больших дозах глюкокортикоиды увеличивают сердечный выброс. Водно-солевой обмен. У людей с недостаточностью глюкокортикоидов нарушается экскреция воды. Это может быть связано с изменением секреции АДГ. Действительно, было показано, что глюкокортикоиды тормозят секрецию АДГ; следовательно, в отсутствие глюкокортикоидов уровень АДГ может возрастать, что способствует задержке воды в организме. В низких концентрациях глюкокортикоиды вызывают повышение диуреза – за счет увеличения скорости клубочковой фильтрации и, возможно, за счет угнетения выброса АДГ. Кроме того, при глюкокортикоидной недостаточности падает скорость клубочковой фильтрации, что может повлечь за собой снижение клиренса несвязанной воды. Подобно минералокортикоидам, глюкокортикоидные гормоны увеличивают выработку ангиотензиногена, а соответственно – и ангиотензина II; в итоге они способствуют повышению кровяного давления, усиливают задержку натрия и вызывают выведение калия. Вместе с тем некоторые эффекты глюкокортикоидов на электролитный обмен обусловлены собственной минералокортикоидной активностью этих соединений. При высоких концентрациях глюкокортикоиды вызывают задержку натрия и воды (увеличивается их реабсорбция в почечных канальцах) и повышают выведение (секрецию) ионов калия. В связи с задержкой ионов натрия возрастает объем плазмы, гидрофильность тканей, повышается артериальное давление. Больше выводится ионов кальция (особенно при повышенном содержании его в организме). Глюкокортикоиды в кишечнике тормозят всасывание кальция, способствуют выходу последнего из костной ткани и выведению его с мочой. Рост и развитие соединительной ткани, мышц и костей. Глюкокортикоиды в высоких концентрациях оказывают катаболический эффект. Они тормозят рост и деление фибробластов, а также продукцию коллагена, гиалуроновой кислоты и фибронектина. Это ведет к ослаблению структурной основы кожи и соответственно к типичным для избыточности глюкокортикоидов в организме явлениям, а именно истончению кожи, ее быстрой повреждаемости, плохому заживлению ран, дряблости кожи, появлению морщин. Глюкокортикоиды подавляют фазу анагена цикла роста волоса, вызывая, таким образом, нарушение отрастания волос, ведущее к облысению. Гормоны снижают секреторную активность сальных желез, вызывают аномальное распределение кальция в коже (кальциноз кожи) и в других тканях. Мышцы служат основным источником субстратов глюконеогенеза – аминокислот, а потому являются первичной мишенью действия глюкокортикоидов. Это действие состоит в торможении синтеза белков, РНК и ДНК и стимуляции распада РНК и белков. При введении глюкокортикоидов даже при достаточном белковом питании возникает отрицательный азотистый баланс. Выражением этого является усиленное выведение с мочой азотистых продуктов обмена веществ. Повышается экскреция с мочой всех азотсодержащих фракций: аммиака, мочевины, мочевой кислоты, аминокислот. Тяжелая атрофия и мышечная слабость характерны для больных, длительное время подвергавшихся воздействию избытка глюкокортикоидов. В костной ткани глюкокортикоиды тормозят деление клеток и их функцию (отложение коллагена), способствуют выведению кальция из организма, а также усиливают действие паратиреоидного гормона. Они тормозят рост, развитие и регенерацию костей. Конечный результат действия этих гормонов – уменьшение массы костей (остеопороз). У детей нарушается формирование тканей, рост. Известно также, что кортизол подавляет выделение соматотропного гормона (гормона роста). Роль глюкокортикоидов в «стрессовых реакциях». Глюкокортикоиды во многих случаях необходимы в реакции типа «борьба или бегство» для проявления максимальной активности отдельных компонентов реакции, в первую очередь катехоламиновых гормонов. Более непосредственным образом глюкокортикоиды участвуют в физиологическом ответе на острый стресс, связанный с хирургическим вмешательством, травмой или инфекцией. В этих обстоятельствах секреция кортизола возрастает в несколько раз, и если этот ответ ослаблен, то шансы на выживание значительно снижаются. При недостаточности секреции глюкокортикоидов понижается сопротивляемость различным вредным воздействиям, поэтому инфекции и другие патогенные факторы переносятся тяжело и нередко приводят к гибели. Влияние на другие функции. Глюкокортикоиды повышают секрецию соляной кислоты и пепсина в желудке, что вместе с сосудосуживающим действием приводит к появлению язв желудка [1]. Глюкокортикоиды влияют и на деятельность ЦНС, на функцию ВНД – они повышают обработку информации, улучшают восприятие внешних сигналов, действующих на многие рецепторы – вкусовые, обонятельные и т.п. Глюкокортикоиды повышают сенсорную чувствительность и возбудимость нервной системы, участвуют в осуществлении стрессовых реакций, влияют на психику человека. Однако при недостатке и, особенно, при избыточном содержании глюкокортикоидов наблюдаются существенные изменения в состоянии ВНД – вплоть до возникновения шизофрении (при длительном стрессе). Нарушения со стороны ЦНС проявляются эйфорией, психомоторным возбуждением, психотическими реакциями. Глюкокортикоиды возбуждают ЦНС, приводят к бессоннице, эйфории, общему возбуждению. Иммунный ответ. Глюкокортикоиды - активные иммунодепрессанты, в высокой концентрации тормозят иммунологический ответ организма - хозяина. Глюкокортикоиды оказывают влияние на пролиферацию лимфоцитов в ответ на антигены и в меньшей степени – на митогены. Кроме того, они могут влиять и на некоторые другие этапы иммунного ответа, в том числе на процессинг антигена макрофагами, выработку антител В-лимфоцитами, супрессорную и хелперную функции Т-лимфоцитов и метаболизм антител. Большая часть этих эффектов наблюдается при высоких (превышающих физиологические) концентрациях глюкокортикоидов, т.е. при тех дозах стероидов, которые используются для лечения аутоиммунных заболеваний или для подавления реакции при пересадке тканей. Снижается гиперчувствительность и сенсибилизация организма. Иммунодепрессивный эффект достигается за счет снижения количества Т- лимфоцитов (хелперов) в крови и снижения их влиянии на выработку иммуноглобулинов и содержания В-лимфоцитов; блокада на поверхности макрофагов Fс-рецепторов для иммуноглобулинов, а также для С3 компонента системы комплемента на поверхности макрофагов и клеток, подвергающихся цитолизу; подавления способности лейкоцитов и тканевых макрофагов реагировать на антиген и митогены, снижать выработку макрофагами ИЛ-1 и других факторов, инволюции лимфоидной ткани (вилочковой железы, селезенки, лимфатических узлов); ускорения катаболизма иммуноглобулинов уменьшения образования интерферона; подавления выработки антител (вызывают только очень высокие дозы глюкокортикоидов спустя неделю после начала терапии); защиты клеток от деструкции медиаторами воспалительной реакции, образующимися в результате реакции антиген-антитело. Надо учитывать, что выраженное иммуносупрессивное действие глюкокортикоидов приводит к угнетению механизмов иммунной защиты и может способствовать генерализации инфекционного процесса. Воспаление. Способность глюкокортикоидов подавлять воспалительную реакцию широко известна. Именно на ней главным образом базируется применение этих гормонов в клинике. Глюкокортикоиды тормозят накопление лейкоцитов в участках воспаления, но стимулируют высвобождение из лейкоцитов веществ, участвующих в воспалительной реакции (кининов, плазминоген-активирующего фактора, простагландинов и гистамина). Кроме того, в участках воспаления эти гормоны ингибируют пролиферацию фибробластов, а также некоторые функции этих клеток, например продукцию коллагена и фибронектина. Сочетание указанных эффектов ведет к плохому заживлению ран, повышенной чувствительности к инфекции и снижению воспалительного ответа, что обычно наблюдается у больных с избытком глюкокортикоидов. Глюкокортикоиды тормозят все компоненты воспалительной реакции – уменьшают проницаемость капилляров, тормозят экссудацию, снижают интенсивность фагоцитоза. Это свойство используют в клинической практике. Противовоспалительный эффект достигается за счет влияния на процессы альтерации за счет улучшения микроциркуляции в очаге воспаления и стабилизации клеточных и субклеточных мембран; влияния на процессы эксудации (ведущий момент) за счет: стимуляции синтеза липомодулина – фермента-ингибитора фосфолипазы А2, что снижает гидролиз мембранных фосфолипидов, высвобождение арахидоновой кислоты и дальнейшее образование ПГ и ЛТ, угнетение активности циклооксигеназы II (ЦОГ II), уровень которой резко повышается при воспалении; влияние на процессы пролиферации за счет: ограничения миграции моноцитов, лимфоцитов, эозинофилов и базофилов из сосудистого русла в очаг воспаления путем их перемещения в лимфоидную ткань, ограничения прилипания к эндотелию сосудистой стенки и снижения проницаемости последней; торможения деления фибробластов, синтеза мукополисахаридов и снижения активности ферментов, вызывающих деструкцию коллагена, хрящевой и костной ткани. Воспалительная реакция подавляется во всех фазах независимо от вызвавшей ее причины, что очень ценно при гиперергическом воспалении, но может быть опасно при инфекциях из-за ограничения защитной воспалительной реакции. Дыхательная система. Введение глюкокортикоидов может уменьшить отёк слизистой оболочки, развивающийся, например, при бронхиальной астме. Глюкокортикоиды ускоряют окончательное созревание легких плода, в частности, стимулируя эндогенную выработку сурфактанта и встраивание холина в фосфатидилхолин. Статическое сопротивление легких у недоношенных младенцев выше; часто оно слишком велико, чтобы обеспечить спонтанную вентиляцию легких, необходимую для выживания новорожденного [1]. Дефицит глюкокортикоидов вызывает гипогликемию, снижение адренореактивности сердечно-сосудистой системы, замедление сердечного ритма, гипотензию, нейропению, эозинофилию и лимфоцитоз, снижение сопротивляемости организма инфекциям [5]. 3.Синтез глюкокортикоидов Стероидные гормоны надпочечников образуются из холестерола, который главным образом поступает из крови в эндокринные клетки липопротеинов низкой плотности. Незначительное количество холестерола синтезируется в самих эндокринных клетках in situ из ацетил-КоА через промежуточное образование мевалоната и сквалена. Значительная часть холестерола подвергается в надпочечниках этерификации и накапливается в цитоплазме в липидных пузырьках в виде его эфиров. При стимуляции надпочечников посредством АКГТ (или цАМФ) происходит активация эстеразы и образующийся свободный холестерол транспортируется в митохондрии, где превращается в прегненолон. У млекопитающих и человека все стероидные гормоны синтезируются из холестерола через промежуточное образование прегненолона в ходе последовательных реакций, которые протекают в митохондриях либо эндоплазматическом ретикулюме клеток надпочечников. Рис. 2. Пути синтеза стероидных гормонов надпочечника. Выделенные двойным контуром превращения в норме происходят вне надпочечника.Стероидогенез (рис.2) обеспечивает множество ферментов, расположенных в митохондриях, цитозоле и гладкой эндоплазматической сети. Подавляющее большинство превращений в коре надпочечников, осуществляют ферменты, относящиеся к группе цитохромов [3]. Для синтеза кортизола необходимы три фермента гидроксилазы. Во время стероидогенеза в клетках клубочковой и пучковой зон происходит челночное движение субстратов: их вход в митохондрии и выход из них, так как некоторые ферменты митохондриальные, а другие – ферменты гладкого эндоплазматического ретикулума [8]. 4.Регуляция глюкокортикоидов в крови Регуляция синтеза и секреции. Глюкокортикоиды — производные холестерола — относятся к неполярным, поэтому они свободно проникают через биологические мембраны. По этой причине секреция этих гормонов происходит без участия секреторных пузырьков. Секреция кортизола зависит от АКТГ, выделение которого в свою очередь регулируется кортикотропин-рилизинг-гормоном (КРГ, кортиколиберин). Эти гормоны связаны между собой классической петлей отрицательной обратной связи (Рис.3). Кортиколиберин поступает в кровь гипоталамо-гипофизарной воротной системы из гипоталамуса. Повышение уровня свободного кортизола тормозит секрецию КРГ. Падение уровня свободного кортизола ниже нормы активирует систему, стимулируя высвобождение КРГ гипоталамусом. Этот пептид, состоящий из 41 аминокислотного остатка, усиливает синтез и высвобождение АКТГ (из молекулы предшественника пропиомеланокортина). В коре надпочечников АКТГ связывается со специфическим рецепторами на клеточной поверхности, которые через гуаниннуклеотидсвязывающий белок стимулируют аденилатциклазу. Это приводит к повышению уровня цАМФ, который стимулирует протеинкиназу А. Протеинкиназа А способствует переносу холестерина из цитозоля в митохондрии, где расположен первый фермент расщепления боковых цепей. Также АКТГ повышает скорость отщепления боковой цепи от холестерола – реакции, лимитирующей скорость стероидогенеза в целом. Указанные процессы составляют одну из сторон петли отрицательной обратной связи. По мере нормализации уровня свободного кортизола в крови происходит снижение секреции КРГ гипоталамусом, что ведет к снижению выработки АКТГ гипофизом, а соответственно и кортизола - надпочечниками; таким образом, выполняется вторая половина петли обратной связи. Этот сложный механизм обеспечивает быструю регуляцию уровня кортизола в крови. Высокие дозы глюкокортикоидов оказывают угнетающее влияние на гипоталамо-гипофизарно-надпочечниковую систему (по принципу обратной связи). Это проявляется в уменьшении продукции АКТГ. Развивающаяся при этом недостаточность коры надпочечников особенно ярко проявляется при резкой отмене приема глюкокортикоидных препаратов. 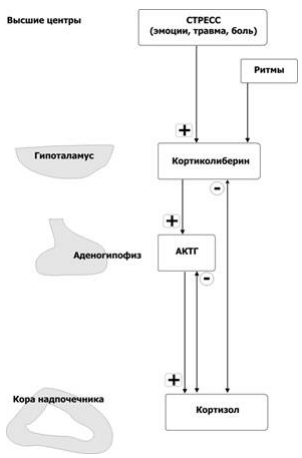 Рис. 3.Регуляторные контуры в системе «Кортиколиберин–АКТГ–кортизол».Символами «+» и «-» обозначены стимулирующие и тормозящие влияния.Высвобождение АКТГ (и секреция кортизола) регулируется нервными импульсами, поступающими из различных отделов нервной системы. Существует эндогенный ритм, определяющий секрецию КРГ, а, следовательно, и АКТГ. Этот циркадный ритм в крови настроен так, чтобы обеспечивать увеличение кортизола в крови вскоре после засыпания. Во время сна уровень кортизола продолжает возрастать, достигая пика вскоре после засыпания, затем постепенно падает до минимальных величин к концу дня и в ранние вечерние часы.[7] Эта общая динамика возникает в результате последовательных эпизодов импульсного выброса кортизола, которым предшествует импульсная секреция АКТГ. Все вместе эти события составляют сложный цикл, зависящий от светового периода и циклов питания-голодания и сна-бодрствования. Увеличение концентрации кортизола рано утром частично может быть обусловлено отсутствием приемов пищи в течение ночи. У людей, постоянно ведущих ночной образ жизни (например, рабочие третьей смены), характер выделения кортизола может быть изменен. Исчезновение суточной периодичности секреции стероидов обычно связано с патологией гипоталамо-гипофизарной системы, некоторыми видами депрессивных состояний, а также с дальними перелетами через несколько часовых поясов. На секрецию кортизола влияют также физический и эмоциональный стрессы, состояние тревоги, страха, волнения и боль. Эти реакции могут нивелировать воздействия системы отрицательной обратной связи и суточного ритма. Стрессовые стимулы активируют всю нисходящую систему влияний, вызывая быстрое выделение кортизола [4]. При беременности плацента вырабатывает ряд гормонов, в том числе и участвующие в регуляции уровня глюкокортикоидов в крови: хориальный АКТГ, плацентарный кортиколиберин. Причем в к родам концентрация плацентарного кортиколиберина в крови возрастает [1]. В середине 20-х годов Хенч обратил внимание на то, что при беременности происходит улучшение состояния больных ревматоидным артритом (хроническое прогрессирующее аутоиммунное воспаление многих суставов конечностей). Постепенно у Хенча нарастало убеждение, что в организме имеется гипотетическая антиревматоидная субстанция X, которая уменьшает ревматоидные проявления во время беременности и при желтухе. Поиск субстанции X активно проводился в течение 1930-х годов. Были испытаны экстракты из разных органов и тканей, но постепенно внимание Хенча целиком переключилось на гормоны. В 1938 г. случайное знакомство Хенча с известным биохимиком Кенделлом переросло во многолетнее сотрудничество. С начала 1930-х годов Кенделл терпеливо и упорно занимался выделением и изучением кортикостероидных гормонов. В 1934 г. совместно с Mason и Meyers он выделил соединение E (кортизон), а в 1936 г. - соединение F (кортизол). Химическую структуру обоих веществ он определил в 1937 - 1938 гг. Между тем стало известно, что командование германских военно-воздушных сил использовало полученные кортикостероиды для повышения боеспособности своих летчиков. Возможность использования кортикостероидов в качестве допинга в военных целях дало резкий толчок к изучению этих гормонов в США. К 1941 г. в следствие выделения кортикостероидов из надпочечников телят было установлено их действие в виде усиления мышечной активности, повышения углеводного обмена и повышения физиологической устойчивости к физическим нагрузкам, холоду и токсическим веществам, как, например, к тифозной вакцине. Хенч писал, что когда во время одной из встреч Кенделл рассказал ему о физиологическом действии кортикостероидов, он вспомнил о своих наблюдениях о благоприятном действии противотифозной вакцины на больных ревматоидным артритом. 5.Транспорт в крови и механизм действия Кортизол в плазме крови находится в связанной с белками и свободной формах. Основной связывающий белок плазмы – это α-глобулин, называемый транскортином (кортикостероид-связывающий белок). Транскортин вырабатывается в печени, и синтез этого белка стимулируется эстрогенами. При содержании кортизола в плазме крови в пределах нормы большая часть гормона связана с транскортином и значительно меньшее количество – с альбумином. Механизм действия. Глюкокортикоиды липофильны. Свободные гормоны легко диффундируют сквозь плазматическую мембрану любой клетки. Но только в клетках- мишенях они находят свой специфический рецептор, имеющий высокую степень сродства к гормону. Рецептор глюкокортикоидов — ядерный фактор транскрипции — полипептид с Mr 94 кД, обнаружен практически во всех ядерных клетках. В цитоплазме клетки - мишени рецептор находится в комплексе с молекулярными шаперонами (например, с белком теплового шока hsp90). При связывании кортизола с рецептором молекула шаперона отсоединяется, а комплекс «кортизол–рецептор» перемещается в ядро клетки– мишени. Гормон - рецепторный комплекс связывается со специфической областью ДНК и активирует специфические гены. В результате избирательного действия на транскрипцию генов и синтез соответствующих мРНК происходит изменение содержания определенных белков, что сказывается на активности тех или иных процессов метаболизма. Регуляция скорости транскрипции – это, по-видимому, важнейший элемент механизма действия глюкокортикоидных гормонов, но он не является единственным. Удалось выявить, что эти гормоны регулируют также процессинг и транспорт ядерных транскриптов, скорость распада специфических мРНК, посттрансляционный процессинг некоторых белков [2]. 6.Нарушение регуляции глюкокортикоидов в крови. Гипо- и гиперфункция Дефицит глюкокортикоидов (болезнь Аддисона, или бронзовая болезнь). Снижение продукции глюкокортикоидов делает невозможным поддержание нормальной концентрации глюкозы в крови в промежутках между приемами пищи, т.к. невозможен синтез глюкозы путем глюконеогенеза. Более того, снижены и многие другие метаболические функции в связи со снижением возможности мобилизации белков и жиров. Наибольший вред организму наносит именно слабость энергетического обеспечения на фоне дефицита кортизола (рис.4). Даже если в организме присутствует избыток глюкозы и других питательных веществ, у больных отмечается мышечная слабость, указывающая на то, что глюкокортикоиды необходимы для обеспечения других метаболических функций дополнительно к обеспечению энергетического обмена. Отсутствие должного уровня продукции глюкокортикоидов также делает пациента с болезнью Аддисона чрезвычайно восприимчивым к различным видам стрессов, и даже легкая респираторная инфекция может привести к смерти. Аддисонический криз. Как отмечалось ранее, на фоне физического или умственного стресса секретируются огромные количества глюкокортикоидов. У пациентов с болезнью Аддисона выброс глюкокортикоидов на фоне действующих стрессоров не происходит, поэтому при действии любого стресса (травмы, заболевания, хирургических вмешательств и др.) человек может испытывать состояние, похожее на болезнь Аддисона в связи с острым дефицитом гормонов коры надпочечников, т.е. у него возникает острая недостаточность коры надпочечников, требующая для предотвращения гибели организма введения десятикратных по сравнению с нормой доз глюкокортикоидов. Такую острую потребность во введении избытка глюкокортикоидов, связанную с тяжелой недостаточностью коры надпочечников во время стресса, называют аддисоническим кризом [9].  Рис.4 Человек с болезнью Аддисона Гиперадренализм (синдром Иценко-Кушинга) Гиперсекреция коры надпочечников сопровождается комплексом последовательных гормональных ответов, названным синдромом Кушинга. Большинство нарушений при этом синдроме приписывают избытку кортизола, хотя гиперпродукция андрогенов также может иметь существенное значение. Избыток кортизола может развиваться в силу разных причин, включая: (I) аденому аденогипофиза, продуцирующую большое количество АКТГ, что вызывает гиперплазию надпочечника и гиперсекрецию кортизола; (2) нарушения функции гипоталамуса, приводящие к продуцированию большого количества кортикотропин-рилизинг гормона, стимулирующего высвобождение избытка АКТГ; (3) «эктопическую секрецию» АКТГ опухолями, расположенными где угодно, как в случае абдоминальной карциномы; (4) аденому коры надпочечников. Если синдром Кушинга возникает как следствие гиперсекреции АКТГ передней доли гипофиза, то он трактуется как болезнь Кушинга. Избыточная продукция АКТГ — наиболее общая причина развития синдрома Кушинга, которая характеризуется высоким уровнем как АКТГ, так и кортизола в плазме крови. Случаи первичной гиперпродукции кортизола составляют 20-25% клинических случаев синдрома Кушинга и обычно сочетаются со снижением уровня АКТГ в плазме вследствие ингибирования избытком кортизола продукции АКТГ по механизму отрицательной обратной связи. Введение большой дозы дексаметазона (синтетического глюкокортикоида) может быть использовано для дифференцирования АКТГ-зависимого и АКТГ-независимого варианта синдрома Кушинга. У пациентов с гиперпродукцией АКТГ, обусловленной секретирующей АКТГ аденомой аденогипофиза или гипоталамо-гипофизарными нарушениями, введение даже очень большой дозы дексаметазона не подавляет секрецию АКТГ. Напротив, пациенты с первичной адреналовой гиперпродукцией кортизола (АКТГ-независимой) имеют низкий или даже нерегистрируемый уровень АКТГ. Несмотря на широкое применение, дексаметазоновый тест иногда бывает поводом для неправильной диагностики, поскольку некоторые секретирующие АКТГ питуитарные опухоли в ответ на дексаметазон изменяют продуцирование АКТГ, поэтому дексаметазоновый тест рассматривают как первый шаг в дифференциальной диагностике синдрома Кушинга. Синдром Кушинга развивается также при длительном введении больших доз глюкокортикоидов с терапевтической целью. Так, у больных с хроническим воспалением, например ревматоидным артритом, могут проявиться некоторые клинические признаки синдрома Кушинга при длительном лечении глюкокортикоидами. Особенностью синдрома Кушинга является мобилизация жира из нижних частей тела с сочетанным отложением избытка жира на груди и в верхней области живота, что внешне создает впечатление бычьего торса. Избыточная продукция стероидов ведет также к появлению отечности на лице, а андрогенная активность некоторых гормонов приводит иногда к развитию акне и гирсутизма (избыточному росту волос на лице). Лицо приобретает лунообразный вид, как у больной с нелеченным синдромом Кушинга (рис.4). Около 80% таких больных имеют гипертензию, по-видимому, вследствие минералокортикоидного действия кортизола. Влияние на углеводный и белковый обмен. Избыток кортизола, продуцируемого при синдроме Кушинга, может быть причиной увеличения концентрации глюкозы в крови, иногда до 200 мг/дл после еды, что почти в 2 раза выше нормы. Это является результатом усиления глюконеогенеза и снижения использования глюкозы тканями. Влияния глюкокортикоидов на катаболизм белков при синдроме Кушинга очень обширны и повсеместно вызывают существенное уменьшение тканевых белков, за исключением печени; остаются без изменений и белки плазмы крови. Исчезновение белков из мышц является причиной резкой слабости. Снижение синтеза белков в лимфоидной ткани ведет к подавлению лимфоидной системы настолько, что многие больные погибают от инфекций. Даже белок коллагеновых волокон подкожных тканей истончается настолько, что появляются надрывы подкожной ткани, в результате становятся заметны багровые полоски (стрии) в местах частичных разрывов тканей. Резкое уменьшение белка в костях приводит к тяжелому остеопорозу с последующей ломкостью костей (рис.5). Лечение синдрома Кушинга. Лечение заключается в удалении, если это возможно, опухоли надпочечника, что приводит к снижению продукции АКТГ. Гипертрофия гипофиза и даже маленькие опухоли гипофиза с гиперпродукцией АКТГ могут удаляться хирургическим путем или облучением. Препараты, блокирующие стероидогенез, такие как метирапону кетоконазол и аминоглютетимиду или ингибиторы секреции АКТГ, такие как антагонисты серотонина, либо ингибиторы гамма-аминомасляной трансаминазы у могут быть использованы, когда хирургическое вмешательство невозможно. Если продукцию АКТГ снизить не удается, единственным удовлетворительным в данной ситуации методом лечения может быть двустороннее частичное или даже тотальное удаление надпочечников с последующей заместительной терапией [6]. 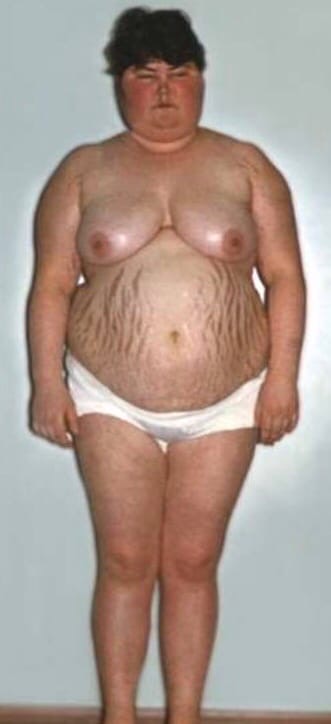 Рис.5 Человек с болезнью Кушинга Заключение Глюкокортикоиды прямо или опосредованно регулируют практически все виды обмена веществ и физиологические функции. Метаболические эффекты глюкокортикоидов проявляются, прежде всего, со стороны белкового, жирового и углеводного обменов. Надпочечники являются для нас незаменимым органом и выделяемые ими гормоны (особенно гормоны коры) жизненно необходимы организму. Заболевания надпочечников - тяжелая эндокринная патология, при которой нарушается гормональный фон и обмен веществ в организме. Негативное влияние на работу надпочечников оказывают аутоиммунные процессы, инфекционные заболевания, черепно-мозговые травмы. Надо сказать, что болеют они крайне редко - важнейший для жизни орган хорошо защищен. Но этим не стоит пренебрегать, от влияния очень многих вредных факторов мы можем сознательно избавить надпочечники. Проводя регулярные профилактические процедуры: посещение врача, своевременный анализ крови, избавление от вредных зависимостей - курение и алкоголя. Список используемой литературы 1. Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник. — 3-е изд., перераб. и доп.— М.: Медицина, 1998. — 704 с. 1998 2. Березняков И.Г. Глюкокортикостероиды: клиническое применение (пособие для врачей). Харьков. 1995. 42 с. 3. Гайтон, А.К. Медицинская физиология / А.К. Гайтоп, Дж.Э. Холл / Пер. с англ.; Под ред. В.И. Кобрина. — М.: Логосфера, 2008. — 1296 с. 4. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т. 1. Пер. с англ.: — М.: Мир, 1993. - 384 с. 5. Теппермен Дж., Теппермен X.- Физиология обмена веществ и эндокринной системы. Вводный курс: Пер. с англ.-М.: Мир,1989-656 с. 6. Физиология человека/Под ред. Г. И. Косицкого. — Ф50 3-е изд., перераб. и доп.— М.: Медицина, 1985. 544 с. 7. Физиология человека: Учебник/Под ред. В.М.Покровского, Г.Ф.Коротько. – 2-е изд., перераб. и доп. – М.: Медицина, 2003. – 656 с. 8. Физиология человека. В 3-х томах. Т. 2. Пер. с англ./ под ред. Р. Шмидта и Г. Тевса. -3-е изд.-М.: Мир, 2005. -314 с. 9. «Фундаментальная и клиническая физиология» Под редакцией Андрея Камкина и Андрея Каменского, Изд. Академия, 2004 г., 1072 с. 10. Холл Дж.Э. Медицинская физиология по Гайтону и Холлу/Дж.Э. Холл/Пер. с англ.; Под ред. В.И. Кобрина, М.М. Галагудзы, А.Е. Умрюхина. 2-е изд., испр. и доп. — М.: Логосфера, 2018. — 1328 с. |
