МИКРА. Физиология микробов
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
Время генерации некоторых видов бактерий при оптимальных условиях роста
Этапы БАКТЕРИОЛОГИЧЕСКОГО МЕТОДА проводится в 3 ЭТАПА
1 этап В лаборатории производят посев исследуемого материала на плотную среду с целью получения изолированной колоний. Для этого механическим путем разобщают бактериальные клетки методом секторального посева или техникой посева змеевидным штрихом. Затем чашку с посевом помещают в термостат и проводят культивацию в течение нескольких дней при 37 градусах. 2 этап Выросшую колонию отсеивают на среду накопления (скошенный агар, жидкие среды) Для этого используют селективные среды для вывода чистой культуры. Желточно-солевой агар – предназначен для выделения чистой культуры стафилококков с подавлением роста сопутствующих микроорганизмов (как грамотрицательных, так и грамположительных). Вырастающие стафилококки дифференцируются по наличию лецитовителазы ( проявление летитиназной активности) Чтобы сократить сроки проведения бактериологического метода культивацию изолированных колоний проводят на хромогенных или дифференциально-диагностических средах или кровяном агаре 5%, среда Эндо Часто используют универсальную среду- КРОВЯНОЙ АГАР На ней можно увидеть проявление гемолитической активности стрептококков( гемолитические зеленящиеся стрептококки), по характеру гемолиза вокруг колонии можно сделать вывод о наличии альфа/бета гемолитических ферментов. Проверка культуры на чистоту Из выросшей культуры готовят мазок и окрашивают его по грамму, если мазок однородный и клетки имеют одинаковые морфологические признаки и окрашиваются в один цвет, то культура чистая. Правила взятия исследуемого материала Предотвращение контаминации образца. Уменьшение доступа кислорода. Использование транспортных систем и сред тормозящих активную жизнедеятельность анаэробных видов бактерий (тиогликолевая среда, среда Стюарта, Среда Эймса и т.п.). Доставка материала в ближайшие часы после взятия пробы, охлаждение при 4С до посева Микроскопическое исследование С применением дифференциально-диагностических и специальных методов окраски позволяет провести ориентировочную идентификацию этих бактерий по морфологическим признакам и подобрать среду для культивации. Характер роста на жидких средах    Облигатные анаэробы Факультативные анаэробы Аэробы 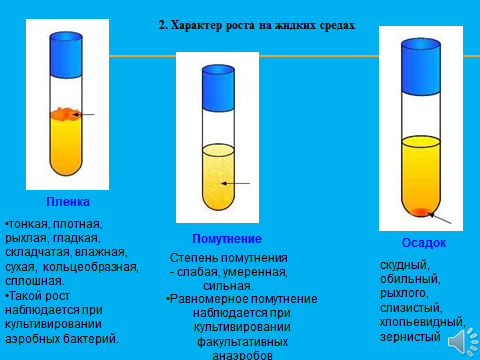 Газообразование в пробирке Нередко рост микробов сопровождается появлением запаха, пигментацией среды, выделением газа. Характерный запах культур некоторых видов бактерий связан с образованием различных эфиров (уксусноэтилового , уксусноамилового и др.), индола, меркаптана, сероводорода, скатола, аммиака, масляной кислоты. При росте на полужидких (0,5-0,7% агара ) питательных средах подвижные микробывызывают выраженное помутнение, неподвижные формы растут только по ходу посева уколом в среду. 3-й этап: Идентификация выделенной чистой культуры – определение таксономического положения, места в классификации, рода и вида микроба В основе идентификации лежит определение биохимической активности на дифференциально-диагностических средах. Идентификация проводится в обязательном порядке по следующим свойствам: морфологическим (микроскопическая характеристика) тинкториальным свойствам (отношение к окраске) культуральным (макроскопическая характеристика колоний, пигментообразование) биохимическим (гликолитическим, протеолитическим, липолитическим) При необходимости дополнительно определяют: патогенные свойства (определение факторов патогенности, например, ферментов агрессии, гемолитической активности) антибиотические свойства (отношение к таксономически значимым антимикробным веществам) фаготип (отношение к типовым бактериофагам – фаготипирование) хемотаксономические свойства (выделение вида таксономически значимым метаболитов, например, жирных кислот) антигенную структуру (серотипирование) профиль ДНК и рибосомальной 16S – РНК (генотипирование, филотипирование) Приёмы идентификации чистой культуры по биохимическим свойствам Протеолитическая активность – на среде содержащей белки. В мясо-пептонный бульон помещают посев бактерий и 2 индикаторные бумаги. При расщеплении белка бактерии выделяют индол или сероводород и индикаторная бумага меняет цвет Гликолитическая активность – определяется с помощью сред Гисса (короткого пёстрого ряда). Посев чистой культуры проводится в пробирке с глюкозой, лактозой, сахарозой, маннозой. После культивирования, если бактерии расщепляют вещество, то среда меняет цвет за счет изменения цвета индикатора. Диско-диффузионный метод определения чувствительности культуры к антибиотикам После идентификации культуры и определения вида возбудителя проводят пробы на чувствительность чистой культуры к антибиотиком, используя диско-диффузионный метод. На чашку с плотной питательной средой производят посев культуры сплошным газоном, далее раскладывают диски, пропитанные антибактериальными препаратами. После культивирования вокруг дисков наблюдаются зоны отсутствия роста бактерий, что говорит о чувствительности культуры к данному препарату. Производят замеры зон задержки роста и делают заключение степени чувствительности культуры: менее 15 мм – низкочувствительные, 15-24 мм – среднечувствительные, более 25 мм- высокочувствительные. Касетный микрометод определения чувствительности культур к антибиотикам – ДЛЯ АНАЭРОБНЫХ БАКТЕРИЙ. Забор гнойного отделяемого из очага инфекции челюстно-лицевой области, культивирование в сахарном бульоне 2 часа, введение стандартных дисков с исследуемыми антибиотиками, инкубирование в течение 2 часов. Результат оценивают по степени мутности содержимого, чем меньше мутность, тем выше чувствительность. Позволяет определить чувствительность без выведения чистой культуры, в смеси разных видов, т.е. с меньшей затратой времени. Культуральные свойства бактерий Это потребность микроорганизмов в питательных веществах и условиях культивирования, а также характер роста на питательных средах. Характер роста бактерий на питательной среде. Для разных видов бактерий он разнообразен. Например, колонии возбудителя сибирской язвы похожи на «гриву льва» образуя шероховатые скопления, колонии возбудителя чумы сравнивают с кружевным платком, актиномицеты с зубом моляром и тд . При описании колоний учитывают следующие признаки: форму колонии - округлая, амебовидная, ризоидная , неправильная и т.д.; Морфологические (микроскопические признаки) Размер (диаметр) колонии- очень мелкие (точечные) (0,1-0,5 мм), мелкие (0,5-3 мм), средних размеров (3-5 мм) и крупные (более 5 мм в диаметре); Поверхность колонии -гладкая, шероховатая, складчатая, морщинистая, с концентрическими кругами или радиально исчерченная; Профиль колонии- плоский, выпуклый, конусовидный, кратерообразный и т.д.; Край колонии- ровный, волнистый, зубчатый, бахромчатый и т.д.; Прозрачность- тусклая, матовая, блестящая, прозрачная, мучнистая; Цвет колонии (пигмент) - бесцветная или пигментированная (белая, желтая, золотистая, красная, черная), особо отмечают выделение пигмента в среду с ее окрашиванием; Структура колонии- однородная, мелко или крупнозернистая, струйчатая; край и структуру колонии определяют с помощью лупы или на малом увеличении микроскопа, поместив чашку Петри с посевом на столик микроскопа крышкой вниз; Консистенция колонии- определяют прикасаясь к поверхности петлей, колония может быть плотной, мягкой, врастающей в агар , слизистой (тянется за петлей), хрупкой (легко ломается при соприкосновении с петлей). Пигменты бактерий !Хорошо определяются при росте на плотных средах! Химическая природа пигментов разнообразна: каратиноиды , антоцианы, меланины. Если пигмент не растворим в воде, окрашивается только культуральный налет, если же он растворим, окрашивается и питательная среда. Считается, что пигменты защищают бактерии от губительного действия солнечных лучей, поэтому в воздухе так много пигментированных бактерий, кроме того, пигменты участвуют в обмене веществ этих микроорганизмов. Цвет колонии (пигмент) - бесцветная или пигментированная (белая, желтая, золотистая, красная, черная), особо отмечают выделение пигмента в среду с ее окрашиванием В полости рта присутствуют пигментообразующие бактерии, являющиеся представителями парадонтопатогенной микрофлоры. На кровяном агаре они обраузют черные колонии за счёт продукции меланина.  В природе существуют, так называемые, фосфоресцирующие бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым светом. Такие бактерии встречаются, главным образом, в речной или морской воде. К светящимся бактериям - фотобактериям - относятся аэробные бактерии (вибрионы, кокки, палочки). Эмбрион тли (его клетки окрашены синим) содержит крупные специализированные клетки — бактериоциты, в которых живут симбиотические бактерии Buchnera (зеленые). Один из бактериоцитов населен риккетсиеллами (красные). Справа — бактериоцит с риккетсиеллами при большем увеличении. Фото из обсуждаемой статьи в Science Бактериологическое исследование АНАЭРОБНЫХ БАКТЕРИЙ Транспорт материала для бактериологического исследования в анаэробных условиях при темп-ре 4 градуса на специальных средах, тормозящих активную жизнедеятельность анаэробных бактерий. (Тиогликолевая среда, среда Стюарта, Эйнса) в ближайшие часы после забора био материала. Культивация проводят в АНАЭРОСТАТЕ, в которой закачена специальная бескислородная газовая смесь (80 % N2, 10 % H2, 10 % CO2) АНААЭРОСТАТ помещают в термостат при тем-ре 37 градусов. Культивирование бактерий в условиях анаэробиоза – система ГазПак Принцип действия основан на активировании газогенерирующих пакетов. Когда пакет вынимается из его упаковки, он активируется, находясь на воздухе. Активированный пакет и образец помещаются в инкубационный контейнер Алгоритм бактериологического исследования с применением анаэробного культивирования (дольше, чем аэробов) Получение изолированных колоний ( 1нед) в условиях анаэробиоза на 5% кровяном агаре с гемином и менадионом 2- получение чистых культур (ЧК); 3- идентификация (ЧК) по морфологическим, культуральным и биохимическим свойствам на ДД средах с импользованием анаэростата Определение чувствительности к антибиотикам (кассетный или диско-диффузионный метод в АНАЭРОБНЫХ условиях) Таким образом, бактерии можно идентифицировать культуральными и молекулярными методами, но некультивируемые бактерии — только молекулярными методами. Идентификация бактерий молекулярными методами чаще основана на анализе нуклеотидных последовательностей их рибосомных 16S-генов. Такой анализ позволяет также выявлять филогенетические связи, что важно для классификации бактерий. КЛАССИФИКАЦИЯ БАКТЕРИЙ ПО ИСТОЧНИКАМ ЭНЕРГИИ И ПИТАНИЯ Автотрофы и ГЕТЕРОТРОФЫ 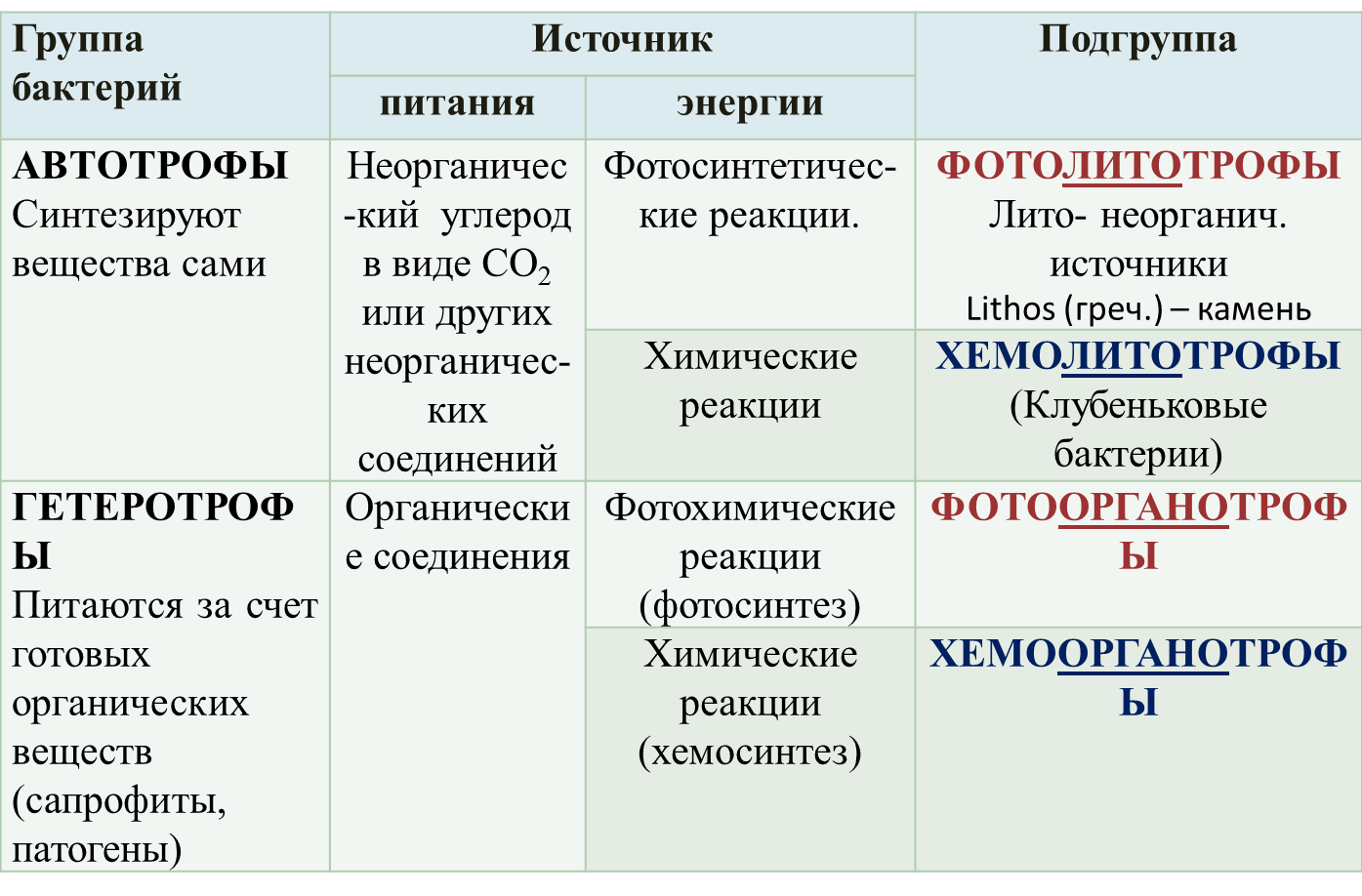 В зависимости от окисляемого субстрата, называемого донором электронов или водорода выделяют ЛИТОТРОФЫ (используют углерод неорганических соединений) и |
