лекция физиол. возб.тканей. Физиология возбудимых тканей
 Скачать 3.36 Mb. Скачать 3.36 Mb.
|
|
Физиология возбудимых тканей План: I. История открытия животного электричества. II. Современные представления о структурно - функциональной организации мембран. III. Механизм возникновения биопотенциалов. IV. Изменение возбудимости при прохождении волны возбуждения. V. Проведение биопотенциалов. I. История открытия животного электричества. Электрические явления в животных организмах известны давно. Еще в 1776 г. они были описаны у электрического ската. Началом же экспериментального изучения электрических явлений в животных тканях следует считать опыты итальянского врача Луиджи Гальвани (1791). В опытах он использовал препараты задних лапок лягушки, соединенных с позвоночником. Cуществует легенда, что Л. Гальвани готовил лягушачьи лапки своей больной жене на обед, и идея пришла ему в голову , когда он их просто сгибал туда-сюда. Подвешивая эти препараты на медном крючке к железным перилам балкона, он обратил внимание, что, когда конечности лягушки раскачивались ветром, их мышцы сокращались при каждом прикосновении к перилам. На основании этого Гальвани пришел к выводу, что подергивания лапок были вызваны "животным электричеством", зарождающимся в спинном мозге лягушки и передаваемым по металлическим проводникам (крючку и перилам балкона) к мышцам конечностей. В 1791г. Гальвани опубликовал свой труд «Трактат о силах электричества при мышечном движении». Однако, против положения Гальвани о "животном электричестве" выступил физик Александр Вольта. В 1792 г. Вольта повторил опыты Гальвани и установил, что описанные Гальвани явления нельзя считать "животным электричеством". В опыте Гальвани источником тока служил не спинной мозг лягушки, а цепь, образованная из разнородных металлов, - меди и железа. Вольта был прав. Первый опыт Гальвани не доказывал наличия "животного электричества", но эти исследования привлекли внимание ученых к изучению электрических явлений в живых образованиях. В ответ на возражение Вольта Гальвани произвел второй опыт, уже без участия металлов. Конец седалищного нерва он набрасывал, стеклянным крючком на мышцу конечности лягушки; при этом также наблюдалось сокращение этой мышцы. Племянник Гальвани Д. Альдини был пылким сторонником своего дяди и считал, что Вольта заблуждается. Он в своих затеях зашел так далеко, что во время наполеоновских войн стал ставить опыты на головах только что гильотированных людей. Как только голова отлетала, Альдини тут же ее подхватывал и прикладывал ток к ушам и губам, и на отрубленной голове появлялись различные гримасы. В 1841 г свои исследования в области физиологии начал знаменитый немецкий физиолог Дюбуа Реймон, который считается «отцом» электрофизиологии. Он ввел в электрофизиологию термины, которыми пользуются до сих пор, например, ток покоя. Д. Реймон предполагал, что мышца и нерв ориентированы так, что их продольные участки заряжены положительно, а поперечные – отрицательно. При всяком раздражении происходит поворот этих молекул на 900 и тем самым происходит распространение тока. Впервые В. .Ю. Чаговец в 1896 году высказал гипотезу об ионном механизме электрических потенциалов в живых клетках и сделал попытку объяснить их с позиции теории электролитической диссоциации С. Аррениуса. В 1902 году Ю. Бернштейном была разработана мембранно–ионная теория, согласно которой потенциал покоя нервных и мышечных волокон определяется избирательной проницаемостью мембраны для ионов калия и их диффузией по концентрационному градиенту. В 1949 – 1952 гг. мембранно-ионную теорию модифицировали и экспериментально обосновали А. Ходжкин, А. Хаксли и др. Исследователям удалось найти замечательный объект - гигантский аксон кальмара, диаметром 1 мм, иннервирующий мышцы мантии. В такой аксон можно было легко вводить микроэлектрод, заменять внутреннее содержимое волокна искусственными растворами. На основании проведенных опытов была сформулирована современная мембранная теория, основные положения которой следующие: 1. Мембрана клетки любого возбудимого образования в покое поляризована. При этом ее внутренняя поверхность заряжена отрицательно, а наружная - положительно; 2. Наличие электрических потенциалов в животных клетках обусловлено неравенством концентраций ионов Na+, K+, CI-, Ca++ внутри и вне клетки, а также их различной проницаемостью через мембрану. 3. В состоянии покоя внутри нервных и мышечных клеток концентрация K+ в 30-40 раз выше, чем в наружном растворе. Концентрация Na+ вне клетки в 10 –12 раз больше, чем внутри. Вне клетки больше также и ионов CI-. 4. В покое мембрана нервных клеток наиболее проницаема для ионов K+, менее для CI- и очень мало проницаема для ионов Na+ (в 100 раз меньше, чем для K+). 5. Для многих анионов органических кислот, присутствующих в цитоплазме, мембрана в покое не проницаема. 6. Благодаря преимущественной проницаемости мембраны для ионов К+ в состоянии покоя, происходит их перемещение по концентрационному градиенту из клетки наружу. 7. В силу возникающего мембранного потенциала ионы K+ по электрическому градиенту частично возвращаются обратно в клетку. Когда число выходящих из клетки ионов K+ становится равным числу входящих в клетку, то на мембране устанавливается так называемый равновесный калиевый потенциал, обозначаемый Ек * II. Современные представления о структурно - функциональной организации мембран. Клеточная (или плазматическая) мембрана представляет собой тонкую, гибкую и эластичную структуру толщиной всего 7,5-10 нм. Она состоит в основном из белков и липидов. Примерное соотношение ее компонентов таково: белки - 55%, фосфолипиды - 25%, холестерол - 13%, другие липиды - 4%, углеводы -3%. Структурную основу клеточной мембраны (матрикс) составляет бимолекулярныйслойфосфолипидов. Фосфолипиды являются барьером для заряженных частиц и молекул водорастворимых веществ. Молекулы фосфолипидов мембранысостоят из двух частей, одна из которых несет заряд и гидрофильна, а другая, напротив, не заряжена и гидрофобна. Молекулы липидов в клеточной мембране ориентированы так, что их гидрофильные головки расположены снаружи, а гидрофобные хвостики – друг к другу. В толще клеточной мембраны молекулы фосфолипидов взаимодействуют незаряженными гидрофобными участками (они «спрятаны» от внутриклеточной и внеклеточной воды). В липидном слое клеточных мембран содержится много холестерина. Обмен липидов, в отличие от белков, происходит медленнее. Однако возбуждение, например, нейронов мозга приводит к уменьшению содержания в них липидов. В частности, после длительной умственной работы, при утомлении количество фосфолипидов в нейронах уменьшается (может быть, с этим связана хорошая память у лиц напряженного умственного труда). Состав мембранных липидов определяется средой обитания и характером питания. Так, увеличение растительных жиров в пищевом рационе поддерживает жидкое состояние липидов клеточных мембран и улучшает их функции. Избыток холестерина в мембранах увеличивает их микровязкость, ухудшает транспортные функции клеточной мембраны. Однако недостаток жирных кислот и холестерина в пище нарушает липидный состав и функции клеточных мембран. В липидном бислое располагаются мембранные белки, большинство которых являются гликопротеинами. Различают три типа мембранных белков: 1) интегральные, которые пронизывают мембрану насквозь; 2) полуинтегральные и 3) периферические, которые выступают только над одной ее поверхностью, не достигая другой. Многие интегральные белки формируют каналы (или поры), через которые во внутри- и внеклеточную жидкость могут диффундировать вода и водорастворимые вещества, особенно ионы. Благодаря избирательности действия каналов одни вещества диффундируют лучше других. Другие интегральные белки функционируют как белки-переносчики, осуществляя транспорт веществ, для которых липидный бислой непроницаем. Иногда белки-переносчики действуют в направлении, противоположном диффузии, такой транспорт называют активным. Некоторые интегральные белки являются ферментами. Интегральные белки мембраны могут служить также рецепторами для водорастворимых веществ, включая пептидные гормоны, поскольку мембрана для них непроницаема. Взаимодействие белка-рецептора с определенным лигандом приводит к конформационным изменениям молекулы белка, что, в свою очередь, стимулирует ферментативную активность внутриклеточного сегмента белковой молекулы или передачу сигнала от рецептора внутрь клетки с помощью вторичного посредника. Таким образом, интегральные белки, встроенные в клеточную мембрану, вовлекают ее в процесс передачи информации о внешней среде внутрь клетки. Молекулы периферических мембранных белков часто бывают связаны с интегральными белками. Большинство периферических белков являются ферментами или играют роль диспетчера транспорта веществ через мембранные поры Углеводы мембран. Клеточный гликокаликс. Углеводы мембран представлены главным образом в соединении с белками (гликопротеины) или жирами (гликолипиды). Большая часть интегральных белков на самом деле являются гликопротеинами, а примерно 1/10 часть всех липидных молекул мембраны - гликолипидами. Углеводные части мембранных структур почти всегда направлены наружу и выступают над поверхностью клетки. Обширную группу углеводных соединений составляют протеогликаны, состоящие из белка с отходящими от него боковыми углеводными цепями. Эти соединения обычно слабо связываются с мембраной и находятся на ее наружной поверхности. Таким образом, вся наружная поверхность клетки окружена углеводной оболочкой, которую называют гликокаликсом. Углеводная оболочка клетки выполняет ряд важных функций: (1) большинство клеток способны отталкивать другие отрицательно заряженные частицы благодаря тому, что многие углеводные молекулы имеют отрицательный заряд; (2) гликокаликс соседних клеток скрепляет их друг с другом; (3) многие углеводные цепочки выполняют роль рецепторных молекул для связывания гормонов, включая инсулин. 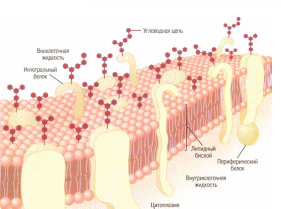 Рис. 2. Строение клеточной мембраны Клеточные мембраны обладают избирательной проницаемостью: одни вещества они пропускают, другие - нет. В частности, мембрана легкопроницаема для жирорастворимых веществ, проникающих через липидный слой; большинство мембран пропускает воду. Анионы органических кислот не проходят через мембрану. Но имеются каналы, избирательно пропускающие ионы Na+, К+, Са2+, С1-. Степень проницаемости клеточной мембраны для разных ионов различна, что является главным фактором, обеспечивающим высокий электрический потенциал клеток возбудимой ткани. Существует два основных вида транспорта ионов и молекул через мембрану: активный и пассивный. Пассивный транспорт – это движение частиц через мембрану в направлении концентрационного градиента (т.е. от большей концентрации к меньшей), а для заряженных частиц (ионов) – еще и электрического градиента (туда, где больше противоположных зарядов). Такой транспорт не требует затрат энергии. Таким образом, имеются две движущие силы для диффузии ионов через мембрану - концентрационный градиент и электрический градиент. Из этих двух сил складывается суммарная движущая сила для переноса того или иного иона через мембрану. Структурами, обеспечивающими пассивный транспорт являются трансмембранные белковые комплексы – ионные каналы. Эти комплексы образуют стенки поры, сквозь которую путем простой диффузии и проходят ионы. Ионные каналы бывают нескольких типов: - безворотные каналы – представляют собой просто поры в мембране, стенки которых образованы трансмембранными белками. К ним относятся, например, каналы утечки, постоянно открытые для тех или иных ионов. - каналы с воротами – обладают особыми белковыми участками, способными перекрывать канал – воротами. Все эти каналы обладают избирательной проницаемостью, т.е. пропускают преимущественно какой-либо один ион – калий, натрий, кальций, хлор и т.д. Активный транспорт идет против концентрационного и электрического градиента, и поэтому требует затрат энергии. Этот транспорт во многих случаях обеспечивается специальными трансмембранными белковыми комплексами – ионными насосами, перекачивающими ионы против концентрационного и электрического градиента. На это расходуется энергия АТФ, поэтому все ионные насосы одновременно являются ферментами –АТФ-азами.  Рис. 3. Транспорт веществ через плазматическую мембрану  Рис. 4. Строение ионных каналов. III. Механизм возникновения биопотенциалов. В покое возбудимые клетки заряжены внутри отрицательно, а снаружи – положительно. Мембранный потенциал при этом колблется в пределах от -30 до -100 мВ (милливольт). Мембранный потенциал – это разность потенциалов по обе стороны мембраны. Потенциалом покоя (ПП) называют мембранный потенциал возбудимой клетки в невозбужденном состоянии. Он представляет собой разность электрических зарядов между внутренней и наружной сторонами мембраны в покое. Разные возбудимые ткани имеют неодинаковый ПП: ПП нервной ткани -70мВ ПП мышечной ткани -90мВ ПП железистой ткани -30 мВ Таким образом, в покое имеется разделение зарядов по обе стороны мембраны, поэтому говорят, что клетка поляризована. Отсюда следует три важных термина: Снижение мембранного потенциала по абсолютной величине (то есть его сдвиг в положительную сторону, например, от -90 до -60 мВ) называется деполяризацией. Восстановление мембранного потенциала после деполяризации (например, от -60 до -90 мВ) называется реполяризацией. Увеличение мембранного потенциала по абсолютной величине, то есть сдвиг в отрицательную сторону по сравнению с потенциалом покоя (например, от -90 до -100 мВ) называется гиперполяризацией. В типичной нервной клетке биопотенциалы создаются в результате диффузии двух катионов: Na+ и K+. Знак и величина ПП объясняется двумя факторами: Распределением катионов по обе стороны мембраны: во внутри клетки преобладает K+ , снаружи - Na+. Такое неравномерное распределение ионов обусловлено работой Na+, К+ - АТФ-азы, или Na+/ К+- насоса – механизма активного транспорта, удаляющего из клетки Na+ и закачивающего в клетку К+. Избирательной проницаемостью мембраны: в покое мембрана высоко проницаема для К+ и мало проницаема для Na+ (это обусловлено тем, что в мембране имеется большое количество постоянно открытых калиевых каналов утечки). Таким образом, ионы К+ выходят из клетки по концентрационному градиенту, вынося с собой положительные заряды и заряжает наружную поверхность мембраны положительно. Внутри остается избыток анионов, которые создают отрицательный заряд на внутренней поверхности мембраны.  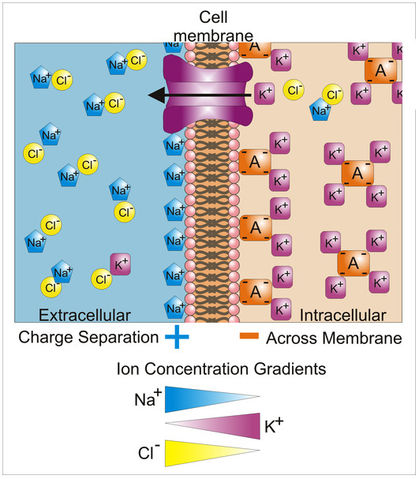 Рис. 5. Распределение ионов по обе стороны мембраны Потенциал действия (ПД) представляет собой кратковременное изменение мембранного потенциала от уровня покоя примерно до +30 мВ. Длительность его 1-2 мс. Если в формировании ПП участвуют постоянно открытые калиевые каналы утечки, то в формировании ПД - два вида потенциалчувствительных каналов: быстрые натриевые и потенциалчувствительные калиевые каналы. Быстрые натриевые каналы (рис. 6) обладают двумя воротами: наружными (активационными) и внутренними (инактивационными). Эти каналы обладают двумя свойствами: Потенциалзависимостью: активационные каналы при ПП закрыты, инактивационные – открыты, в ответ на деполяризацию активационные ворота открываются, инактивационные – закрываются; Времязависимостью: активационные ворота в ответ на деполяризацию открываются очень быстро (десятые доли миллисекунды), инактивационные закрываются также достаточно быстро, но все же медленнее.  Рис.6. Канал для ионов натрия (1) образован макромолекулами белка (2). В канале имеются активационные (А) и инактивационные ворота (И). Состояние а – активационные ворота закрыты, б - активационные ворота открыты, канал может пропускать ионы, в – закрыты инактивационные ворота – канал инактивирован. На рис. 6 изображена реакция этих каналов на деполяризацию: В состоянии покоя быстрые натриевые каналы закрыты (так как закрыты активационные ворота); В ответ на деполяризацию быстрые натриевые каналы сначала быстро открываются (инактивационные ворота еще не закрылись, активационные уже открылись); Затем с некоторой задержкой (очень небольшой) эти каналы закрываются (так как в ответ на деполяризацию закрываются инактивационные ворота); По окончании деполяризации активационные ворота вновь закрываются, инактивационные открываются – канал переходит в исходное состояние. Из этого следует три очень важных момента: Быстрые натриевые каналы могут находиться в одном из трех состояний: покоя, активации и инактивации. При этом только в состоянии активации они открыты, так как для того, чтобы канал пропускал ионы, должны быть открыты все ворота. В состоянии и покоя, и инактивации канал закрыт, однако есть существенная разница: в состоянии покоя канал может открыться в ответ на деполяризацию, а в состоянии инактивации – нет. Это имеет принципиальное значение, так как любой раздражитель может вызвать ПДтолько путем деполяризации, а значит, в состоянии инактивации ПД возникнуть не может. Для того, чтобы канал снов стал способен реагировать на раздражитель, клетка должна реполяризоваться, так как только после реполяризации быстрые натриевые каналы возвращаются в состояние покоя. Потенциалчувствительные калиевые каналы обладают только наружними (активационными) воротами. Потенциал действия возникает при действии пороговой силы раздражения (порог раздражения – минимальная сила раздражителя, способная вызвать ответную реакцию). Слабое (подпороговое) раздражение может вызвать локальный потенциал. Он подчиняется закону силы: с увеличением силы стимула величина его также возрастает. Потенциал действия возникает в тот момент, когда деполяризация мембраны достигает критической (пороговой) величины (Екр.). Критический уровень деполяризации Екр (КУД) – это минимальная деполяризация клеточной мембраны, при которой возникает ПД. КУД определяется лишь свойствами мембраны и не зависит от характера раздражителя. Скорость же, с которой происходит деполяризация мембраны, зависит от силы раздражающего тока. Чем меньше сила, тем медленнее развивается деполяризация. Если исходный потенциал мембраны перед нанесением раздражающего стимула обозначить Ео, а критическую величину мембранного потенциала Ек, то можно записать, что Ек = Ео + V, где V- пороговый потенциал, т.е. величина на которую необходимо повысить внутренний потенциал мембраны для возникновения импульса (рис.7). 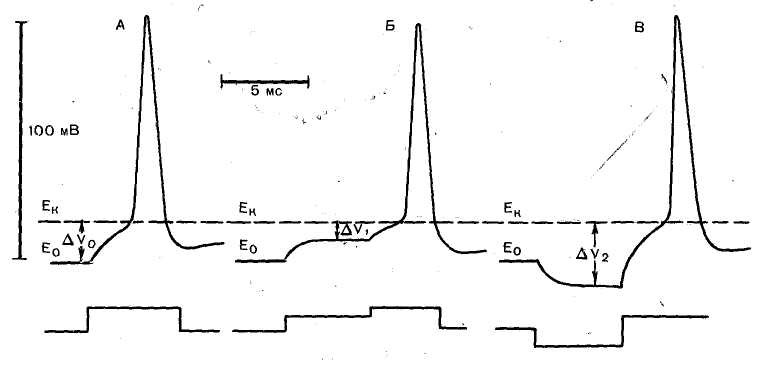 Рис. 7. Соотношения между исходным уровнем потенциала покоя (Ео), критическим уровнем деполяризации (Ек) и пороговым потенциалом (∆V). ПД протекает в несколько стадий: 1. фаза деполяризации – процесс исчезновения заряда клетки до нуля. В эту фазу открываются натриевые каналы и мембрана становится проницаемой для ионов Na+, которые устремляются внутрь мембраны. 2. фаза инверсии (от лат. inversio – переворачивание) – изменение заряда клетки на противоположный, т. е. весь период ПД, когда внутри клетки заряд положительный, а снаружи отрицательный; 3. фаза реполяризации - восстановление заряда клетки до исходной величины (возврат к потенциалу покоя). В эту фазу ионы калия по градиенту концентрации выходят из мембраны, вынося положительный заряд. Кроме того, начинает работать натрий-калиевый насос, который выкачивает ионы натрия из клетки. 4. следовые потенциалы: отрицательный следовой потенциал (следовая деполяризация) и положительный следовой потенциал (следовая гиперполяризация). 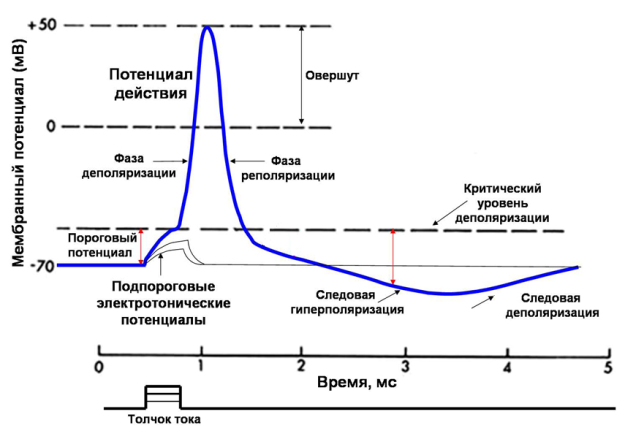 Рис. 8. Фазы потенциала действия З  начение натриевых и калиевых каналов для генерирования нервного импульса подчеркивается тем фактом, что яды пауков, актиний, лягушек, змей, скорпионов и множества других экзотических существ воздействуют именно на эти каналы и, таким образом, нарушают функционирование нервов и мышц. Многие яды очень специфичны и нацелены на какой-нибудь один вид ионных каналов. начение натриевых и калиевых каналов для генерирования нервного импульса подчеркивается тем фактом, что яды пауков, актиний, лягушек, змей, скорпионов и множества других экзотических существ воздействуют именно на эти каналы и, таким образом, нарушают функционирование нервов и мышц. Многие яды очень специфичны и нацелены на какой-нибудь один вид ионных каналов. Тетродотоксин, содержащийся в печени и других органах иглобрюха, является сильнодействующим блокатором натриевых каналов в нервной ткани и скелетных мышцах. На сердце яд не влияет, поскольку в его клетках натриевые каналы другого типа. Токсин также не может преодолеть гематоэнцефалический барьер, поэтому, как это не ужасно, обездвиженная и умирающая жертва остается в сознании. Противоядия не существует, и смерть обычно наступает в интервале от двух часов до суток. Тетродотоксин содержат многие живые существа: от рифовых рыб, крабов и морских звезд до плоских червей, саламандр, лягушек и жаб. Для большинства из них яд служит биологической защитой. По какой причине так много разных животных содержат тетродотоксин, никто не знал до тех ор,пока не обнаружилось, что на самом деле этот яд вырабатывают бактерии (Psuedoalteromonastetradonia), которыми животные питаются или которые живут у них в кишечном тракте. Иглобрюхи, выращенные в среде без этих бактерий не содержат тетродотоксина.  Блокатором натриевых каналов является также яд, выделяемый водорослями динофлагелятами, сакситоксин. Мидии и другие двустворчатые моллюски могут питаться этими водорослями и накапливать в себе этот токсин. Динофлагеляты сильнее всего размножаются весной и летом. Видимо с этим связана старая мудрость: «Не ешь моллюсков, когда в названии месяца нет буквы «Р». Возникает вопрос: почему сакситоксин не действует на моллюсок и почему иглобрюх павает как ни в чем не бывало, несмотря на высокий уровень тетродотоксина? Дело в том, что сродство их собственных натриевых каналов к токсину сильно уменьшено в результате замены в процессе эволюции одной или нескольких аминокислот в месте присоединения токсина. Аналогичная мутация наблюдается и в натриевых каналах клеток сердца. 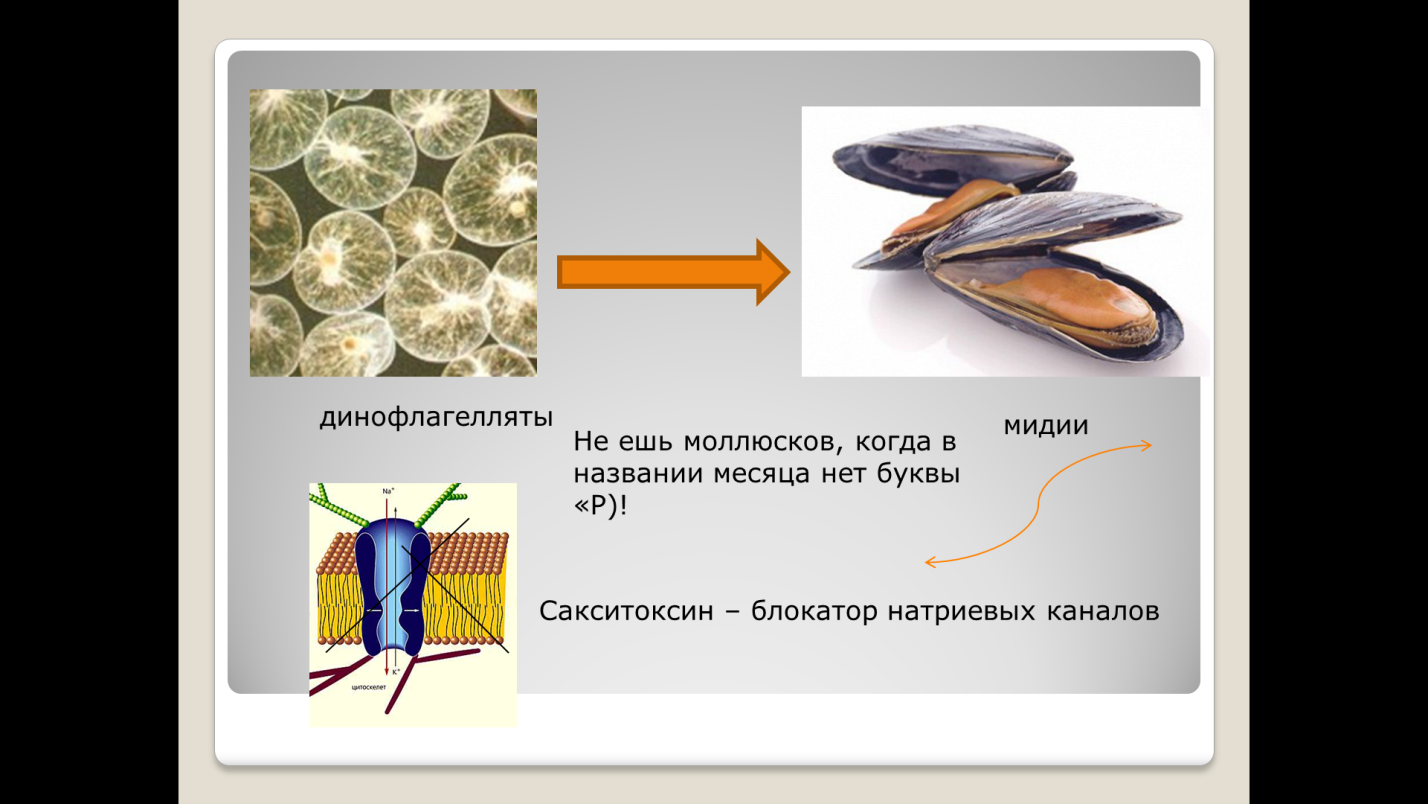 Существуют яды, которые держат натриевые каналы в открытом состоянии, что приводит к чрезмерному возбуждению нервных и мышечных волокон. Одним из самых сильнодействующих ядов является аконит. Аконит называют королем ядов. Он содержится в борце. В соответствии с греческой мифологией оно вырастает там, куда упала слюна из пасти Цербера, трехглавого пса, который охраняет врата ада. Другим сильнодействующим активатором натриевых каналов является батрахотоксин, который выделяют из желез на спине ярко окрашенных желтых и черных лягушек древолазов из Южной и Центральной Америки. Батрахотоксин вырбатывают не сами лягушки, а жуки, которыми они питаются. Не менее опасен андромедотоксин, который также активирует натриевые каналы. Его выделяют некоторые виды рододендрона, и он накапливается в меде из нектара, собранного пчелами на его цветках (бешеный мед).  IV. Изменение возбудимости при прохождении волны возбуждения Если использовать тестирующие электроды в различные фазы ПД, то можно убедиться в изменении возбудимости клетки сопровождающих волну возбуждения (рис.8). Изменение возбуждения имеет следующую последовательность: Абсолютная рефрактерность (полное отсутствие возбудимости). Она соответствует фазам деполяризации, овершута и начальной фазе реполяризации ПД. В эти фазы, как писалось ранее большинство натриевых каналов открыто, поэтому ткань не может реагировать на действие последующего раздражителя. Относительная рефрактерность. В этот период часть натриевых каналов успевает закрыться, поэтому при увеличении силы действующего раздражителя можно добиться некоторой ответной реакции. Она соответствует фазе реполяризации ПД. Супервозбудимость (экзальтация) – фаза повышенной возбудимости. В этот период ткань наиболее возбудима. Продолжительность ее в быстрых двигательных волокнах составляет приблизительно 30 мсек. Эта фаза совпадает с периодом отрицательного следового потенциала. При операциях на сердце кардиохирурги стараются избегать этой фазы, поскольку совпадение манипуляций с этой фазой может привести к повышенной возбудимости сердечной мышцы и остановке сердца. Субнормальная (околонормальная) возбудимость наблюдается в период положительного следового потенциала (гиперполяризации). 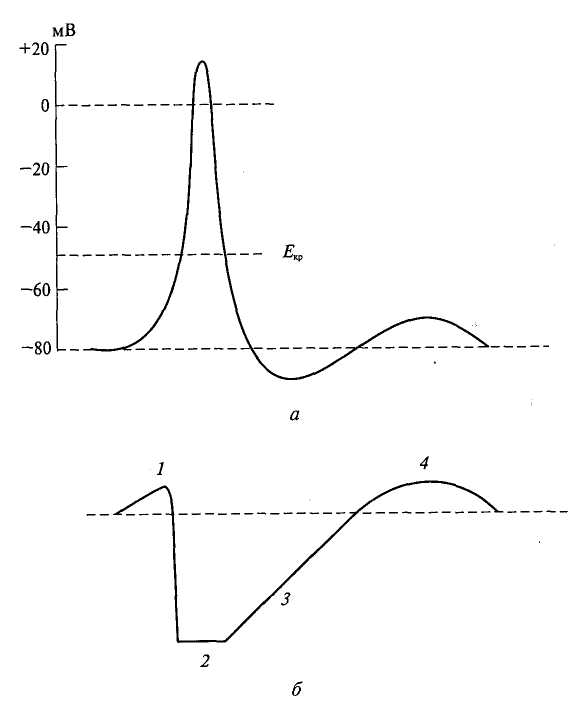 Рис. 9. Изменение возбудимости при прохождении волны возбуждения. А – потенциал действия: 1 – деполяризация, 2 – перезарядка (овершут, инверсия), 3 – реполяризация; 4 – отрицательный следовой потенциал (следовая деполяризация), 5 – положительный следовой потенциал (гиперполяризация) Б – Изменение возбудимости: 1 – абсолютная рефрактерность, 2 – относительная рефрактерность, 3 – супернормальная возбудимость (экзальтация), 4 – субнормальная возбудимость. V. Проведение биопотенциалов. Механизм распространение возбуждения по нервным и мышечным волокнам осуществляется при помощи местных токов, возникающих между возбужденными и невозбужденными участками мембраны. Теория проведения возбуждения при помощи местных токов была сформулирована Германом в 1899 году и получила в настоящее время экспериментальное подтверждение. Главная разница в проведении местных потенциалов и ПД заключается в том, что местные потенциалы распространяются с затуханием, а ПД – без затухания. Это означает, что амплитуда местных потенциалов по мере удаления от точки их возникновения постепенно снижается, а амплитуда ПД – нет. Физиологический смысл этого в том, что местные потенциалы предназначены для местной обработки информации, поэтому им нет необходимости распространяться дальше. Назначение же ПД заключается в передаче информации. Существует 2 типа нервных волокон: Мякотные (миелинизированные) Безмякотные (немиелинизированные) К миелинизированным волокнам относятся чувствительные и двигательные волокна, а также часть волокон вегетативной нервной системы. На рис. 10 показано строение миелинизированного нервного волокна. Миелиновая оболочка создается Шваннновской клеткой, многократно обертывающей осевой цилиндр волокна, поверхность которого образована плазматической мембраной. Свободные от миелиновой оболочки участки мембраны шириной, примерно, 1мкм называют перехватами Ранвье. В нервных волокнах, диаметром 10-20 мкм, длина межперехватных участков составляет 1-2 мм. Миелиновая оболочка участвует в регуляции обмена веществ и росте осевого цилиндра, выполняет функцию электрического изолятора, благодаря высокому сопротивлению и обеспечивает более экономное и быстрое проведение возбуждения. 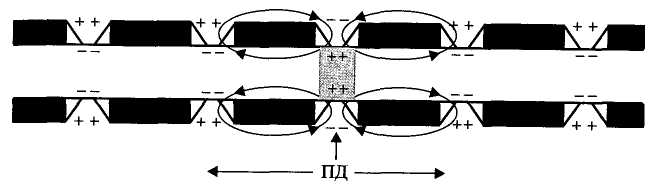 Рис. 10. Сальтаторное распространение ПД в миелиновых нервных волокнах. Участки между перехватами, покрытые миелином являются практически невозбудимыми. Перепрыгивание нервного импульса с одного перехвата на другой называют сальтаторным проведением возбуждения. Оно связано с высокой плотностью натриевых каналов в перехватах (до 1000 на 1 мкм мембраны). Сальтаторное проведение возбуждения от одного перехвата до другого оказывается возможным только потому, что амплитуда ПД в каждом перехвате в 5-6 раз превышает пороговую величину, необходимую для возбуждения соседнего перехвата Ранвье. Предположение о скачкообразном распространении возбуждения в нервных волокнах впервые было высказано Вериго в 1899 году. Распространение ПД по мембране можно сравнить с распространением пламени по фитилю, набитому порохом: достаточно нагреть фитиль до температуры воспламенения в одном участке и тогда этот участок нагреет соседний, тот вспыхнет, нагреет следующий участок и так далее. В мышечных и безмякотных волокнах возбуждение осуществляется непрерывно от точки к точке. Такое распространение возбуждения происходит с затуханием. Безмякотные волокна у позвоночных животных принадлежат в основном симпатической нервной системе. Они не имеют миелиновой оболочки, однако изолированы друг от друга Шванновскими клетками. Нервы обычно состоят из миелинизированных и немиелинизированных волокон в различном соотношении. В нервах иннервирующих скелетные мышцы преобладают миелинизированные волокна, а в нервах вегетативной нервной системы, например, в блуждающем нерве количество безмякотных волокон достигает 80-95%. Ф  ункция миелиновой оболочки не вполне ясна. Самое простое предположение относительно ее функции состоит в том, что она служит своеобразным изолятором нервного волокна, уменьшая утечку тока в окружающую среду. Такие утечки возрастают по мере того, как волокно становится тоньше, и присутствие изолятора позволяет волокну оставаться тонким без увеличения потери потенциала. Доказательства в пользу такого факта основаны на том, что миелин преимущественно состоит из липидных (жироподобных) материалов, которые действительно являются превосходными электрическими изоляторами. (Именно этот материал придает нерву белый цвет) ункция миелиновой оболочки не вполне ясна. Самое простое предположение относительно ее функции состоит в том, что она служит своеобразным изолятором нервного волокна, уменьшая утечку тока в окружающую среду. Такие утечки возрастают по мере того, как волокно становится тоньше, и присутствие изолятора позволяет волокну оставаться тонким без увеличения потери потенциала. Доказательства в пользу такого факта основаны на том, что миелин преимущественно состоит из липидных (жироподобных) материалов, которые действительно являются превосходными электрическими изоляторами. (Именно этот материал придает нерву белый цвет)Клетки миелиновой оболочки поддерживают целостность аксона, поскольку он вытянут на такое большое расстояние от тела нервной клетки, что, вполне вероятно, может утратить нормальную связь с ядром своей нервной клетки. Известно, что ядро жизненно необходимо для поддержания нормальной жизнедеятельности любой клетки и всех ее частей. Возможно, ядра шванновских клеток берут на себя функцию «нянек», которые питают аксон на тех участках, которые они окутывают. Аксоны нервов, даже лишенных миелина, покрыты топким слоем шванновских клеток, в которых, естественно, есть ядра. Наконец, миелиновая оболочка ускоряет проведение импульса по нервному волокну. Волокно, покрытое миелиновой оболочкой, проводит импульс намного быстрее, чем волокно такого же диаметра, но лишенное миелиновой оболочки. Вот почему позвоночные выиграли эволюционную схватку с беспозвоночными. Они сохранили тонкие нервные волокна, но значительно увеличили скорость проведения импульсов по ним. Миелинизированные нервные волокна млекопитающих проводят нервный импульс со скоростью около 100 м/с. Самое большое расстрояние, которое приходится преодолевать импульсам в нервах млекопитающих, - это 25 метров, которые отделяют голову синего кита от его хвоста. Нервный импульс проходит этот неблизкий путь за 0,3 с. Расстояние от головы до большого пальца ноги у человека импульс по миелинизированному волокну проходит за одну пятидесятую долю секунды. При рождении ребенка процесс мнелинизации нервов в его организме еще не завершен, и различные функции не развиваются должным образом до тех пор, пока нужные нервы не будут миелинизированы. Так, ребенок сначала ничего не видит. Функция зрения устанавливается только после миелинизации зрительного нерва. Точно так же нервы, идущие к мышцам рук и ног, остаются не миелинизированными в течение первого года жизни, поэтому координация движений, необходимая для самостоятельного передвижения, устанавливается только к этому времени. Иногда взрослые люди страдают так называемой «демилиенизирующей болезнью», при которой происходит дегенерация участков миелина с последующей утратой функции соответствующего нервного волокна. Лучше всего изучено одно из таких заболевании, известное как рассеянный склероз. Такое название дано этой болезни потому, что при ней в различных участках нервной системы появляются очаги дегенерации миелина с замещением его более плотной рубцовой тканью. Такая демиелинизация может развиться в результате действия на миелин какого-то белка, присутствующего в крови больного. Представляется, что этот белок является антителом, представителем класса веществ, которые в норме обычно взаимодействуют только с чужеродными белками, но часто становятся причиной симптомов состояния, которое мы знаем как аллергию. По сути дела, у больного рассеянным склерозом развивается аллергия к самому себе, и эта болезнь, быть может, является примером аутоаллергического заболевания. Поскольку чаще всего поражаются чувствительные нервы, то самыми распространенными симптомами рассеянного склероза являются двоение в глазах, утрата тактильной чувствительности и другие расстройства чувствительности. Рассеянный склероз чаще всего поражает людей в возрасте от 20 до 40 лет. Болезнь может прогрессировать, то есть могут поражаться все новые и новые нервные волокна, и в конце концов наступает смерть. Однако прогрессирование заболевания может быть медленным, и многие больные живут больше десяти лет с момента установления диагноза. Ярким примером критической важности миелина является также синдром Гийена-Барре. Это редко аутоиммунное заболевание обычно начинается с покалывания и слабости в ступнях, за которыми быстро следует паралич нижних конечностей, затем кистей рук и предплечий и под конец мышц грудной клетки, так что больной теряет способность дышать, и его приходится подключить к аппарату искусственного дыхания. В конечном итоге поражаются почти все нервы, включая лицевые. Человек при этом перестает говорить и может реагировать на вопросы только движением глаз. В самом тяжелом случае переход от нормального функционирования нервной системы почти к полному параличу может произойти за один день. Головной и спинной мозг не страдают от этого, поскольку антитела не могут преодолеть окружающий их гематоэнцефалический барьер и добраться до миелинизированных волокон. К-счастью, этот паралич обычно не является необратимым, и как только антитела удаляются из системы, миелин восстанавливается. Вместе с тем процесс восстановления идет медленно, примерно по 1 см в день, и высокому человеку может понадобиться более года, чтобы к некоторым мышцам вернулась работоспособность. Во многих случаях функции полностью так и не восстанавливаются. |
