Фонд оценочных средств по дисциплине
 Скачать 151.27 Kb. Скачать 151.27 Kb.
|
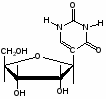 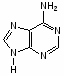 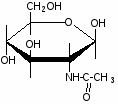 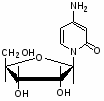 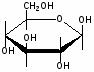 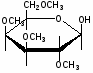 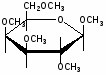 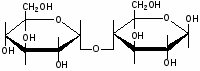 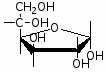 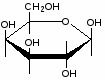 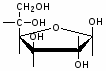 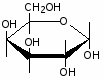 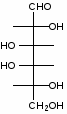 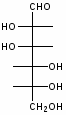 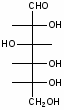 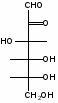 Федеральное государственное бюджетное образовательное учреждение Федеральное государственное бюджетное образовательное учреждениевысшего образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО НГМУ Минздрава России) Кафедра медицинской химии (наименование кафедры) ФОНД ОЦЕНОЧНЫХ СРЕДСТВ ПО ДИСЦИПЛИНЕ ХИМИЯ Б1.Б6 (наименование дисциплины) _31.05.03 Стоматология (код и наименование направления подготовки) 31.05.03 Стоматология (наименование профиля подготовки) Врач-стоматолог (квалификация (степень) выпускника) УТВЕРЖДЕН на заседании кафедры «_3_»__мая__2017 г. протокол __№13_ Заведующий кафедрой Д.В. Суменкова_____________________И.О. Фамилия (подпись) Авторы/составители ФОС по дисциплине:
Фонды оценочных средств рассмотрены и одобрены на заседании цикловой методической комиссии Медико-профилактическое дело, Медицинская биохимия, Медицинская биофизика Протокол № 6 от «_28_» _июня__2017 г. Паспорт фонда оценочных средств по дисциплине ____ХИМИЯ Б1.Б6 (наименование дисциплины)
Перечень оценочных средств
* Все оценочные средства должны иметь разработанные преподавателем и утвержденные на заседании кафедры критерии оценки -Итоговый тест: 0-69% правильных ответов – неудовлетворительно, 70% - 79% правильных ответов - удовлетворительно, 80% - 89% - хорошо, 90% -100% - отлично. -Текущие э/к: 0-69% правильных ответов – неудовлетворительно, 70% - 79% правильных ответов - удовлетворительно, 80% - 89% - хорошо, 90% -100% - отлично. -Доклад: «зачтено» - отражена тема доклада, представленная в виде презентации или устного доклада с распечатками реакций, структурных формул и/или таблиц; «не зачтено» - тема доклада не раскрыта, не иллюстрирована в презентации или распечатках. Комплект тестовых заданий По дисциплине ХИМИЯ Б1.Б6 Итоговый тест V1 Общая химия V2 Биоорганическая химия V3 Химическая термодинамика 1. Расположите агрегатные состояния воды в порядке убывания энтропии А) пар Б) горячая вода В) холодная вода Г) лед 2. Свободная энергия Гиббса ΔG равна: А) ΔH – TΔS Б) ΔH + TΔS В) ΔH + SΔT Г) ΔH – SΔT 3. Изменение внутренней энергии (ΔU) равно нулю: А) только для изолированной системы Б) для закрытых и изолированных термодинамических систем В) для открытых и изолированных систем Г) только для закрытой системы Д) для всех видов систем 4. К функциям состояния не относится: А) объем Б) энтальпия В) энтропия Г) внутренняя энергия Д) свободная энергия Гиббса 5. Энтропия уменьшается в процессе: А) синтеза белка Б) гидролиза крахмала В) окисления жирных кислот до СО2 и Н2О Г) горения целлюлозы 6. Самопроизвольно происходят реакции, для которых изменение свободной энергии Гиббса: А) ΔG < 0 Б) ΔG = 0 В) ΔG › 0 Г) самопроизвольность не зависит от изменения ΔG 7. При образовании химической связи энергия: А) выделяется Б) поглощается В) не изменяется Г) может и выделяться, и поглощаться 8. Тепловой эффект обратной реакции: А) равен тепловому эффекту прямой реакции, взятому с обратным знаком Б) равен тепловому эффекту прямой реакции В) больше теплового эффекта прямой реакции Г) меньше теплового эффекта прямой реакции 9. Человеческий организм: А) открытая термодинамическая система Б) закрытая термодинамическая система В) изолированная термодинамическая система Г) может быть в разных условиях и открытой, и закрытой системой 10. Наиболее калорийными являются: А) жиры Б) белки В) углеводы Г) клетчатка V3 Химическая кинетика 1. Температурный коэффициент реакции равен 3. При охлаждении системы на 20 градусов скорость химической реакции: А) уменьшится в 9 раз Б) уменьшится в 3 раза В) увеличится в 9 раз Г) уменьшится в 6 раз 2. Первый порядок имеет реакция: А) С2Н6 → С2Н4 + Н2 Б) С2Н4 + Н2→ С2Н6. В) С2Н2 + 2Н2→ С2Н6 Г) 3С2Н2 → С6Н6 3. Установите соответствие между уравнением реакции и выражением для скорости: 1) А(г)+2В(г)= 3С(г) 2) А(г)+2В(тв)= 3С(г) 3) 3А(г)+2В(г)= С(г) А) v = k [A]*[B]2 Б) v = k [A] В) v = k [A]3*[B]2 Г) v = k [A]3*[B]2 /[C] 4. Количественное влияние температуры на скорость химической реакции выражается: А) уравнением Аррениуса Б) принципом Ле Шателье В) законом Гесса Г) законом действующих масс 5. При уменьшении объема системы Н2(г) + J2(г) = 2HJ(г) в 4 раза скорость реакции А) увеличится в 16 раз Б) уменьшится в 16раз В) уменьшится в 8 раз Г) увеличится в 4 раз. 6. Вещества, понижающие энергию активации и увеличивающие скорость химической реакции, называются: А) катализаторы Б) ингибиторы В) стимуляторы Г) ускорители 7. Увеличение скорости реакции при использовании катализаторов происходит в результате А) уменьшения энергии активации Б) увеличения теплового эффекта В) увеличения концентрации реагирующих веществ Г) увеличения энергии активации 8. Установите соответствие между уравнением реакции и порядком реакции 1) 2С(тв) + 3D(тв) = 2А(г) 2) С(г) + D(г) = 2В(тв) 3) 2С(тв) + 3D(г) = А(г) 4) 2С(г) + 3D(г) = 2А(г) А) реакция нулевого порядка Б) реакция второго порядка В) реакция третьего порядка Г) реакция пятого порядка 9. Уравняйте уравнения реакций и соотнесите реакции по их суммарному порядку 1) 1 порядок 2) 2 порядок 3) 3 порядок 4) 4 порядок А) NaCl → Na+ + Cl- Б) C2H4 + H2→ C2H6 В) SO2 + O2 → SO3 Г) N2 + H2→ NH3 Д) CaCO3→ CaO + CO2 10. Температурный коэффициент реакции равен 2. При повышении температуры системы на 40 градусов скорость химической реакции: А) увеличится в 16 раз Б) уменьшится в 8 раз В) увеличится в 8 раза Г) увеличится в 64 раза. V3 Растворы V4 Вода 1. На внеклеточную воду приходится А) треть воды организма Б) половина воды организма В) четверть воды организма Г) две трети воды организма 2. На внутриклеточную воду приходится: А) две трети воды в организме Б) половина воды в организме В) треть воды в организме Г) четверть воды в организме 3. Основным внеклеточным катионом является катион ### А) Na+, Б) натрий 4. Основным внутриклеточным катионом является катион ### А) К+ Б) калий 5. Основным внеклеточным анионом является: А) хлорид Б) фосфат В) гидрокарбонат Г) сульфат 6. При обезвоживании организма водный баланс А) отрицательный Б) положительный В) равновесие Г) в этом случае не корректно использовать термин «баланс» 7. Основное количество воды человек выделяет через: А) почки в мочу Б) кожу В) легкие Г) кишечник 8. К амфифильным веществам можно отнести: А) фосфолипиды Б) сахарозу В) жиры Г) фосфорную кислоту 9. По растворимости в воде жирные кислоты относятся к: А) амфифильным Б) гидрофильным В) гидрофобным Г) нерастворимым в воде V4 Осмос 1. Соотнесите растворы по их тоничности к плазме крови (0,3 осмоль) 1) гипотоничные 2) изотоничные 3) гипертоничные А) 0,15 моль/л глюкозы, Б) 0,3 моль/л мочевины В) 0,2 моль/л KCl Г) воздух 2. Осмосом называется движение А) растворителя из области с более низкой концентрацией вещества в область с более высокой концентрацией Б) растворителя из области с более высокой концентрацией вещества в область с более низкой концентрацией В) растворенного вещества из области с более высокой концентрацией вещества в область с более низкой концентрацией Г) растворенного вещества из области с более низкой концентрацией вещества в область с более высокой концентрацией 3. Осмотически активным веществом не является А) мочевина Б) СаС12 В) глюкоза Г) белок 4. Онкотическое давление плазмы крови создает: А) белок Б) хлористый натрий В) глюкоза Г) гидрокарбонат натрия 5. При снижении онкотического давления развивается А) отек Б) обезвоживание тканей В) гипогликемия Г) увеличение объема крови 6. Нормальная осмолярность крови равна: А) 0,3 осмоль Б) 1 осмоль В) 0,5 осмоль Г) 0,1 осмоль V4 Растворы электролитов 1. Соотнесите способы выражения концентраций и единицы измерения концентраций 1) молярная 2) массовая доля 3) моль-эквивалентная 4) процентная А) моль/л Б) доли единицы В) моль-экв/л Г) % Д) моль/кг 2. Гидролизом соли называется А) взаимодействие соли с водой с образованием основания и кислоты Б) распад соли на анионы и катионы В) взаимодействие катионов сильного основания с водой Г) взаимодействие анионов сильной кислоты с водой 3. Гидролизу не подвергаются: А) соли сильной кислоты и сильного основания Б) соли слабой кислоты и сильного основания В) соли сильной кислоты и слабого основания Г) соли слабой кислоты и слабого основания 4. Полному гидролизу подвергаются: А) соли слабой кислоты и слабого основания Б) соли сильной кислоты и сильного основания В) соли слабой кислоты и сильного основания Г) соли сильной кислоты и слабого основания 5. Водные растворы ацетата натрия и карбоната калия имеют: А) рН > 7 Б) рН < 7 В) рН = 7 Г) рН = 0 6. Полному гидролизу подвергается: А) А12(СО3)3 Б) К2СО3 В) А1С13 Г) NaCl 7. Ионное произведение воды равно: А) 10-14 Б) 10-16 В) 15 Г) 16 8. рН раствора равен: А) –lg[Н+] Б) молярной концентрации Н+ В) процентной концентрации Н+ Г) lgС%[Н+] 9. Между рН и рОН существует следующее соотношение: А) рН + рОН = 14 Б) рН = рОН В) рН = – рОН Г) рН + рОН = 16 10. Мерой электролитической диссоциации вещества считают… А) степень диссоциации Б) молярную концентрацию раствора В) процентную концентрацию раствора Г) моляльную концентрацию раствора |
