_5. Газовые смеси,. Газовые смеси. Смеси рабочих тел. Газовые смеси
 Скачать 107.53 Kb. Скачать 107.53 Kb.
|
|
Задание: В тетрадях написать конспект, разобрать примеры решения задач. Газовые смеси. Смеси рабочих тел. 1. Газовые смеси. 1) Газовые смеси - обычно имеются в виду соединения горючих составных частей топлива и воздуха при горении.  Как известно, горение представляет собой химический процесс соединения горючих составных частей топлива с кислородом воздуха. В результате этого процесса получается газовая смесь, состоящая из кислорода, азота, углекислого, газа, водяного пара и некоторых других газов. Состав этих смесей, или, как их называют, продуктов сгорания топлива, может быть самым разнообразным и зависит как от состава топлива, так и от условий, при которых происходит сгорание (в частности, от количества подводимого воздуха). 2) Иногда топливо заставляют сгорать при недостаточном количестве воздуха (в газогенераторе). В этом случаев состав продуктов сгорания топлива входят в значительном количестве водород, окись углерода и другие продукты неполно го сгорания. Такие газовые смеси способны к дальнейшему соединению с кислородом (сгоранию) и при этом выделяют тепло, а поэтому они применяются как горючие газы, часто их употребляют в качестве топлива в двигателях внутреннего сгорания. Газовая смесь может также быть получена в газогенераторе, где происходит сгорание при недостатке кислорода. газогенератор  3) Кроме того к газовым смесям относятся продукты сгорания топлива, а также горючие газы:  Горючий газ, добываемый из недр земли (естественный газ), также представляет собой газовую смесь; она состоит главным образом из метана (СН4), различных углеводоро¬дов, углекислого газа, азота и др. В свою очередь, к смесям не относятся однородные газы, например, пар (рабочее тело в паросиловых установках). Кроме пара все остальные рабочие тела являются смесями и рассматриваются как смеси идеальных газов. 2. Уравнение состояния идеального газа для компонентов смесей. С однородным газом приходится иметь дело главным образом в паросиловых установках, где рабочим телом служит по преимуществу водяной пар. В остальных случаях в качестве рабочего тела используется газовая смесь. Поэтому необходимо уметь вычислять для такой смеси все те величины, о которых шла речь в предыдущих параграфах. Газовые смеси, встречающиеся в теплотехнических расчетах, рассматриваются как идеальные газы; они подчиняются законам Бойля — Мариотта и Гей-Люссака. Уравнение аналогично уравнению идеального газа для однородного газа Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов. Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции. При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие. 3. Понятие парциального давления для смесиПарциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение: Парциальным называется давление pi, которое могло бы создаваться i-ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры. Формула парциального давления будет выглядеть так: 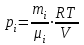 Объем смеси здесь обозначен буквой V, ее температура – T. Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона: р = р1 + р2 +..+рn, тогда 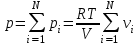 , где , где  - знак суммирования компонентов - знак суммирования компонентов4. Понятие парциального объема для смесиУ газовой смеси также есть такая характеристика, как парциальный объем. Парциальный объем Vi газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема. Если речь идет о смеси идеальных газов, то к ней применим закон Амага: 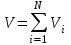 Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так: 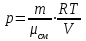 Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так: pV = mRsmTpV Здесь параметры 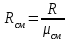 означают удельную газовую постоянную смеси. означают удельную газовую постоянную смеси.5. Параметры смеси 1) Массовая доли смеси  Масса газовой смеси равна сумме масс всех входящих в нее:  2) Объёмная доля каждого компонета газа. 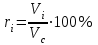 где ri – объёмная доля i-го газа; Vi – парциальный объём i-го газа; V – объём смеси газов. 3) Существует взаимосвязь массовых и объемных долей смеси. Ее несложно получить, выразив массы газов через произведение их объемов на плотности, а отношение плотностей при одинаковых параметрах, в соответствии с законом Авогадро, заменив отношением молярных масс:  4) Кажущаяся молярная масса смеси μсм – это величина, которая определяется путём деления массы смеси mсм, кг, на число молей смеси νсм, моль Кажущаяся молярная масса смеси:  Эта величина имеет условный характер (ее иногда называют кажущейся молекулярной массой) из следующих соображений. По отношению к отдельному газу молекулярная масса — отвлеченное число, характеризующее массу действительно существующей молекулы. Так как газовая смесь — совокупность разнородных молекул, по отношению к такой смеси понятие о молекулярной массе может быть применено в том смысле, что эта смесь как бы заменяется газом, состоящим из однородных фиктивных («средних») молекул, совокупность которых образует газ, соответствующий действительной смеси. Эта величина вводится для удобства при расчетах. В теплотехнических расчетах в громадном большинстве случаев пользуются объемными долями, так как прибор, которым пользуются для определения состава продуктов сгорания — газоанализатор, дает результаты анализа в объемных долях. 5) Кажущуюся молярную массу смеси по её химическому составу μсм= r1 μ1+ r2 μ2+…+ rn, где r – объемные доли компонентов 6) Газовая постоянная смеси Rсм = g1·R1+ g2·R2+……+ gn·Rn, где 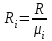 газовая постоянная компонентов смеси газовая постоянная компонентов смеси7) Вычисление относительного объемного состава газовой смеси по относительному массовому составу На практике часто необходим взаимный пересчёт из массовых и объёмных долей. Рекомендуется использовать следующие выражения:   Решение задач Задача 1. Какой объем V занимает смесь газов — азота массой m1=1 кг и гелия массой m2=1 кг — при нормальных условиях? Дано: Решение: m1=1 кг V = V1 + V2 m2=1 кг Уравнение Менделеева-Клайперона: 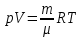 V-? Откуда: 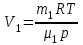 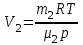  Задача 2. Дана смесь газов, состоящая из 1 кг углекислого газа и 0,5 кг O2. Если считать их идеальными, какой объем они будут занимать при давлении в 1 атм? Температура смеси равна 300К. Дано: M = 1 кг (CO2) m = 0,5 кг (O2) р =1 атм = 10·105Па Т = 300К Vс-? Решение 1) Вычислим общую массу газовой смеси. m = mO2 + mCO2 Значит, m = 1 + 0,5=1,5 2) Вычислим массовые компоненты смеси:  gO2=0,5/1,5=0,33; gСO2=1/1,5=0,67 3) Найдем газовую постоянную смеси: Rсм = g1·R1+ g2·R2, где 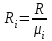 Rсм=8,31(0,33/32⋅10−3+0,67/46⋅10−3)= 200 ДжкгК. 4) Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона: 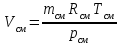 Vsm=1,5⋅200⋅300/105=0,9 м3V Ответ: 0,9 м3. Задача 3. В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне. Дано: V= 25л = 0,025м3 m1 = 20·10-3кг m2 = 2·10-3кг р-? Решение: 1) Уравнение Менделеева-Клайперона: 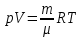 Для двух газов: 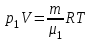 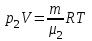 2) Запишем закон Дальтина  Ответ: p = 105 Па. Задача 4 Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением p=1 МПа. Определить парциальные давления p1 кислорода и p2 азота, если массовая доля g1кислорода в смеси равна 0,2 Дано: P =1 МПа g 1 = 0,2 р1,р2-? Решение: Закон Дальтона: р = р1 + р2 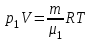 , следовательно , следовательно 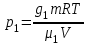 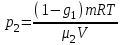 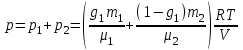 Выразим 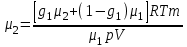 , подставляем в давление р2 , подставляем в давление р2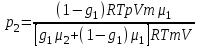 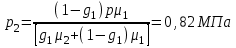 р1 = р - р2 =0,18МПа Задача 5. Сухой воздух состоит в основном из кислорода и азота. Если пренебречь остальными составными частями воздуха, то можно считать, что массовые доли кислорода и азота соответственно g1=0,232, g2=0,768. Определить относительную молекулярную массу Mr воздуха. Дано: g1=0,232, g2=0,768 μ-? Решение: Если известен массовый состав смеси, то по нему можно найти её мольный состав. Массы отдельных газов mi и полную массу смеси т можно выразить через число моль следующим образом: m1=μ1 ν1; m2=μ2 ν2; νсм = ν1 + ν2  Упростим: Упростим:  Тогда  Задача 6.. Найти молярную массу смеси кислорода массой m1 =25г и и азота массой m2=75 г Дано: m1 = 25·10-3кг m2 = 75·10-3кг μсм-? Решение: Молярная масса смеси:  Масса смеси m = m1 + m2 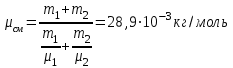 Задача для самостоятельного решения: Имеется сосуд объемом 1 м3, в котором находится 0,10⋅10−3 кгг гелия и 0,5⋅10−3 кг водорода. Постоянная температура равна 290 К. Вычислите давление смеси и парциальное давление гелия в нем. Контрольные вопросы: 1. Что называется смесью газов 2. Назовите параметры смеси газов: массовые доли, объемные доли 3. Как найти парциальное давление смеси газов 4. Как найти кажущуюся молярную массу смеси газов 5. Как вычислить относительный объемный состав газовой смеси по относительному массовому составу 6. Как определить газовую постоянную смеси? |
