|
|
бх. бх колок 2 21-24 2. Гем структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями Синтез гема в основном идет в предшественниках эритроцитов,
21 вопрос
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника, в меньшем количестве в остальных тканях.
Этапы:
Первая реакция синтеза с участием -аминолевулинат-синтазы происходит в митохондриях.
Следующая реакция при участии аминолевулинатдегидратазы протекает в цитозоле.
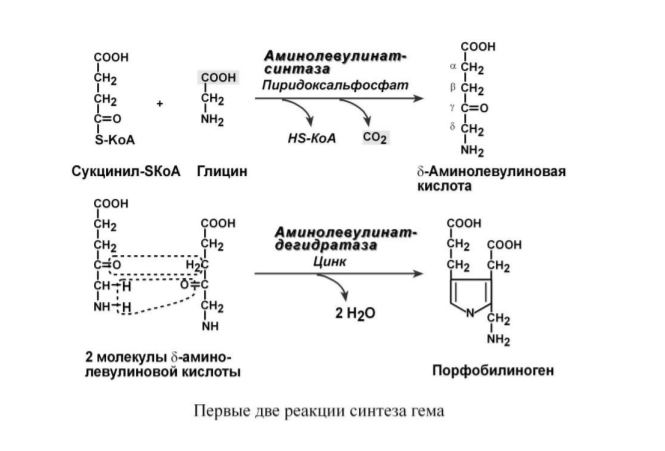
После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиметилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I–синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфириноген III–косинтаза.
Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III возврашается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
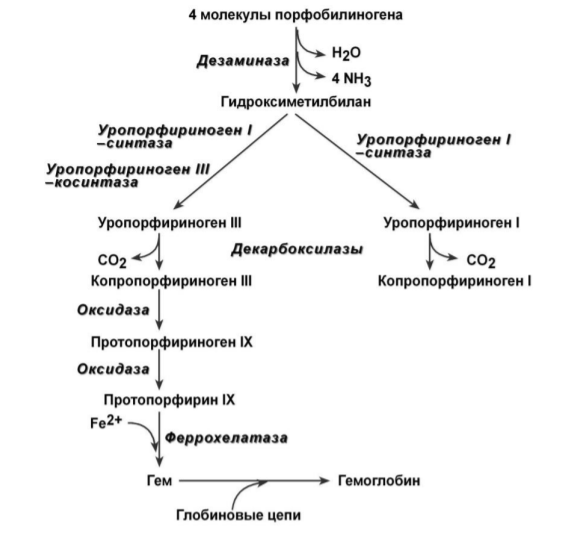
Регуляция:
Гем и гемоглобин являются аллостерическими ингибиторами и репрессорами синтеза аминоливулинатсинтазы. Они регулируют синтез фермента по механизму отрицательной обратной связи.
Скорость-лимитирующей (ключевой) реакцией синтеза гема является реакция образования ALA (аминолевулиновой кислоты). Активность ALA – синтазы, катализирующей эту реакцию, регулируется аллостерически и на уровне транскрипции гена фермента.
Структура гемоглобина:
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Протомеры соединяются друг с другом благодаря образованию гидрофобных, ионных, водородных связей. При этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α ("альфа"), β ("бета"), ε ("'эпсилон") ("кси"), ("дельта"), ("гамма"),. В состав молекулы гемоглобина входят по две цепи двух, разных типов.
Гем соединяется с белковой субъединицей, вопервых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот.
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином образуя оксигемоглобин.
22 вопрос
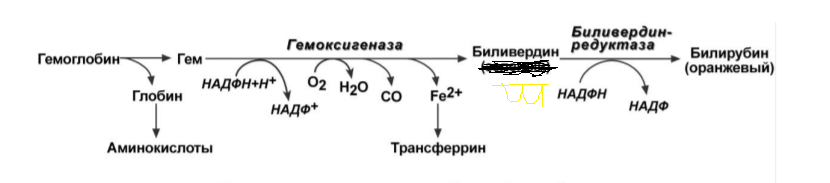
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке.
Этапы катаболизма:
Первая реакция катаболизма гема происходит при участии NADPH-зaвиcимoгo ферментативного комплекса гемоксигеназы. Ферментная система локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, — таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапиррол — биливердин (пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца.
Образованный биливердин под действием биливердинредуктазы превращается в билирубин.
Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Токсичность билирубина состоит в его липофильности. Ситуации, при которых в крови накапливается билирубин, в зависимости от причины делятся на три вида:
(Ниже это виды гипербилирубинемии или же выд желтухи)
•Гемолитические – в результате гемолиза при избыточном превращении гемоглобина в билирубин,
•Печеночно-клеточные – когда печень не в состоянии обезвредить билирубин,
•Механические – если билирубин не может попасть из печени в кишечник из- за механического перекрытия желчевыводящих путей.
Так как в норме билирубин и его фракции находятся в крови в концентрации не более 20 мкмоль/л, то накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Поскольку свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее очень опасно для детей, особенно для новорожденнных.
(Механизм)Токсичность билирубина для новорожденных заключается в том, что неконьюгированный билирубин проходит через гематоэнцефалический барьер и, являясь разобщителем окислительного фосфорилирования, снижает синтез АТФ в клетках головного мозга и вызывает пирогенное действие.
23 вопрос
Протеогликаны
Другая группа гликопротеинов – протеогликаны – характеризуется наличием полисахаридов, состоящих из повторяющихся дисахаридных остатков.
Дисахариды включают в себя уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. В литературе встречаются другие названия – кислые гетерополисахариды (т.к. имеют много кислотных групп), гликозаминогликаны (содержат аминогруппы). Эти молекулы входят в состав протеогликанов – сложных белков, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур.
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
Основными представителями структурных гликозаминогликанов является гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты. Гепарин используется в антикоагулянтной системе крови.
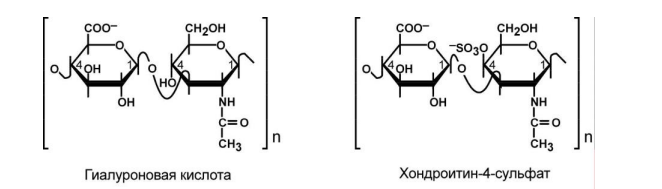
По функции протеогликаны особенно значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. При помощи электронной микроскопии выяснено, что они имеют древовидную структуру – в центре находится гиалуроновая кислота, которая через связующие белки присоединяет многочисленные "веточки" из хондроитинсульфатов, кератансульфатов, дерматансульфатов. Молекулы гликанов весьма гидрофильны, создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмо.
Метаболизм гликозаминогликанов зависит от соотношения скорости их синтеза и распада.
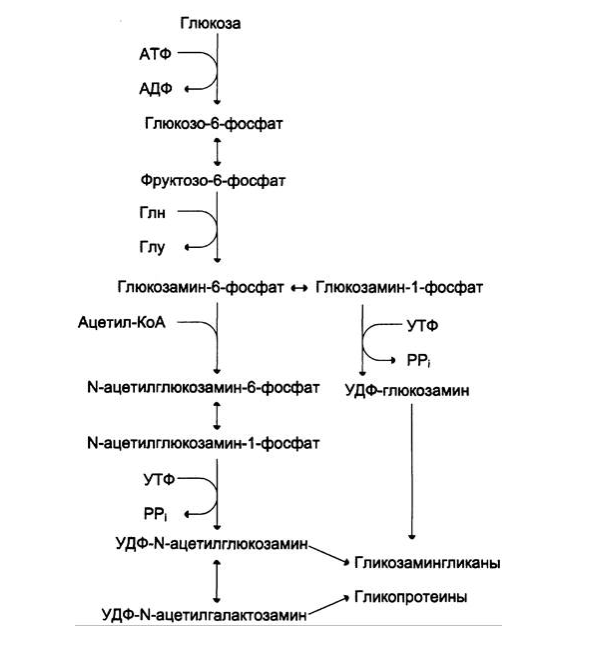
Синтез гликозаминогликанов
Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов. Донорами моносахаридов обычно являются соответствующие нуклеотид-сахара. Реакции синтеза гликозаминогликанов катализируют ферменты семейства трансфераз, обладающие абсолютной субстратной специфичностью. Эти трансферазы локализованы на мембранах аппарата Гольджи. Сюда по каналам ЭР поступает коровый белок, синтезированный на полирибосомах, к которому присоединяются моносахариды связующей области и затем наращивается вся полисахаридная цепь. Сульфатирование углеводной части происходит здесь с помощью сульфотрансферазы, донором сульфатной группы выступает ФАФС.
Аминосахара синтезируются из глюкозы; в соединительной ткани 20% глюкозы используется таким образом. Непосредственным предшественником N-ацетилглкжозамина, N-ацетилгалактозамина и сиаловой кислоты является фруктозо- 6-фосфат. Источником NН2-группы в этих сахарах служит глутамин. Аминосахар далее ацетилируется с помощью ацетил-КоА. Активированными формами этих аминосахаров служат их УДФ-производные.
L-идуроновая кислота образуется после включения D-глюкуроновой кислоты в углеводную цепь в результате реакции эпимеризации.
На синтез гликозаминогликанов влияют глюкокортикоиды: они тормозят синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов. Показано также тормозящее действие половых гормонов на синтез сульфатированных гликозаминогликанов в органах-мишенях.
24 вопрос
КОЛЛАГЕН
Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
Полипептидная цепь коллагена включает 1000 аминокислот и носит название α-цепь. Насчитывается около 30 вариантов α-цепи коллагена, но все они обладают одним общим признаком – в большей или меньшей степени включают повторяющийся триплет [Гли-Х-Y], где X и Y – любые, кроме глицина, аминокислоты. В положении X чаще находится пролин или, гораздо реже, 3-оксипролин, в положении Y встречается пролин и 4-оксипролин. Также в положении Y часто находится аланин, лизин и 5-оксилизин. На другие аминокислоты приходится около трети от всего количества аминокислот. Гидроксилирование пролина и лизина осуществляют соответствующие гидроксилазы, железосодержащие ферменты, для их полноценной работы необходим витамин С (аскорбиновая кислота).
Коллаген обычно содержит моносахаридные (галактоза) и дисахаридные (глюкоза-галактоза) молекулы, соединенные с ОН-группами некоторых остатков оксилизина.
Молекула тропоколлагена построена из 3 -цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через -аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.

Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между глицином и лейцином. В результате распада коллагена появляется свободный гидроксипролин. При поражении соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидроксипролина возрастает и имеет диагностическое значение. По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Это ведет к повышенной ломкости кости и снижению прозрачности роговицы глаза в старческом возрасте.
Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных.
1-Й ЭТАП
Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген.
2-Й ЭТАП
С помощью сигнального пептида “пре” транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется “пре” - образуется “проколлаген”.
3- Й ЭТАП
Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы (эти окислительные ферменты относятся к подподклассу монооксигеназ) (смотрите рисунок). При недостатке витамина “С” - аскорбиновой кислоты наблюдается цинга, - заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления.
4-Й ЭТАП
Посттрасляционная модификация - гликозилирование проколлагена под действием фермента гликозил трансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина.
5-Й ЭТАП
Заключительный внутриклеточный этап - идет формирование тройной спирали - тропоколлагена (растворимый коллаген). В составе про-последовательности - аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации.
6-Й ЭТАП
Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность.
7-Й ЭТАП
Ковалентное “сшивание” молекулы тропоколлагена по принципу “конец-в-конец” с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь. Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном. Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена).
8-Й ЭТАП
Ассоциация молекул нерастворимого коллагена по принципу “бок-в-бок”. Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи. |
|
|
 Скачать 458.8 Kb.
Скачать 458.8 Kb.





