Гемоглобин и его производные. Гемоглобин и его производные. Гемопротеины
 Скачать 294.5 Kb. Скачать 294.5 Kb.
|
|
Гемоглобин и его производные. Гемопротеины К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо(или магний)-порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Рассмотрим более подробно химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения [показать]. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового - гем. Видовые различия гемоглобина обусловлены глобином, в то же время гем одинаков у всех видов гемоглобина. Структурную организацию гемоглобина (и миоглобина) расшифровали Дж. Кендрью и М. Перутц (Нобелевская премия 1962 г.). Гемоглобину принадлежит уникальная роль в транспорте кислорода от легких к тканям и углекислого газа от тканей к легким. Это важное проявление жизни - дыхание - основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340 000 000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов. Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из четырех молекул тема "обернута" одной полипептидной цепью. В молекуле гемоглобина взрослого человека, обозначаемого НbА (от англ. adult - взрослый), содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы - глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру и включают по 141 аминокислотному остатку. Две другие, обозначаемые β-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат одинаковые аминокислотные последовательности. В дополнение к основному гемоглобину, НbА1, в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из четырех субъединиц: двух α- и двух δ-цепей. На долю НbА2 приходится около 2,5 % от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый НbF и состоящий из двух α- и двух γ-цепей. Фетальный гемоглобин отличается от НbA1 не только по составу аминокислот, но и по ряду физико-химических свойств: спектральным показателям, электрофоретической подвижности, устойчивости к щелочной денатурации и др. Кровь новорожденного ребенка содержит до 80% НbF, но к концу 1-го года жизни он почти целиком заменяется на НbА (и все же в крови взрослого человека открывается до 1,5% НbF от общего количества гемоглобина). Нельзя не отметить и тот факт, что последовательность аминокислот в γ- и δ-цепях гемоглобинов окончательно не расшифрована. Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования, связанные с расшифровкой структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются эти гемоглобины в крови вследствие мутаций генов. Аномальные гемоглобины, отличающиеся по форме, химическому составу и величине заряда, были выделены при помощи методов электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную (табл. 2. [показать]) и, поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (α или β), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью. Болезни гемоглобинов (их насчитывают более 200) называют гемоглобинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к "молекулярным болезням"). талассемии, обусловленные нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии. В медицинской практике часто прибегают к анализу кровяных пигментов, который основан на исследовании спектроскопических свойств тема гемоглобина, точнее, продуктов его окисления (хлорида гемина или гематина, образующихся соответственно при обработке гемоглобина уксусной кислотой в присутствии хлорида натрия или разведенными растворами щелочей). При восстановлении гематина сульфитом аммония в присутствии глобина образуется производное гемоглобина - гемохромоген, в котором денатурированный глобин соединен с гемом. Полученный комплекс имеет характерный спектр поглощения; этот метод широко применяется в судебно-медицинской практике при исследовании кровяных пятен. Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин - НbО2 - соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к гему гемоглобина при помощи координационных связей железа, причем валентность железа не меняется и железо остается двухвалентным. Такой гемоглобин называют оксигенированным. Неправомочно называть процесс присоединения кислорода к гемоглобину окислением, а НbО2 - окисленным гемоглобином, так же как и диссоциацию оксигемоглобина (НbО3), т. е. распад его на Нb и кислород, - восстановлением, а Нb - восстановленным, поскольку в обоих случаях изменения валентности железа в теме не происходит. Помимо кислорода, гемоглобин легко соединяется и с другими газами, в частности с СО, N0 и др. Так, при отравлении оксидом углерода гемоглобин прочно с ним связывается с образованием карбоксигемоглобина (НbСО). При этом из-за высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом. Однако повышение парциального давления кислорода во вдыхаемом воздухе приводит к частичному вытеснению СО из связи с гемоглобином. При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Поскольку метгемоглобин также теряет способность к переносу кислорода от легких к тканям, то и в случаях метгемоглобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т. е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния. В заключение следует указать, что самым надежным методом качественного определения различных производных гемоглобина является исследование их спектров поглощения. У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы - гемэритрин и гемоцианин. Они не относятся к гемосодержащим хромопротеинам, хотя в этих терминах содержится корень "гем". Эти белки, как и гемоглобин, несмотря на то, что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (в случае гемэритрина) и меди (в случае гемоцианина) с кислородом и др. Эти отличия суммированы в табл. 3 [показать] (по Г. Эйхгорну). Трансферрины (сидерофилины) - группа сложных белков, полученных из разных источников и характеризующихся способностью специфично, прочно и обратимо связывать ионы железа Ре (III) и других переходных металлов. Наиболее подробно из этой группы белков изучен трансферрин сыворотки крови. Функция трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина. Система трансферрин - ретикулоцит считается весьма перспективной для изучения взаимодействия металла с белком и белковой молекулы с клеткой. Обмен хромопротеидов. Проблемы синтеза и распада хромопротеидов привлекают внимание как исследователей, так и практических врачей по двум основным причинам. Во-первых, вследствие широкого разнообразия биологически важных функций гемоглобина, хлорофилла и цитохромов (от фотосинтетических до тканевого дыхания), в которых центральную роль играет ядро порфирина (см. Химия сложных белков), обладающего способностью координационно связываться с ионами металлов. Во-вторых, потому, что изменения синтеза или распада порфиринов и соответственно их комплексов с белками приводят к нарушению жизненно важных функций и к развитию болезней у человека и животных. В данном разделе рассмотрены современные представления о синтезе и распаде железопорфиринов и, в частности, гемоглобина, наиболее важного для человека хромопротеида. В организме человека содержится около 4,5-5,0 г железа. На долю гемоглобина крови из этого количества (если взять за 100% все железо в организме) приходится 60-70%, на долю многлобина -3-5%, ферритина - 20% (от 17 до 23%), трансферрина - около 0,18%, функционального железа тканей - до 5%. Содержание железа в организме человека и животных регулируется главным образом интенсивностью всасывания пищевого железа в кишечнике. Избыток его просто не всасывается. Потребность в железе резко возрастает при анемиях различного происхождения. Данные о месте всасывания пищевого железа, механизме его транспорта, отложения и мобилизации из депо можно представить в виде следующей модифицированной таблицы, заимствованной у Кантарова и Шепарц (табл. 41). 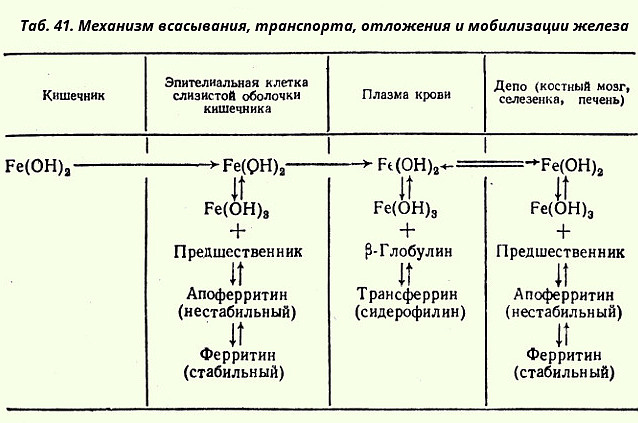 Пищевое железо всасывается в кишечнике в виде неорганического двухвалентного железа (Fe2+) после освобождения его из комплексов с белками. В клетках слизистой оболочки кишечника железо уже в трехвалентной форме (Fe3+ соединяется с белком апоферритином с образованием стабильного комплекса ферритина. Дальнейший транспорт железа к местам кроветворения осуществляется в комплексе с β1-глобулинами сыворотки крови (комплекс получил название трансферрина) или железо соединяется с апоферритином тканей и в виде ферритина депонируется (см. табл. 41). При некоторых заболеваниях (в частности, при гемохроматозе) избыток железа откладывается в клетках ретикулоэндотелиальиой системы в виде гемосидерина, метаболически инертного соединения железа с белком. Источниками железа для синтетических целей являются пищевые продукты, а также железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезенки (около 25 мг Fe за сутки). Что касается железа пищевых хромопротеидов (гемоглобина, миоглобина и др., включая хлорофиллпротеиды), то имеющиеся данные свидетельствуют о том, что простетические группы этих соединений не используются для синтеза железопротеидов организма, поскольку после переваривания небелковый компонент - гем - подвергается окислению в гематин, который, так же как и хлорофилл, не всасывается в кишечнике. Обычно эти пигменты выделяются с калом в неизмененной форме или в виде продуктов распада под действием кишечных бактерий. Следовательно, синтез сложного пиррольного комплекса в организме протекает из низкомолекулярных предшественников de novo, а не путем обращения химических реакций распада гемсодержащих соединений. |
