Тема 27. Гетероциклические соединения.. Гетероциклические ароматические соединения
 Скачать 79.27 Kb. Скачать 79.27 Kb.
|
|
Гетероциклические ароматические соединения Химические свойства Методы получения Шестичленные ароматические гетероциклы и их производные Алкалоиды Строение и номенклатура Ароматические гетероциклы представляют собой плоские циклические системы, содержащие вместо одного или нескольких атомов углерода, атомы кислорода, серы, азота. Ароматическими их называют вследствие того, что они удовлетворяют всем критериям, присущим любой ароматической системе, а именно: · Система является циклической · Цикл является плоским · Имеется сопряжение по всему циклу, то есть возможность беспрепятственной делокализации любого из p-электронов по всей системе, благодаря наличию негибридизованных р-орбиталей · Число делокализованных p- электронов, участвующих в сопряжении, отвечает, согласно правилу Хюккеля, проявлению ароматических свойств, а именно, равно 4n+2, где n- любое натуральное число, включая 0. Среди ароматических гетероциклических соединений наиболее широко распространены и, соответственно, представляют наибольший интерес, пяти- и шести-членные гетероциклы, включающие в своем составе азот, серу и кислород, а также эти же системы, конденсированные с бензольным кольцом. К пятичленным циклическим системам с одним гетероатомом относятся: пиррол, фуран и тиофен: 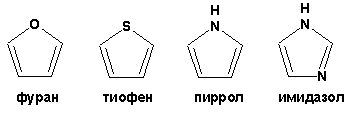 Из пятичленных гетероциклов с двумя гетероатомами наибольший практический интерес представляет имидазол. К конденсированным с бензольным кольцом пятичленным гетероциклам относятся: 2,3- бензопиррол (индол, I), 3,4-бензопиррол (изоиндол, II), бензимидазол(III), бензофуран(IV) и 2,3-бензотиофен(V): 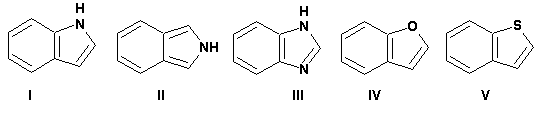 Наиболее важными из шестичленных гетероциклов являются: пиридин, пиримидин, хинолин (бензопиридин) и пурин. 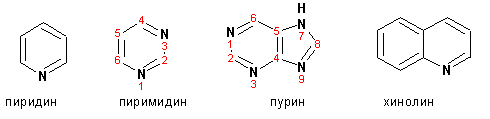 Характерной особенностью пятичленных гетероциклических соединений является одновременное сочетание у них свойств как ароматического соединения, так и диена. Склонность к реакциям того и другого типов, однако, у них различна и связана с природой гетероатома. Так, “ароматические” свойства убывают в ряду: тиофен > пиррол > фуран. При этом их ароматические системы менее устойчивы, чем у бензола. При нахождении гетероатома в кольце он взаимодействует с его электронной системой по двум направлениям. Как более электроотрицательные элементы, азот, сера и кислород, оттягивают электронную плотность с кольца по индуктивному эффекту, распространяющемуся по системе s- связей. Однако решающий вклад вносит мезомерный эффект, имеющий в каждом из этих случаев противоположное индуктивному эффекту направление. Таким образом, молекула пятичленного гетероциклического соединения становится поляризована, где “положительным” центром поляризации служит гетероатом. Электрические моменты диполей убывают в том же порядке, что и ароматические свойства. Наиболее электроотрицательный кислород имеет меньшую склонность к обобществлению своей пары электронов в ароматической системе, поэтому фуран обладает наименьшими ароматическими свойствами в ряду тиофен-пиррол-фуран. Меньшая устойчивость ароматических систем у пятичленных гетероциклов объясняется двойственной природой np-электронной пары гетероатома, несоответствием валентных углов внутри цикла значению 120 градусов, характерному для sp2-гибридизованного атома углерода, а также сильной поляризацией связи углерод-гетероатом. В результате наибольшая электронная плотность сосредоточена на ближайших к гетероатому атомах углерода (a- положения). На удаленных от него b- атомах углерода электронная плотность ниже. Все это предопределяет химические свойства соединений этого класса. Пятичленные гетероциклы в целом легче вступают в реакции электрофильного замещения, по сравнению с незамещенным бензолом. Замещение проходит по положению 2, если оно занято, замещаются атомы у третьего атома углерода Совершенно иначе сказывается наличие гетероатома (азота) в шестичленном цикле пиридина. Неподеленная пара электронов азота не участвует в образовании ароматической системы, поэтому, в отличие от пиррола, пиридин проявляет выраженные основные свойства, а в отличие от бензола, его ароматическая система обеднена электронной плотностью вследствие проявления отрицательного индуктивного эффекта азота. Поэтому пиридин вступает в реакции электрофильного замещения в значительно более жестких условиях, чем незамещенный бензол, и в положения 3 относительно азота. Одновременно для пиридина характерны реакции нуклеофильного замещения, идущие с большей легкостью, нежели у незамещенного бензола, по тем же причинам. Гетероциклические соединения чрезвычайно широко распространены в живой природе. Так, гетероциклы семейств пурина и пиримидина являются неотъемлемой частью нуклеиновых кислот, ответственных за хранение и передачу наследственной информации. Взаимодействие пуриновых и пиримидиновых производных по системе водородных связей лежит в основе процессов репликации, транскрипции и трансляции, основ функционирования любой живой клетки. В технике и в промышленности гетероциклические соединения находят применение в качестве растворителей (тетрагидрофуран, пиридин), компонентов красителей, являются важными компонентами очень многих синтетических лекарственных средств, исходными соединениями при синтезах целого ряда важных химических соединений. Химические свойства Пятичленные ароматические гетероциклы и их производные Как уже было отмечено, устойчивость ароматической системы убывает в ряду: Тиофен > Пиррол > Фуран. Наименее ароматичный фуран, присоединяя в кислой среде протон по атому кислорода, образует диеновую систему, склонную к полимеризции и осмолению. Поэтому реакции электрофильного замещения в фуране (проходящие настолько же легко, как и в фенолах) проводят в нейтральных и щелочных средах. Так, фуран ацилируется ангидридами кислот в присутствии SnCl4, сульфируется пиридинсульфотриоксидом (бескислотный сульфирующий агент, пиридин связывает образующиеся при сульфировании протоны), нитруется ацетилнитратом : 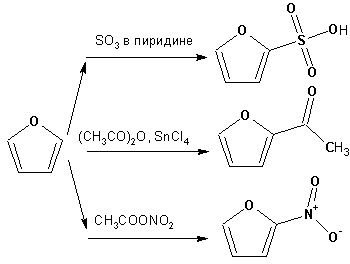 Галогенирование фурана галогенами приводит к замещению всех четырех атомов водорода: 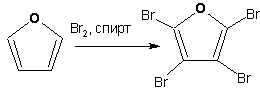 Моногалоидные производные получают косвенным путем: 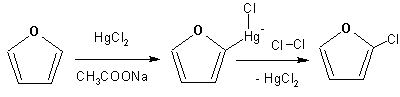 Фуран легко вступает в реакцию Дильса-Альдера с диенофилами (малеиновый ангидрид): 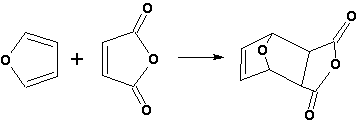 При нагревании с разбавленной соляной кислотой цикл легко раскрывается: 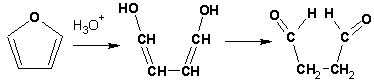 Фурановый цикл приобретает устойчивость при наличии в нем электроноакцепторных заместителей: -NO2, -CHO, -COOH, -SO2OH, галогены. Из производных фурана большое значение имеет применяемый в качестве растворителя тетрагидрофуран, получаемый при гидрировании фурана на никелевом катализаторе. Тиофен по ароматичности наиболее близок к бензолу и для него характерны все реакции электрофильного замещения, протекающие с большей легкостью, чем у незамещенного бензола. Так, одним из способов очистки технического бензола от тиофена является обработка бензола серной кислотой на холоду: 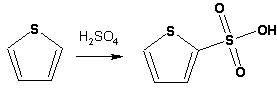 Образующаяся при этом сульфокислота тиофена растворяется в серной кислоте. Тиофен устойчив в сильнокислых средах, но атом серы чувствителен к окислению, поэтому при нитровании тиофена не применяют азотную кислоту, а используют ацетилнитрат (см. фуран). При галогенировании в тиофене замещаются только 2 атома водорода: 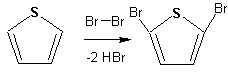 Бромтиофен легко образует магнийорганические соединения, из которых можно получить многие производные тиофена. При восстановлении тиофена получают тетрагидротиофен (тиофан) (I) , последний может быть окислен в сульфоксид (II) или сульфолан (III): 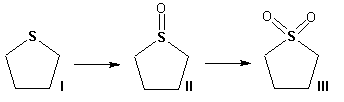 Интерес представляет конденсированное соединение тиофена- бензтиофен, производным которого является кубовый краситель красного цвета- тиоиндиго: 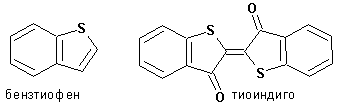 Вследствие наличия значительной доли положительного заряда у атома азота пиррол в большей степени проявляет кислотные свойства, нежели основные. Тем не менее, это все же очень слабая кислота, способная отдавать протон лишь при взаимодействии с очень сильными основаниями: 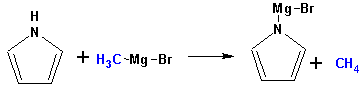 Отрицательный заряд аниона (I) значительно делокализован: 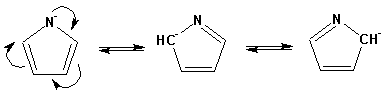 поэтому в реакциях с галоидными алкилами можно получить как N-замещенные алкилпирролы (при низких температурах): 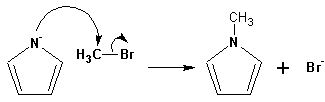 так и a- алкилпирролы (при повышенной температуре): 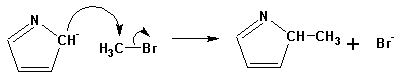 Свободный пиррол в отличие от тиофена мало устойчив в кислых средах, также проявляя склонность к полимеризации и окислению. Однако, повышенная электронная плотность в кольце приводит и к большей легкости протекания реакций электрофильного замещения, которые проходят в мягких условиях, подобно фурану. Пиррол имеет сравнительно высокую температуру кипения (130 оС), которая объясняется структурированием при образовании межмолекулярных водородных связей: 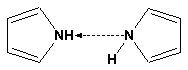 Имидазол, подобно пирролу, также значительно структурирован и имеет еще большую температуру кипения (250 оС): 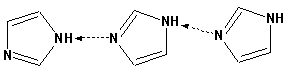 Электрофильное замещение в кольце имидазола протекает по положениям 4 или 5, в которых электронная плотность намного больше, чем в положении 2. Атомы азота в молекуле имидазола равноценны, благодаря равновесию: 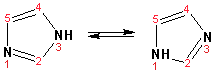 Наличие второго атома азота в кольце значительно понижает в нем электронную плотность, что стабилизирует молекулу в целом. Имидазол не боится кислой среды, а электрофильное замещение протекает значительно труднее, чем в случае с пирролом. Как слабая кислота, имидазол образует металлопроизводные с натрием или реактивами Гриньяра, подобно пирролу. Получают имидазол конденсацией глиоксаля и формальдегида в присутствии аммиака: 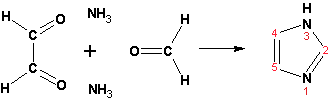 Методы получения Фуран получают в промышленных масштабах из фурфурола, каталитическим декарбоксилированием: 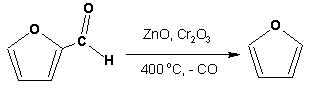 Сам фурфурол получают кипячением с разбавленными кислотами пятиатомных углеводов (пентоз), которые в больших количествах содержатся подсолнечной шелухе, кукурузных початках, отрубях и др. Тиофен получают циклизацией бутана или бутилена в парах серы при 700 оС: 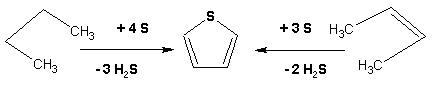 Пиррол (в переводе означает “красное масло) получают пиролизом аммонийной соли слизевой кислоты: 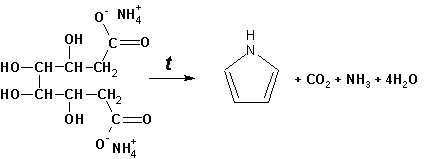 Или восстановлением сукцинимида цинковой пылью: 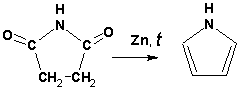 Ю. К. Юрьев открыл реакции взаимопревращений пятичленных гетероциклов, которые также применяют с целью их получения. Реакция идет в токе сероводорода, аммиака и воды, при высоких температурах, над окисью алюминия: 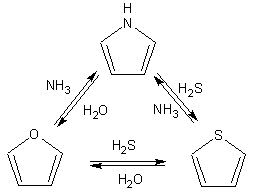 Шестичленные ароматические гетероциклы и их производные Распределение электронной плотности по атомам пиридинового кольца показано на схеме: 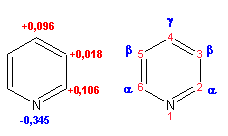 Молекула пиридина поляризована и отрицательный центр поляризации сосредоточен на атоме азота. Вследствие этого, как уже было отмечено ранее, электрофильное замещение в пиридине протекает значительно труднее, чем в незамещенном бензоле, а нуклеофильное- легче, особенно при взаимодействии с сильными основаниями: 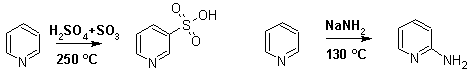 Так, сульфирование пиридина пиросерной кислотой протекает при 250 оС в бета-положение, нитрование нитратом калия в азотной кислоте также проходит с трудом, только при 350оС и с выходом 15%, в то время как реакция с амидом натрия идет при сравнительно небольшом нагревании. Атом азота в пиридине устойчив по отношению к окислителям, поэтому алкилпиридины легко окисляются до пиридинкарбоновых кислот:  Однако, под действием перекисей, пиридин легко превращается в окись пиридина: 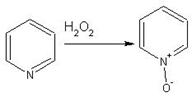 Последняя легко подвергается реакциям электрофильного замещения, с образованием замещенных, подобно активированным электронодонорными заместителями производным бензола: 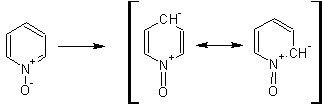 На схеме отчетливо видно, каким образом в окиси пиридина кольцо активировано к электрофильному замещению, притом, во 2-м и 4-м положениях. Это важный способ получения производных пиридина, которые не могут быть получены путем прямого замещения. После реакции замещения окись восстанавливают в пиридин диметилсульфоксидом. Из бензозамещенных имеет практическое значение 2,3-бензопиридин или хинолин. Хинолин получают из каменноугольной смолы (как и сам пиридин), либо синтезируют из анилина и глицерина, в присутствии серной кислоты и окислителя- нитробензола (синтез Скраупа). Из глицерина получается участвующий далее в реакции акролеин: НО-СН2-СН(ОН)-СН2-ОН + H2SO4--> CH2=CH-CHO + 2 H2O 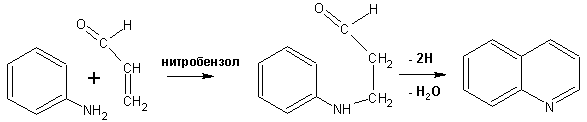 Для пиридинового кольца хинолина характерны все реакции самого пиридина, однако реакции электрофильного замещения идут в бензольном кольце, в положениях 5 или 8: 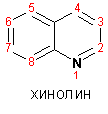 При взаимодействии с окислителями (Cr2O42-, в кислой среде, при нагревании) разрушается бензольное кольцо хинолина: 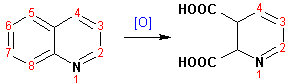 Хинолин применяется как высококипящий растворитель, а также для синтеза лекарственных препаратов и красителей. Пиримидин, отличающийся от пиридина наличием двух атомов азота в кольце, по положениям 1 и 3, имеет больший частичный положительный заряд в положениях 2, 4 и 6, и меньший- в положении 5, поэтому он инертен к электрофильным атакам: 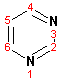 По этой же причине пиримидин устойчив к действию окислителей. Хорошая растворимость в воде объясняется образованием водородных связей при участии атомов азота. Производные пиримидина: цитозин (I), тимин (II) и урацил (III) являются важнейшими компонентами нуклеиновых кислот, неотъемлемыми частями любой живой материи: 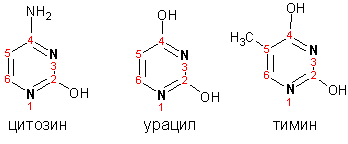  |
