Гетероциклические соединения
 Скачать 163.5 Kb. Скачать 163.5 Kb.
|
|
Тема урока: «Гетероциклические соединения» Цели урока: 1. Ввести понятие «ароматические гетероциклические соединения», рассмотреть состав и строение молекул пиридина и пиррола, охарактеризовать негативную роль табакокурения и наркомании в жизни человека (обучающая, воспитывающая). 2. Продолжить формирование научного мировоззрения (воспитывающая). 3. Способствовать развитию логического мышления (умения сравнивать, обобщать, делать выводы) (развивающая). Ход урока Подготовка к восприятию нового материала (10 мин) Опрос учащихся по домашнему заданию. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: карбонат кальция - оксид кальция - карбид кальция - ацетилен - бензол - нитробензол - анилин - триброманилин Изучение нового материала (12 мин). Гетероциклические соединения – вещества, в молекулах которых в состав цикла входит один или несколько атомов других элементов (O, S, N, P и др.).   Наиболее важное биологическое значение имеют азотсодержащие пяти- и шестичленные гетероциклы (пиридин, имидазол и никотиновая кислота). Ароматические гетероциклы– соединения, имеющие плоский замкнутый цикл и сопряженную электронную систему, содержащую (4n+2) π-электрона, где n=1,2,3 и т.д. Ароматические гетероциклы по свойствам напоминают бензол и др. ароматичекие соединения: высокая стабильность, не вступают в реакции присоединения, вступают в реакции замещения. Пиридин C5H5N.  Молекула пиридина образуется в результате замены группы СН- на группу NH-. Атом азота в цикле имеет неподеленную пару электронов, которая не участвует в образовании σ-связей и сопряженной π-системы. Физические свойства. Бесцветная жидкость, хорошо растворимая в воде и органических растворителях, с характерным неприятным запахом. Очень ядовит. Химические свойства. Пиридин можно рассматривать как амин. Пиридин обладает основными свойствами благодаря паре электронов атома азота. Изменяет цвет индикатора. Присоединяет протон при реакциях с минеральными кислотами. С трудом вступает в реакцию нитрования:  Вступает в реакцию гидрирования в присутствии катализатора: 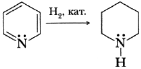 К производным пиридина относится алкалоид никотин:  Пиррол Строение молекулы. Молекула пиррола – пятичленный цикл с одним атомом азота в цикле. В создании ароматического кольца участвуют 4р-электрона атома углерода и неподеленная электронная пара атома азота.  Физические свойства. Пиррол – бесцветная жидкость, малорастворим в воде, на воздухе быстро окисляется (буреет). Химические свойства. Проявляет ароматические свойства. Как бензол, вступает в реакцию восстановления водородом и нитрования. В отличие от бензола легко нитруется. Ядро пиррола входит в состав хлорофилла, гемоглобина. Закрепление нового материала (16 мин). Решение задач: 1. Решение задачи на вычисление выхода продукта реакции. Условие задачи: При йодировании 50 г пиррола получили 360 г тетрайодпиррола. Чему равен выход продукта реакции? Ответ запишите с точностью до десятых долей. Шаг первый: вычислим молярную массу пиррола. Шаг второй: вычислим молярную массу тетрайодпиррола: Шаг третий: найдем количество тетрайодпиррола при 100%-ном выходе. Для этого составим пропорцию: 50 : 67 = х : 571, откуда х = (50·571) : 67 = 426 г. Шаг четвертый: найдём выход продукта реакции. (360 : 426)·100 = 84,5 %. Ответ: 84,5. 2.Решение задачи на определение необходимого количества реагента. Условие задачи: Взаимодействием ацетилена и формальдегида с последующей обработкой промежуточного продукта аммиаком получают пиррол. Выход реакции при использовании 20%-ного избытка аммиака составляет 85%. Какой объём аммиака (л), измеренный при нормальных условиях, необходим для получения 0,5 кг пиррола? Ответ запишите с точностью до десятых долей. Шаг первый: В молекуле аммиака один атом азота и в молекуле пиррола тоже один атом азота, то есть для получения 1 моль пиррола требуется (без учёта избытка) 1 моль аммиака. При нормальных условиях 1 моль аммиака занимает объём, равный 22,4 л. Шаг второй: вычислим молярную массу пиррола: Шаг третий: составим пропорцию и найдём необходимый объём аммиака. х : 22,4 = 500 : 67. (0,5 кг = 500 г). х = 167 л. Шаг четвёртый: найдём объём аммиака с учётом 20%-ного избытка. 167 л – 100 %; V л – 120 %. V = (167·120) : 100 = 200,6 л. Ответ: 200,6. IV. Подведение итогов учебного занятия, рефлексия (2 мин). V. Домашнее задание: |
