гломерулонефрит. Гломерулонефрит это
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
Гломерулонефрит это заболевание почек, во время которого происходит воспаление клубочков почек, что в будущем приводит к развитию недостаточности. Первые сведения об этом заболевании появились в конце 19 века. Основные работы по исследованиям, а также написанием научных статей занимались Брайт (в 1827 году), Фольгард совместно с Фаром (в 1914 году), Боткин. Фольгард характеризовал это заболевание, как воспаление тканей почек, во время которого появлялся главный симптом, как повышение артериального давления. К тому же, он выделял три стадии развития: хроническую и острую (на этих стадиях не появлялась почечная недостаточность), и конечную, уже с почечной недостаточностью. Источник Больше Здоровья: http://morehealthy.ru/material/istoriya-bolezni-glomerulonefrit-otkrytie-prichiny-osobennosti-2898.html Больше всего работ проводилось в начале и середине 20 века, когда медицина начала развиваться, и начала постепенно появляться техника, благодаря которой удавалось проводить сложные исследования. Так, в 1934 году у Масуги получилось создать практически идентичную модель болезни, которая долгое время считалась единственной и полностью совпадающей с человеческой. В 1949 году Руби, проведя некоторые эксперименты, смог обнаружить увеличенный кровоток в почках при нефрите. В 1950 году двое ученых, Кунс и Каплан, смогли создать специальный метод, благодаря которому можно было обнаруживать антитела и антигены при помощи флуоресцентного красителя. А у Ланса получилось обнаружить антигены стрептококка на мембране клубочков в почках. Все дальнейшие исследования проводились уже в условиях новейших технологий, и каждый новый врач-нефролог, предлагал свои дополнения, благодаря которым стало еще больше известно о гломерулонефрите. Среди известных ученых, которые внесли свой вклад в изучение этой болезни, есть и советские ученые, такие как Тареев, Рябов, Серов. Стоит отметить, что болезнь развивается примерно в течение 15 лет. За это время могут быть как острые, так и хронические стадии, а также может наблюдаться период ремиссии. По тому, как развивается гломерулонефрит, его относят к инфекционным и аллергическим болезням. Если постараться расшифровать это определение, то примерно это значит, что в организме происходит аллергическая реакция на какую-то инфекцию, причем она не носит иммунный характер, то есть это не ответ организма на раздражитель Источник Больше Здоровья: http://morehealthy.ru/material/istoriya-bolezni-glomerulonefrit-otkrytie-prichiny-osobennosti-2898.html Но, как и везде, бывают исключения. Встречаются случаи, когда характер болезни носит аутоиммунное происхождение, то есть орган повреждается теми антителами, которые вырабатывается относительно собственного органа, то есть организм сам убивает свои клетки. Если говорить о том, как протекает болезнь, то можно сказать, что в первые 15 лет не будет наблюдаться почечная недостаточность. Но это не значит, что ее не будет вообще. Со временем функции почек начинают угасать, и недостаточность начинает развиваться. Обычно это происходит тогда, когда болезнь переходит в хроническую стадию Источник Больше Здоровья: http://morehealthy.ru/material/istoriya-bolezni-glomerulonefrit-otkrytie-prichiny-osobennosti-2898.html Гломерулонефрит Классификация Существует несколько классификаций гломерулонефрита. По течению процесса различают: Острый диффузный гломерулонефрит. По клиническим характеристикам разделяется на две формы:
Хронический гломерулонефрит. Разделяется по клиническим формам на:
По этиологии и патогенезу различают: Первичный гломерулонефрит - развивающийся вследствии непосредственного морфологического разрушения почек. И вторичный гломерулонефрит, который является следствием основного заболевания. Например ,инфекционная инвазия бактериями, вирусами и другими вирулентными микроорганизмами, наркотиками, злокачественными образованиями или системными заболеваниями, например системная красная волчанка, васкулит и так далее. По клинико-морфологическим признакам разделяют:
Этиология В этиологии гломерулонефрита установлена роль бактериальных и вирусных заболеваний, которые предшествуют поражению клубочков почек. Наиболее детально исследована и доказана роль стрептококковой инфекции. Чаще всего гломерулонефрит возникает после перенесенных заболеваний стрептококковой природы (ангина, скарлатина, стрептококковая пиодермия, обострения хронического стрептококкового тонзиллита и др.). Этиологическая роль стрептококковых антигенов в генезе гломерулонефрита подтверждена частым их обнаружением у больных детей, наличием в крови стрептококковых антигенов и антител к ним (антистрептолизина-О, антигиалуронидазы, антител к Μ-протеину стрептококка), а также доказана в эксперименте. Установлено также, что ведущее этиологическое значение имеют бета-гемолитические стрептококки группы А, особенно типов 4, 6, 12, 18, 25, 49, которые получили название нефритогенных. Недавно детально изучена роль стрептококкового антигена в патогенезе острого постстрептококкового гломерулонефрита. Исследовали значение стрептококкового протеина (преабсорбированный антиген), который был выделен с помощью хроматографии из нефритогенных стрептококков, в развитии заболевания. Антитела к указанному стрептококковому антигену были обнаружены у 96,8% больных острым постстрептококковым гломерулонефритом и только у 2,8% больных стрептококковой инфекцией верхних дыхательных путей и здоровых людей. Было также обнаружено, что преабсорбированный стрептококковый антиген активирует альтернативный путь активации системы комплемента, тогда как другие водорастворимые стрептококковые антигены, используемые в качестве контроля, не активировали систему комплемента. Кроме того, данный стрептококковый антиген выявляется в гломерулах в ранней стадии заболевания и способен активировать СЗ и фактор В, что подтверждает его ведущую роль в патогенезе острого постстрептококко вого гломерулонефрита путем активации системы комплемента in situ. Кроме стрептококковых антигенов, в развитии заболевания могут иметь значение и другие бактериальные антигены, например стафилококка. Довольно часто причиной гломерулонефрита является вирусная инфекция. Описано много случаев возникновения гломерулонефрита после перенесенной аденовирусной, гриппозной, ECHO 9, Коксаки инфекции, ветряной оспы, эпидемического паротита и др. В последние годы доказана этиологическая роль HBs-антигена, который с высокой частотой обнаруживается в сыворотке крови и на базальных мембранах почечных клубочков. Важное значение в развитии гломерулонефрита придается факторам небактериальной природы, в частности, воздействию холода, травме, чрезмерной инсоляции, повторному введению вакцин и сывороток, химических веществ и лекарственных препаратов (пенициллин, d-пеницилламин и др.). Патогенез Возникновение первичного гломерулонефрита есть результат взаимодействия средовых и генетических факторов. Многочисленными исследованиями с использованием современных методов иммуногенетики показано преобладание антигенов В8, В12, В35, DR2 системы HLA у больных первичным гломерулонефритом, что подтверждает наследственную предрасположенность к развитию заболевания. С указанными HLA-антигенами связывают повышенную готовность к образованию иммунных комплексов антиген—антитело, недостаточную функциональную активность макрофагов в отношении их элиминации, а также определенную чувствительность к нефритогенным штаммам стрептококка. Успехи в области фундаментальной иммунологии позволили понять многие звенья патогенеза гломерулонефрита. В настоящее время общепризнано, что в основе заболевания лежат иммунопатологические реакции. Патогенез гломерулонефрита довольно сложен. В его развитии выделяют два основных патогенетических механизма: иммунокомплексный и аутоиммунный, которые имеют существенное различие на этапе инициации патологического процесса, но эффекторное (повреждающее) звено является общим. У 80-85% больных гломерулонефритом заболевание обусловлено иммунокомплексным механизмом с образованием иммунных комплексов антиген—антитело. К иммунокомплексным гломерулонефритам относится постстрептококковый гломерулонефрит, гломерулонефрит при малярии, гломерулонефрит, обусловленный вирусом гепатита В, идиопатические гломерулонефриты (мембранознопролиферативный I и II типов, IgA-нефропатия и др.). Патогенез иммунокомплексного гломерулонефрита можно представить следующим образом. В качестве этиологического агента выступают экзогенные (бактериальные, вирусные, химические и др.) или эндогенные (ДНК и др.) антигены, которые при взаимодействии с иммунной системой организма подвергаются первичному распознаванию макрофагами. В результате этого взаимодействия макрофаги осуществляют частичный фагоцитоз антигенов и функцию неспецифического иммуноло гического распознавания. Макрофаги передают специфический сигнал Т-лимфоцитам-хелперам, которые обеспечивают пролиферацию и дифференцировку В-лимфоцитов в плазматические клетки, активно синтезирующие антитела. Синтезируемые антитела высокоспецифичны в отношении антигенов, вызвавших первичный иммунный ответ, и направлены на их обезвреживание путем образования иммунных комплексов антиген—антитело. 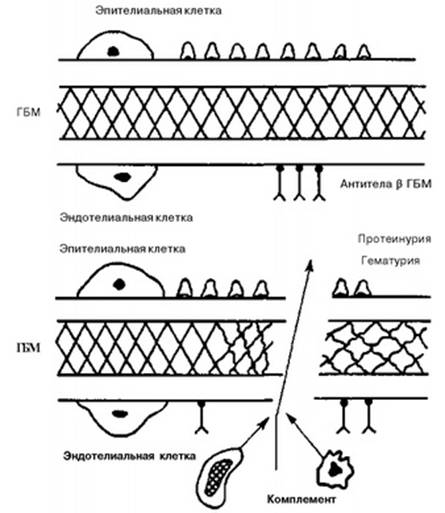 Иммунные комплексы могут первоначально формироваться в гемо-циркуляторном русле и затем откладываются на стенках капилляров различных органов, в том числе и гломерулярных капилляров. Нефритогенный потенциал и отложение циркулирующих иммунных комплексов на базальных мембранах гломерул предопределяются их размерами (малые комплексы более патогенны и легче откладываются), избытком антигена в их составе, а также электрическим зарядом как базальной мембраны, так и самих иммунных комплексов. При некоторых клинико-морфологических формах гломерулонефрита (нефрит Хейманна и др.) иммунные комплексы формируются локально (in situ), непосредственно в клубочках. В качестве «ловушки» для циркулирующих антител могут выступать фиксированные собственные антигены (гликопротеидные gp-330 и gp-90 антигены) и «встроенные» антигены (ДНК, чужеродные катионизированные иммуноглобулины, бак териальные антигены, эндострептолизин и др.). В результате формирования локальных иммунных комплексов образуются субэпителиальные, субэндотелиальные и мезангиальные гранулярные депозиты. В дальнейшем осажденные из сосудистого русла и сформированные in situ иммунные комплексы вызывают активацию триггерных гуморальных систем: комплемента, калликреин-кининовой, гемокоагуляции и фибринолиза, ренин-ангиотензиновой и др. Активация системы комплемента приводит к гипокомплементемии, выделению хемо-таксических факторов СЗа и С5а, привлекающих в очаг повреждения лимфоциты, моноциты, полиморфонуклеары и др., образованию мембрано-атакующего комплекса С5-9, который деполимеризирует белки базальной мембраны гломерул и вызывает ее лизис с ограниченными дефектами. Кроме того, в результате первичной альтерации компонентами комплемента возникает активация калликреина (фактором Хагемана ХПа) с последующим образованием активных кининов, которые вызывают контракцию эндотелиальных клеток, увеличивают проницаемость гломерулярной базальной мембраны и повышают протеинурию. Одновременно активированный фактор Хагемана (ХПа) инициирует систему коагуляции и фибринолиза, что вызывает внутрисосудистую коагуляцию, образование микротромбов в капиллярах гломерул и отложение фибрина. Важным звеном патогенетической цепочки гиперкоагуляции являются лейкоциты, особенно моноциты. Они, попадая в область иммунопатологического повреждения гломерулы, способствуют резкому возрастанию локальной коагуляционной активности. Лизосомные энзимы моноцитов (протеазы, коллагеназы, гидролазы) вместе с литическим фактором комплемента деполимеризуют белки базальных мембран, нарушают их целостность, увеличивают проницаемость, способствуют образованию в них трещин. Эти механизмы облегчают образование интрагломерулярных депозитов фибрина и фибриноида. Локальная активация гемокоагуляции в клубочках — один из важных факторов в патогенезе гломерулонефрита, так как усугубляет острые воспалительные изменения и способствует хронизации почечного процесса с постепенным разрушением клубочка. Инфильтрация клубочков и мезангия почек нейтрофильными лейкоцитами и макрофагами приводит к тому, что эти клетки под влиянием иммунных комплексов и компонентов комплемента выделяют значительное количество свободных кислородных радикалов (супероксидных анионов, перекиси водорода, гидроксильных радикалов), которые повреждают мембраны, инициируя перекисное окисление липидов и вы свобождение простагландинов. В развитии гломерулонефрита также участвуют медиаторы воспаления: лимфокины, продуцируемые Т-лимфоцитами (принимают участие в повреждении гломерул); простагландины (обуславливают снижение функций почек); лейкотриены (стимулируют пролиферацию эпителиальных клеток); тромбоксаны (вызывают агрегацию тромбоцитов) и другие медиаторы воспаления. Окончательное повреждение клубочков и возникновение гломерулонефрита в конечном итоге есть результат совместного воздействия клеточных реакций (Т-лимфоцитов, макрофагов, мезангиальных клеток) и гуморальных компонентов, таких как иммунные комплексы, триггерные системы (комплемента и др.) и медиаторы воспаления. Характер ной чертой иммунокомплексного гломерулонефрита является наличие гранулярных депозитов, располагающихся вдоль базальной мембраны клубочков и содержащих различные классы иммуноглобулинов, компоненты комплемента, фибрин. Развитие гломерулонефрита по аутоиммунному механизму отлича ется от описанного выше только инициальным звеном, поскольку эффекторное звено патогенеза является общим для обоих механизмов. Развитие гломерулонефрита по аутоиммунному механизму связано: а) с наличием общих перекрестно-реагирующих антигенов микроорганизмов (бактерий, вирусов и др.) и антигенов базальной мембраны клубочков; б) с интенсивным появлением на базальной мембране гломерул антигенов главного комплекса гистосовместимости (в частности, HLA-DR2 и DR3 антигенов); в) с повреждением почечной ткани и освобождением скрытых антигенов или детерминант гломерулярной базальной мембраны, к которым нет толерантности. Необходимым условием для возникновения и течения гломерулонефрита по аутоиммунному механизму является своеобразный иммунодефицит, при котором понижены функции Т-лимфоцитов-супрессоров, обеспечивающие толерантность к собственным антигенам и ограничивающие иммунный ответ. Таким образом, на фоне нарушенной функции Т-лимфоцитов-супрессоров в ответ на внедрение и повреждение гломерулярной базальной мембраны (ГБМ) происходит генерация Т-лимфоцитов-эффекторов, обладающих выраженной цитотоксической активностью, и активация В-лимфоцитов, которые синтезируют аутоантитела к ГБМ. В дальнейшем в развитии аутоиммунного гломерулонефрита принимают участие все эффекторные факторы воспаления, указанные в патогенезе иммунокомплексного гломерулонефрита. Морфология почки при гломерулонефрите Почки при остром гломерулонефрите Макроскопия:Увеличены,набухшие.Пирамиды темно-красные,кора серовато-коричневого цвета с мелким красным крапом на поверхности и разрезе или с сероватыми полупрозрачными точками(пестрая почка). 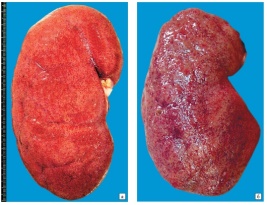  Клубочки увеличены в размерах, с повышенным в них числом клеток (феномен гиперклеточности) за счет инфильтрации нейтрофильными лейкоцитами, пролиферации эндотелиоцитов и в меньшей степени - мезангиальных клеток. Полнокровие, диапедезные кровоизлияния, отек стромы, белковая дистрофия эпителия канальцев. Окраска гематоксилином и эозином. |
