Курсовая работа на тему «Расчет основных параметров горения и тушения пожара газового фонтана» Нефтяная и газовая промышленность. Теоретический расчет основных параметров горения и тушения пожар. Горение газов
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
3. расчёт расхода воды, требуемого для прекращения горения газового фонтанаПроцесс прекращения горения газовых фонтанов водой включает нескольковидов воздействия этого огнетушащего вещества. Главным из них можно считать охлаждение зоны горения. Кроме того, при использовании воды происходит разбавление зоны горения её парами, экранирование газа от факела пламени и механическое воздействие струи воды с целью его отрыва. Согласно тепловой теории потухания прекращение горения наступает в результате понижения температуры пламени до некоторой критической величины, называемой температурой потухания Тпот. Это достигается путем увеличения интенсивности теплоотвода из зоны горения и (или) уменьшением интенсивности тепловыделения за счет снижения скорости реакции горения. В результате введения воды в зону горения часть тепла химической реакции начинает затрачиваться на нагрев, испарение воды и нагрев образующегося пара. Учитывая высокие теплоёмкости воды и водяного пара, а также теплоту парообразования, всё это приводит к снижению температуры зоны горения. В то же время появление водяного пара уменьшает концентрацию молекул горючего и окислителя в зоне горения, т.е. приводит к ее разбавлению и снижению скорости реакции горения, а значит и тепловыделения. В результате снижается нормальная скорость распространения пламени в газовой струе. Это приводит к нарушению устойчивости факела, что в ряде случаев сопровождается срывом пламени. Теплоотвод от факела пламени горящего фонтана газов основном происходит за счёт лучистой составляющей. В связи с этим температура пламени определяться из разности интенсивностей выделения тепла в зоне горения qп и его отвода излучением qлуч: Δq = qп + qлуч, (5) Величину qлуч можно выразить через qп, обозначив её долю в тепловом балансе факела пламени как ηлуч: Δq = qп - ηлуч qп, (6) или Δq = (1 - ηлуч) qп. (7) Интенсивность теплоотвода из зоны горения, обеспечивающего охлаждение зоны горения до температуры потухания Тпот., также выразим в виде доли от qп, обозначив её ηт. Согласно тепловой теории, адиабатическая температура потухания кинетического пламени может быть легко найдена, если известна адиабатическая температура пламени. Для углеводородных горючих Тпот, как правило, составляет около 1000оС. Однако горение реальных газовых фонтанов является диффузионным, т.е. характеристики процесса определяются главным образом скоростью взаимной диффузии горючего и окислителя, а не скоростью химических реакций между ними. Значения энергии активации реакции горения в таких условиях фактически не играют роли. В таком случае за температуру потухания можно принять температуру горения смеси, в которой содержание горючего равно нижнему концентрационному пределу воспламенения 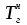 . .Допустим, что максимальная температура факела пламени равна температуре горения смеси стехиометрического состава 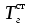 . Тогда количество тепла, которое необходимо отвести от пламени, будет пропорционально разности ΔТ = . Тогда количество тепла, которое необходимо отвести от пламени, будет пропорционально разности ΔТ = 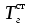 - - 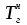 . Отношение ΔТ/ . Отношение ΔТ/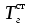 фактически составит величину ηт. фактически составит величину ηт.Таким образом, требуемая для потухания пламени интенсивность теплоотвода  с учетом выражения (7) будет равна: с учетом выражения (7) будет равна: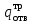 = (1-ηл) ηт qп. (8) = (1-ηл) ηт qп. (8)Интенсивность тепловыделения рассчитывается по формуле qп = Vг 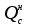 β, (9) β, (9)где: Vг -секундный расход горючего газа, м3/с; 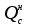 - низшая теплота сгорания газа, кДж/м3; - низшая теплота сгорания газа, кДж/м3;β - коэффициент полноты сгорания. Коэффициент ηл зависит от состава горючего газа. В общем случае для многокомпонентного газа его значение можно оценить из выражения: ηл = 0,048 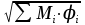 , (10) , (10)где Mi и φi - молярная масса и объемная доля i-го компонента горючего газа в смеси. Действительную температуру горения 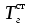 находят по формуле: находят по формуле:Тгст = Т0 + Qнс, об (1- ηл) / (νCO2 CP,CO2 + νH2O CP,H2O + νN2 CP,N2 + νSO2 CP,SO2) (11) где 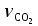 , , 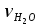 , , 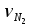 , ν SO2- число молей диоксида углерода, воды, азота и диоксида серы, найденные из стехиометрического уравнения реакции горения, м3; , ν SO2- число молей диоксида углерода, воды, азота и диоксида серы, найденные из стехиометрического уравнения реакции горения, м3;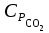 , ,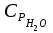 , ,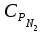 , CP,SO2 - удельная изобарная теплоемкость диоксида углерода, водяного пара, азота и диоксида серы, кДж/(м3 град). , CP,SO2 - удельная изобарная теплоемкость диоксида углерода, водяного пара, азота и диоксида серы, кДж/(м3 град).При концентрации горючего, равной НКПР, температура горения 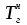 будет равна: будет равна:Тгн = Т0 + Qнс, об (1- ηл) / (νCO2 CP,CO2 + νH2O CP,H2O + νN2 CP,N2 + νSO2 CP,SO2 +Δν CP,в) (12) где ΔVв = 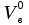 (α - 1)/0,02445 - избыток воздуха, м3; (α - 1)/0,02445 - избыток воздуха, м3;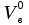 - теоретический объем воздуха, необходимый для обеспечения горения, м3; - теоретический объем воздуха, необходимый для обеспечения горения, м3;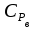 - удельная теплоемкость воздуха, кДж/(м3 град). - удельная теплоемкость воздуха, кДж/(м3 град).Здесь 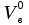 - теоретический объем воздуха, необходимый для обеспечения горения, м3 ; - теоретический объем воздуха, необходимый для обеспечения горения, м3 ;α - коэффициент избытка воздуха; ,02445 - объем, занимаемый 1 моль воздуха при 298 К. Коэффициент избытка воздуха на нижнем концентрационном пределе воспламенения составит: α = (100 - НКПР) / (НКПР×Vв0 ) (13) С использованием формул (11-13) находится коэффициент ηт как отношение ( 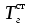 - -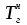 )/ )/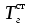 . Коэффициент полноты сгорания β для газов можно принять равным 0,9. Низшую теплоту сгорания находят по таблицам или рассчитывают по известным формулам. . Коэффициент полноты сгорания β для газов можно принять равным 0,9. Низшую теплоту сгорания находят по таблицам или рассчитывают по известным формулам.Количество тепла, которое способна отнять вода из зоны горения при полном ее испарении и нагреве водяного пара до температуры потухания пламени, рассчитывается по формуле 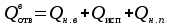 , (14) , (14)где Qн.в - количество тепла, затрачиваемое на нагрев воды до температуры кипения, кДж; Qисп - количество тепла, затрачиваемое на испарение воды, кДж; Qн.п - количество тепла, затрачиваемое на нагрев пара от 100 оС до температуры потухания пламени, кДж. После подстановки в (14) массы воды и водяного пара (mв, mп) средних удельных теплоёмкостей воды и водяного пара (СРв, СРп), удельной теплоты парообразования воды Lв, получим: 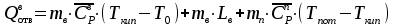 , (15) , (15)Если в качестве исходных данных в выражение(15) подставить mв=mп=1 кг, Ткип = 373 К, Т0 = 293 К, Lв = 2256 кДж/кг, 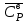 =4,18 кДж/(кг град), =4,18 кДж/(кг град),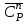 =2,2 кДж/(кг град) в диапазоне температур 373-1373 К, получим:=4570 кДж/кг. =2,2 кДж/(кг град) в диапазоне температур 373-1373 К, получим:=4570 кДж/кг.В зависимости от температуры пламенного горения, удельная величина теплоотъёма может составить от 4400 до 5000 кДж на кг поданной в зону горения воды, при условии её полного испарения и нагрева водяного пара до Тпот. При расходе воды nв (л/с) интенсивность отвода тепла (в кДж/с) от факела пламени при указанных условиях будет равна: qотв = 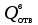 nв. (16) nв. (16)Согласно тепловой теории, горение прекратиться, если фактическая интенсивность теплоотвода будет больше требуемой для прекращения этого процесса величины: 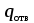 > > 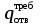 , (17) , (17)С учётом выражений (8, 9, 16, 17), необходимый для прекращения горения расход воды рассчитывается по формуле: nв >= 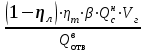 . (18) . (18)В действительности расход воды, обеспечивающий тушение газовых факелов, может быть как выше, так и ниже значения nв, найденного таким способом. Это зависит от скорости истечения газовой струи. Чем ниже скорость истечения, тем меньше турбулентность потока газа и, соответственно, меньше степень дробления воды. В результате этого крупные капли выпадают из зоны горения, не все капли успевают испариться и не весь образовавшийся пар успевает нагреться до Тпот, т.е. фактическое значение 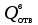 будет меньше расчетного. Соответственно фактический расход воды может быть больше расчетного. С увеличением скорости истечения газа степень дробления воды возрастает. Соответственно увеличивается и её полезное использование. Кроме того, с увеличением скорости истечения газа все больше возрастает вклад аэродинамического фактора, способствующего нарушению устойчивости факела. Поэтому при большом дебите газового фонтана фактический расход воды, приводящий к прекращению горения, может быть меньше теоретического. будет меньше расчетного. Соответственно фактический расход воды может быть больше расчетного. С увеличением скорости истечения газа степень дробления воды возрастает. Соответственно увеличивается и её полезное использование. Кроме того, с увеличением скорости истечения газа все больше возрастает вклад аэродинамического фактора, способствующего нарушению устойчивости факела. Поэтому при большом дебите газового фонтана фактический расход воды, приводящий к прекращению горения, может быть меньше теоретического.4. Задание на курсовую работу (вариант 5603) Используем характеристики компактного газового фонтана состава: Метан СН4 84% Этан С2Н6 6% Сероводород H2S(Г) 7% Кислород О2 3% истекающего через устье диаметром 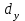 =250мм и имеющего высоту факела пламени =250мм и имеющего высоту факела пламени 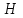 ф=13м, химический недожог в зоне горения составляет ф=13м, химический недожог в зоне горения составляет 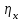 =0,08. =0,08.Таблица 3 Значения стандартных теплот образования и средних приведенных теплоемкостей (в интервале температур 298−2000 K) ряда веществ Вещество Химическая формула Стандартная мольная теплота образования 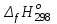 , кДж/мольИзобарная , кДж/мольИзобарная
Таблица 4 Значения нижнего концентрационного предела распространения пламени горючих газов
Необходимо рассчитать следующие параметры его горения и тушения: 1. дебит газового фонтана 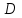 (млн. м3 /сутки); (млн. м3 /сутки);. адиабатическую температуру горения, 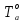 , К; , К;. действительную температуру горения, 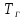 , К; , К;. построить зависимость удельной интенсивности лучистого теплового потока (облучённости)в зависимости от расстояния до устья скважины Е (кВт/м2)=f(L); 5. определить безопасные расстояния от устья скважины, обеспечивающие возможность выполнения боевой работы в зависимости от вида экипировки; 6. рассчитать расход воды, необходимый для тушения горящего фонтана. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
