Курсовая работа на тему «Расчет основных параметров горения и тушения пожара газового фонтана» Нефтяная и газовая промышленность. Теоретический расчет основных параметров горения и тушения пожар. Горение газов
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
|
Оглавление Введение 1. Горение газов 1.1 Общие закономерности кинетического режима горения .2 Влияние различных факторов на скорость распространения пламени 1.3 Диффузионное горение газов 1.4 Особенности горения газовых струй. Условия стабилизации пламени .5 Оценка дебита горящих газовых фонтанов 2. Методы тушения пожаров газовых фонтанов 2.1 Использование импульсных струй жидкости высокой скорости для тушения газовых факелов .2 Современные способы тушения газовых фонтанов .3 Перспективные направления разработки устройств для тушения газовых фонтанов .4 Схема проведения эксперимента .5 Эксперименты по тушению газового факела при помощи ИВ 3. Расчет расхода воды, требуемого для прекращения горения газового фонтана 4. Исходные данные для расчета . Расчет основных параметров горения и тушения пожара газового фонтана Выводы Список литературы ВведениеУвеличивающаяся с каждым годом добыча нефти и газа, ежегодный объем которой в настоящее время в стране составляет сотни млрд. м3, повышает вероятность аварийных ситуаций, которые могут сопровождаться крупными пожарами, большими материальными потерями, ухудшением экологической обстановки в зоне пожара и прилегающих районах, а нередко и человеческими жертвами. Это обусловливается отказом механизмов, нарушением технологии добычи, природными катастрофами и приводит к серьёзным авариям. Борьба с пожарами на нефтяных и газовых месторождениях, часто находящихся в труднодоступных районах, требует привлечения огромных материально-технических ресурсов и может длиться неделями. Затраты на тушение нередко составляют миллионы рублей. Вред, нанесённый окружающей среде в зоне пожара и прилегающих районах, точно оценить практически невозможно. Пожары на открыто фонтанирующих газонефтяных скважинах являются одними из наиболее сложных видов промышленных аварий. Некоторое представление о пожаре на фонтанирующей скважине можно получить по следующим данным: дебит мощных газовых фонтанов может достигать 10 - 20 миллионов кубометров в сутки, высота горящего факела - 80 - 100 м, а интенсивность тепловыделения в факеле - несколько миллионов киловатт. Целью курсовой работы “Теоретический расчет основных параметров горения и тушения пожаров газовых фонтанов” является выработка навыков использования теоретических знаний, полученных при изучении дисциплины «Физико-химические основы развития и тушения пожаров» при проведении расчетов параметров пожаров и расхода огнетушащих веществ. В результате выполнения курсовой работы студент должен знать и уметь оценивать расчетными методами: режим истечения газового фонтана; параметры пожара газового фонтана; адиабатическую и действительную температуры пламени; интенсивность облучённости от факела пламени в зависимости от расстояния до устья скважины; расход воды на тушение пожара газового фонтана. 1. Горение газовПри изучении дисциплины «Теория горения и взрыва» были рассмотрены различные режимы горения газов: кинетический и диффузионный, ламинарный и турбулентный. Кинетическое горение возможно только в предварительно перемешанных смесях горючего и окислителя. Во всех остальных случаях горение будет протекать в диффузионном режиме. При возрастании высоты пламени (обычно выше 30 см) ламинарное пламя практически всегда приобретает турбулентный характер. 1.1 Общие закономерности кинетического режима горенияЕсли с помощью оптического прибора рассмотреть кинетическое пламя в неподвижной горючей смеси, то можно увидеть следующую картину (рис. 1). Справа находятся нагретые до высокой температуры продукты горения (Тпг), слева − холодная с температурой (Т0) исходная горючая смесь, а между ними − ярко светящаяся полоска − фронт пламени с толщиной (). Горючий компонент во фронте пламени сгорает, и в продуктах горения его концентрация практически равна нулю. Естественно, температура продуктов горения, равная температуре зоны горения (Тг), больше температуры исходной смеси (Т0) Тпг = Тг >> Т0. Поскольку теплота передается от горячего тела к холодному, в сторону исходной смеси будет идти тепловой поток (q), нагревая прилегающий к ней слой, так называемую зону подогрева. Передача теплоты от нее осуществляется теплопроводностью. 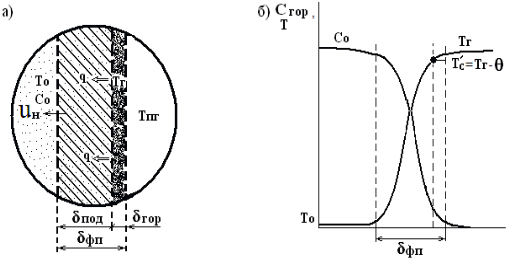 Рисунок. 1. Схема фронта (а) и изменение температуры и концентрации горючего (б) в кинетическом пламени: δПОД - зона подогрева; δГОР - зона горения; δФП - фронт пламени; uн - нормальная скорость распространения пламени Смесь в этом слое воспламенится при достижении температуры самовоспламенения (Тс). Зона горения переместится в сторону исходной смеси,двигаясь от слоя к слою. Фронт пламени будет непрерывно перемещаться до самой границы горючей смеси. Такое распространение пламени называют нормальным или дефлаграционным горением. Нормальное или дефлаграционное горение − это распространение пламени по однородной горючей среде, при котором фронт пламени движется вследствие ее послойного разогрева по механизму теплопроводности от продуктов горения. Толщина фронта пламени (фП), как правило, не превышает десятых долей миллиметра. Поэтому его обычно принимают за поверхность, отделяющую исходную смесь от продуктов горения. Как показали исследования, своим свечением фронт пламени обязан многоатомным радикалам: С=С:, :CH, .HCO и др. Есть в пламени и ионы, концентрация которых достигает 1016− 1017 м−3. Возникновение ионов в пламени имеет химическую и термическую природу. 1.2 Влияние различных факторов на скорость распространения пламени Нормальная скорость распространения пламени (uн) зависит от теплофизических свойств газовоздушной смеси. Но в еще большей степени скорость распространения зависит от ее физико-химических свойств − скорости горения V, и температуры в зоне реакции горения, ТГ: 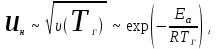 (1) (1)т.е. uн пропорциональна скорости реакции окисления (V) и находится в экспоненциальной зависимости от обратной температуры зоны горения (Тг). Определяющим параметром, безусловно, будет скорость реакции. Запишем уравнение скорости химической реакции горения: 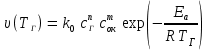 , (2) , (2)где k0 - предэкспоненциальный множитель из уравнения Аррениуса, Сг, Сок - концентрации горючего и окислителя, m, n - порядки реакции соответственно по горючему и окислителю, Еа - энергия активации химической реакции. Рассмотрим, как будет меняться скорость реакций окисления для смесей с разным соотношением горючего и окислителя (рис. 2). Из графика видно, что для смеси стехиометрического состава (коэффициент избытка воздуха =1) скорость реакции окисления максимальна. При увеличении концентрации горючего в смеси выше стехиометрического количества, когда становится < 1 (кислород находится в недостатке), горючее сгорает не полностью. В этом случае меньше выделится теплоты реакции горения Qгор и произойдёт снижение Tг. Скорость реакции окисления по сравнению со стехиометрическим составом смеси уменьшится, причем как из-за снижения концентрации окислителя О2, так и температуры зоны горения. То есть при последовательном снижении (что эквивалентно увеличению концентрации СГ в смеси) скорость реакции окисления и температуры зоны горения Tг будут последовательно снижаться. На графике при CГ > СГстех кривая становится резко нисходящей. Снижение же скорости реакции окисления при > 1 объясняется уменьшением тепловыделения в зоне горения в связи с более низкой концентрацией в ней горючего. 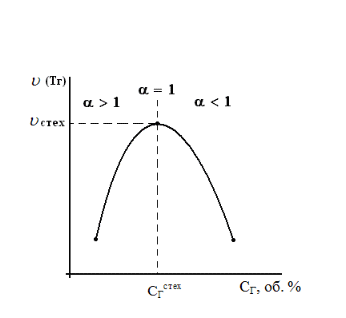 Рисунок 2. Зависимость скорости горения от концентрации горючего в смеси Именно такая, как на рис.2, зависимость скорости реакции горения от концентрации горючего компонента в исходной смеси предопределяет параболический вид зависимости её других параметров процесса горения от состава смеси: температуры самовоспламенения и минимальной энергии зажигания, концентрационных пределов распространения пламени. Вид параболы имеет также и зависимость нормальной скорости распространения пламени uн от концентрации горючего в смеси СГ. На рис. 3 приведены такие зависимости для случая горения воздушно-пропановой смеси при различных значениях начальной температуры. 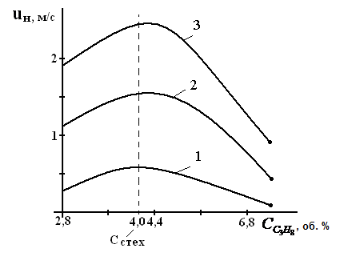 Рисунок 3. Зависимость скорости распространения пламени от концентрации пропана в воздухе при начальной температуре 311 K (1); 644 K (2); 811 K (3) Согласно описанным выше представлениям, максимальная скорость распространения пламени (uнмах) должна соответствовать стехиометрической концентрации горючего. Однако экспериментально найденные её значения несколько сдвинуты в сторону богатых по содержанию горючих смесей. С увеличением начальной температуры смеси скорость распространения пламени должна повышаться, что и наблюдается на практике. Например, для воздушной смеси паров бензина и керосина она имеет вид, приведенный на рис. 4. 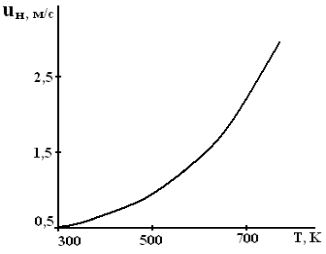 Рисунок 4. Зависимость скорости распространения пламени от начальной температуры воздушной смеси паров бензина и керосина с воздухом Для различных веществ uн зависит от их химической природы и колеблется в довольно широких пределах (табл. 1). Для большинства смесей углеводородных топлив с воздухом uн < 1 м/с. При введении в горючую смесь избыточного воздуха или азота температура горения заметно снижается. Таблица 1. Нормальная скорость распространения пламени для некоторых горючих смесей
Введение в горючую смесь инертных и нейтральных газов: азота N2, аргона Аr, диоксида углерода СО2 разбавляет ее и тем самым снижает как скорость реакции окисления, так и скорость распространения пламени. Это хорошо видно из зависимостей, приведённых на рис. 5. При этом при определённой (флегматизирующей) концентрации разбавителей горение вообще прекращается. Наиболее сильное влияние оказывает введение хладонов, так как они обладают ещё и ингибирующим действием на реакцию горения. Как видно из рис. 5, введение в горючую смесь хладона (114В2) в 4 - 10 раз эффективнее, чем нейтральных газов - разбавителей. 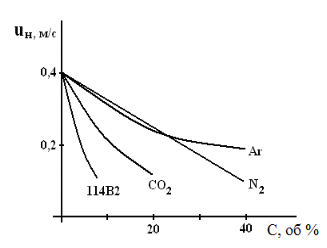 Рисунок 5. Влияние концентрации разбавителей и хладона 114В2 на скорость распространения пламени в пропано-воздушной смеси ( = 1.15) Флегматизирующая способность газов - разбавителей зависит от их теплофизических свойств, и в частности, от их теплопроводности и теплоёмкости. |
