магний. курс раб из Реферат. Характеристика комплексонометрии как метода количественного титриметрического анализа 4
 Скачать 263.61 Kb. Скачать 263.61 Kb.
|
ОГЛАВЛЕНИЕВВЕДЕНИЕ 2 ХАРАКТЕРИСТИКА КОМПЛЕКСОНОМЕТРИИ КАК МЕТОДА КОЛИЧЕСТВЕННОГО ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА 4 ЖЕСТКОСТЬ ВОДЫ И ЕЕ КЛАССИФИКАЦИЯ 8 ИСПОЛЬЗОВАНИЕ КОМПЛЕКСОНОМЕТРИИ ПРИ ОПРЕДЕЛЕНИИ ЖЕСТКОСТИ ВОДЫ 10 ЗАКЛЮЧЕНИЕ 16 СПИСОК ЛИТЕРАТУРЫ 17 ВВЕДЕНИЕВода – один из самых ценных ресурсов. Человечество использует воду ежедневно для приготовления пищи, бытовых, сельскохозяйственных и технических целей. Несмотря на то, что 75% поверхности Земли покрыто водой, однако только 0,3% ее объема пригодно для употребления. Причины невозможности использования всего мирового запаса воды кроются в ее минеральном составе, который отражает результат взаимодействия воды как физической фазы и среды жизни с другими фазами (средами). Минерализация воды имеет важнейшее значение при использовании ее в повседневной жизни. Например, если в воде находятся большое количество ионов кальция и магния, то воду называют жесткой, что затрудняет ее использование в повседневной жизни: при взаимодействии с мылом образуются нерастворимые кальциевые и магниевые соли жирных кислот, что затрудняется образование пены при стирке белья или мытье рук. Жесткость воды пагубно сказывается на трубопроводах тепловых сетей, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты; при приготовлении пищи повышается риск возникновения мочекаменной болезни, так как ионы кальция и магния образуют нерастворимые комплексные соли с органическими кислотами цикла трикарбоновых кислот (например оксалаты и ураты кальция); в водопроводных трубах и радиаторах отопления образуются известняковые отложения (что уменьшает поперечный просвет труб системы отопления и ухудшает ее теплообменную функцию). Цель данной работы – систематический анализ и обобщение литературных данных по вопросу использования метода комплексонометрии в анализе жесткости воды. Для выполнения поставленной цели необходимо решить следующие задачи: 1. Охарактеризовать комплексонометрию как метод химического анализа; 2. Дать определение понятию «жесткость воды», привести классификацию видам жесткости; 3. Рассмотреть использование метода комплексонометрии в анализе воды. ХАРАКТЕРИСТИКА КОМПЛЕКСОНОМЕТРИИ КАК МЕТОДА КОЛИЧЕСТВЕННОГО ТИТРИМЕТРИЧЕСКОГО АНАЛИЗАКомплексонометрия – метод титриметрического анализа, основанный на свойстве катионов металлов количественно вступать в реакцию с органическими реагентами-комплексонами с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений. Чаще всего в качестве титрованного раствора выступает раствор трилона Б - динатриевая соль этилендиаминтетрауксусной кислоты, сокращенно ТrБ, или эдетат натрия (рисунок 1). 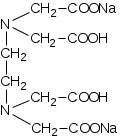 Рисунок 1 – Формула трилона Б Трилон Б легко образует прочные внутрикомплексные соли со многими катионами. Соли образуются, с одной стороны, за счет замещения металлом водорода карбоксильных групп, с другой – за счет образования координационных связей между ионами металла и атомами азота (рисунок 2). 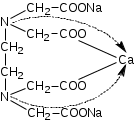 Рисунок 2 – Внутрикомплексная соль трилона Б с катионом кальция При комплексонометрическом титровании к раствору, содержащему определяемые ионы, прибавляют небольшое количество нужного индикатора. Образуется сравнительно устойчивое, хорошо растворимое в воде окрашенное соединение: Me2+ + H2Ind → Melnd + 2H+ При титровании натрия эдетатом сначала образуется комплекс со свободными ионами определяемого металла: 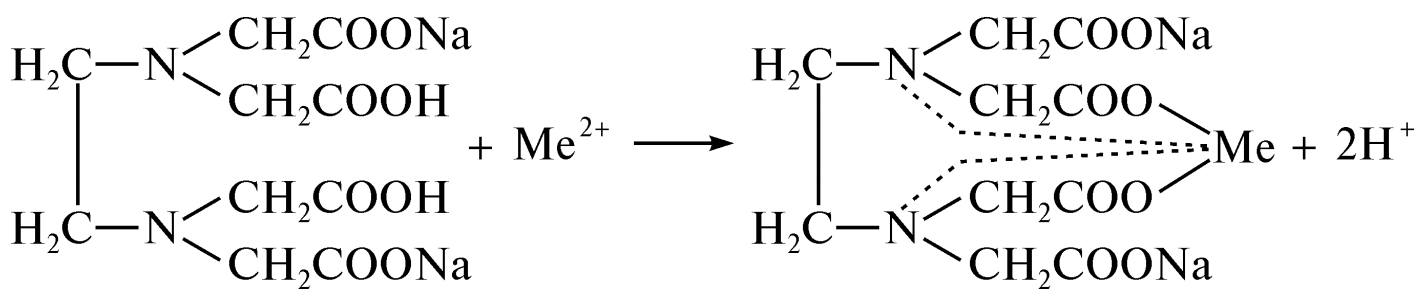 Когда все свободные ионы металла оттитрованы, комплекс индикатора с металлом разрушается. В момент эквивалентности происходит полное разрушение окрашенного металлоиндикаторного комплекса, индикатор освобождается и раствор приобретает цвет свободного индикатора: 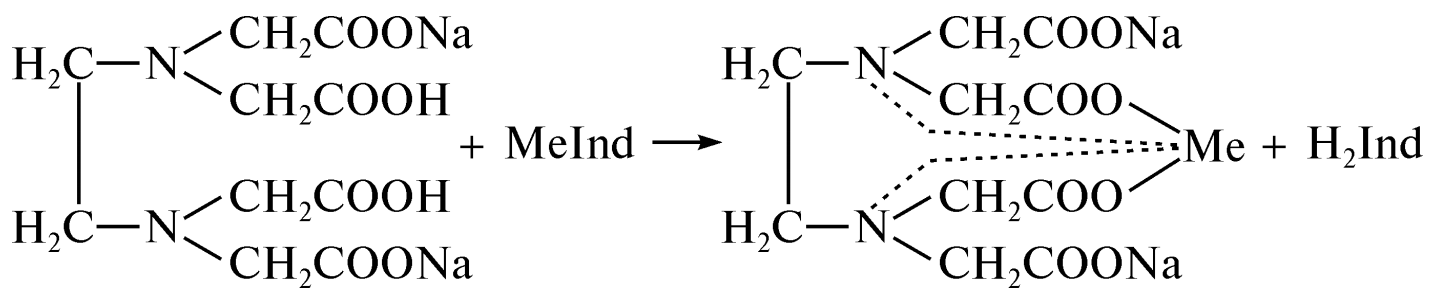 Для определения конечной точки титрования служат индикаторы – вещества, образующие окрашенные соединения с ионами кальция и магния или с одним из этих катионов. В качестве индикаторов в комплексонометрии используют металлоиндикаторы - органические красители (сокращенно НInd или Н2Ind), имеющие различную окраску в свободном виде и виде комплекса с металлом, который является менее прочным, чем комплекс ТrБ с металлом. Устойчивость комплекса и действие металлоинднкаторов существенно зависит от рН среды. Поэтому комплексонометрическое титрование ведут в заданном интервале рН, используя различные буферные растворы: рН 9,5-10 создается аммиачным буфером. Индикаторы: кислотный хром черный специальный (или эриохром черный Т), кислотный хромовый темно-синий (или хромовый темно-синий), переход окраски от красно-фиолетовой или вишнево-красной к синей или сине-фиолетовой. Титруют: Zn2+,Ca2+, Mg2+ pH 12-14 создается 30% раствором натрия гидроксида вблизи точки эквивалентности. Индикатор: кальконкарбоновая кислота, переход окраски от красновато-сиреневой к голубой. Титруют Са2+. Индикаторы обладают различной чувствительностью, т.е. их окрашенные соединения с ионами кальция и магния возникают при различных, но определенных для данного индикатора и для выбранных условий концентрациях этих ионов (таблица). Например, эриохром черный Т образует окрашенное соединение с кальцием при концентрации этого иона около 7 мкг – экв/л; по отношению к ионам магния этот индикатор более чувствителен, и окраска возникает уже при 4 – 5 мкг-экв/л. Методом комплексонометрии можно определить катионы магния, кальция, цинка, алюминия, бария, свинца и многие другие – более 40 различных катионов. Этот метод широко применяется для определения жесткости воды. ЖЕСТКОСТЬ ВОДЫ И ЕЕ КЛАССИФИКАЦИЯЖесткость воды – это качественная и количественная химическая характеристика воды, обусловленная присутствием растворимых и малорастворимых соединений кальция и магния (рисунок 3). 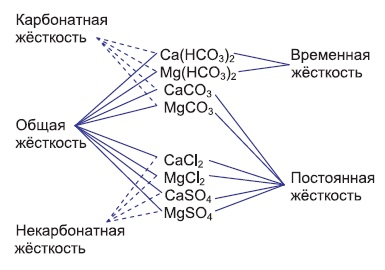 Рисунок 3 – Виды жесткости воды Суммарная жесткость воды, то есть общее содержание растворимых солей кальция и магния, получила название «общей жесткости» Известны две разновидности жёсткости: Временная (гидрокарбонатная) жесткость воды – обусловлена присутствием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Mg(НСО3)2. Данный вид жесткости почти полностью устраняется при копчении воды, поэтому и получила название «временная» Бикарбонаты в этой ситуации подвергаются разрушению и превращению в карбонаты нерастворимого типа, которые образуют осадок на стенках поверхности нагрева (накипь). Са(НСО3)2 → СаСО3↓ + СО2 ↑ + Н2О Постоянная (карбонатно-некарбонатная) жёсткость воды - характеризуется присутствием в ней карбонатов, сульфатов, хлоридов, в редких ситуациях содержанием силикатов, нитратов и фосфатов кальция и магния. Данный вид жесткости не устраняется кипячением. С химической точки зрения жёсткость воды определяется, как суммарная концентрация миллимолей частиц кальция и магния, содержащихся в 1 литре воды (ммоль/л). Природная вода по показателям общей жёсткости делится на следующие категории: воды с низкой жёсткостью (мягкие) - жёсткость 0,5 - 1,0 ммол/л; умеренно жесткие воды - 1,0 - 4,0 ммол/л; воды с высокой жёсткостью (жесткие) - более чем 4,0 ммол/л. Критерии качества воды международных стандартов не нормируют жёсткость воды – исключительно единичные значения катионов кальция (Са2+) и магния (Mg2+) в воде. ИСПОЛЬЗОВАНИЕ КОМПЛЕКСОНОМЕТРИИ ПРИ ОПРЕДЕЛЕНИИ ЖЕСТКОСТИ ВОДЫОпределение жесткости питьевой воды проводят в соответствии с ГОСТ 31954-2012. Согласно ГОСТ 31865-2012. «Вода. Единица жесткости» в Российской Федерации единицей меры жёсткости воды является градус жёсткости (°Ж) - концентрация щелочноземельного элемента, численно равная 1/2 его моля в мг/дм3 (г/м3). Анализ состоит из нескольких последовательных этапов: отбор проб; подбор необходимого оборудования, приготовление титрованных растворов, реактивов и индикаторов; установление поправочного коэффициента к концентрации раствора трилона Б; титрование аликвоты анализируемого образца воды: обработка и оформление результатов титриметрического анализа. Отбор проб является важной частью анализа, необходимым условием правильности получаемых результатов. Отобранные пробы должны отвечать требованиям репрезентативности. Пробу отбирают объемом не менее 400 см3. Срок хранения пробы воды - не более 24 ч. Для увеличения срока хранения пробы и для предотвращения осаждения из воды карбонатов кальция (что характерно для подземных или бутилированных вод) пробу подкисляют кислотой хлористоводородной до pH < 2. Для расфасованной воды сроки и температурные условия хранения должны соответствовать требованиям, указанным в нормативной документации на готовую продукцию. Целью этих операций является сохранение содержания соответствующего компонента без изменения на время, необходимое для доставки и обработки пробы воды. К анализу следует приступать в кратчайший срок после отбора пробы. Сущность метода: метод основан на образовании при рН=10±0,01 прочного бесцветного комплексного соединения трилона Б с ионами кальция и магния. Чувствительность метода составляет 0,1 оЖ при титровании 0,05н раствором трилона Б. Ионы алюминия, кадмия, свинца, железа, кобальта, меди, марганца, олова и цинка влияют на установление конечной точки титрования и мешают определению. Для устранения мешающего влияния ионы меди, алюминия, железа, марганца, кобальта, никеля, кадмия, свинца, цинка переводят в сульфиды. Для уменьшения влияния марганца, железа, алюминия, меди добавляют от 5 до 10 капель раствора гидроксиламина гидрохлорида. Мутность (взвешенные вещества) пробы устраняют фильтрованием через мембранные фильтры с диаметром пор 0,45 мкм или бумажные обеззоленные фильтры «синяя лента». Ионы ортофосфата и карбоната могут осаждать кальций в условиях титрования. Определению могут также мешать некоторые органические вещества. Присутствие в воде Сl‑, SO42‑ и НСО3‑ не мешает определению общей жесткости. Если исследуемая проба была подкислена для консервации или проба имеет кислую среду, то в аликвоту пробы добавляют раствор гидроксида натрия до pH = 6 - 7. Если проба воды имеет сильнощелочную среду, то в аликвоту пробы добавляют раствор соляной кислоты до pH = 6 - 7. При необходимости раздельного определения кальция и магния сначала определяют суммарное их количество. Затем в отдельной пробе осаждают кальций в виде оксалата кальция и оттитровывают ионы магния. Кальциевую жесткость определяют по разности. Приготовление растворов и индикаторов Раствор трилона Б 25 ммоль/л готовят путем растворения в теплой бидистиллированной воде точной навески (9,31 г) высушенного при 80 °С в течение двух часов реактива-порошка, в мерной колбе вместимостью 1000 см3. Установку поправочного коэффициента к концентрации раствора трилона Б, приготовленного из навески, проводят по раствору сульфата магния. Раствор из ГСО состава трилона Б или стандарт-титра (фиксанала) трилона Б готовят в соответствии с инструкцией по применению, разбавляя его до требуемой концентрации. Раствор трилона Б пригоден для использования в течение 6 мес. Рекомендуется не реже одного раза в месяц проверять значение поправочного коэффициента. Стандартный раствор ионов магния 25 ммоль/дм3 готовят из ГСО состава водного раствора ионов магния или стандарт-титра (фиксанала) сульфата магния в соответствии с инструкцией по его применению, при необходимости разбавляя до требуемой концентрации. Аммиачный буферный раствор с рН 10±0,01: растворяют 10 г хлорида аммония в 100 см3бидистилированной воды в мерной колбе на 500 см3, добавляют 50 см3 25 % водного аммиака, тщательно перемешивают и доводят до метки бидистиллированной водой. Индикаторы кислотный хром темно – синий или эриохром черный Т: 0,5 г индикаторной смеси (индикатор+натрия хлорид) растворяют в 20 см3 аммиачного буферного раствора и доводят объем до 100 см3 этиловым спиртом. Установление коэффициента поправки к концентрации раствора трилона Б проводят путем титрования аликовоты стандартного раствора ионов магния раствором трилона Б до изменения окраски в эквивалентной точке от винно-красной (красно-фиолетовой) до синей (с зеленоватым оттенком) при использовании индикатора эриохром черный Т, а при использовании индикатора хромовый темно-синий кислотный до синей (сине-фиолетовой). Титрование проводят на фоне титрованной контрольной пробы. Значение коэффициента поправки должно быть равным 1,00 ± 0,03. Коэффициент поправки (К) к концентрации раствора трилона Б рассчитывают по формуле: 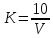 , где , гдеV - объем раствора трилона Б, израсходованный на титрование, 10 - объем раствора ионов магния Анализ проводят в виде двух определений, для чего пробу анализируемой воды делят на две части. Первую часть аликвоты помещают в коническую колбу, добавляют аммиачной буферной смеси, несколько капель индикатора и титруют окрашенную в розовый или фиолетово – розовый цвет жидкость раствором трилона Б. Титрование ведут медленно, по каплям, так как образование трилонатных комплексов происходит не мгновенно Вторую часть аликвоты также помещают в коническую колбу, добавляют буфер и индикатор и раствор трилона Б, которого берут на 0,5 см3 меньше, чем пошло на первое титрование, быстро и тщательно перемешивают и дотитровывают. В процессе обработки результатов жесткость анализируемой воды вычисляют по формуле: 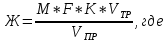 М - коэффициент пересчета, равный 2СТР (концентрация раствора трилона Б, моль/м3, как правило равняется 50); F - множитель разбавления исходной пробы воды при консервировании (как правило 1); K - коэффициент поправки к концентрации раствора трилона Б; VТР- объем раствора трилона Б, израсходованный на титрование, см3; VПР - объем пробы воды, взятой для анализа, см3. В случае раздельного выявления содержащихся в пробе частиц щелочноземельных элементов, жёсткость воды Ж, °Ж, выявляют формулой: 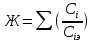 , где , гдеСi - содержание щелочноземельного компонента в анализируемой воде, мг/дм3 (г/м3); Ciэ - содержание щелочноземельного компонента, численно равного 1/2 его моля, выраженное в мг/дм3 (г/м3). За результат измерения принимают среднеарифметическое значение результатов двух определений. Приемлемость результатов определений оценивают исходя из условия: | Ж1 – Ж2 | ≤ r, где r - предел повторяемости; Ж1 и Ж2 - результаты определений по, Ж. Если расхождение между двумя результатами превышает установленное значение, то определение жесткости воды повторяют. ЗАКЛЮЧЕНИЕПо результатам анализа доступной литературы можно сделать следующие выводы: 1. Комплексонометрия один из распространенных титриметрических методов количественного определения ионов металлов; 2. Жесткость воды – это совокупность химических свойств воды, обусловленная содержанием в ней солей щелочноземельных металлов, преимущественно кальция и магния. 3. Определение содержания кальция и магния в воде комплексонометричеким методом один из основных путей определения жесткости воды согласно ГОСТ 31954-2012. СПИСОК ЛИТЕРАТУРЫСистемы очистки воды Waterman [Электронный ресурс]. – Режим доступа: http://water2you.ru/articles/khimicheskie-elementy-v-vode-i-pokazateli-kachestva-vod/zhestkost-vody/ Руководство по анализу воды. Питьевая и природная вода, почвенные вытяжки / [составители: Муравьёв Александр Григорьевич и др. ; под ред. А. Г. Муравьёва]. - Изд. 4-е, перераб. и доп. - Санкт-Петербург : Крисмас+, 2018. - 359 с. ГОСТ 31954-2012. Вода питьевая. Методы определения жесткости = Drinking water. Methods of hardness determination : межгосударственный стандарт : издание официальное : введен впервые : дата введения 2014-01-01 / Межгос. совет по стандартизации, метрологии и сертификации; Общество с ограниченной ответственностью «Протектор» совместно с Закрытым акционерным обществом «Центр исследования и контроля воды». - Изд. (июль 2018 г.) с Поправкой (ИУС 1-2017). - Москва : Стандартинформ, 2018. - V, 12 c. ГОСТ 31865-2012. Вода. Единица жесткости = Water. Unit of hardness : межгосударственный стандарт: изд.офиц. : введен впервые : введен 2014-01-01 / Межгос. совет по стандартизации, метрологии и сертификации. - Москва : Стандартинформ, 2013. - III, 3 с. ГОСТ Р 51232-98. Вода питьевая. Общие требования к организации и методам контроля качества = Drinking water. General requirements for organization and quality control methods : государственный стандарт Российской Федерации : издание официальное : введен впервые : введен 1999-07-01 / разработан "Технический комитет по стандартизации ТК 343 "Качество воды", [и др.]. - Переизд. Июнь 2000 г. - Москва : Изд-во стандартов, 2000. - III, 15 c. Харитонов, Ю. Я. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа : учебник / Ю. Я. Харитонов. - 6-е изд., испр. и доп. - М. : ГЭОТАР-Медиа, 2014. - 656 с. |
