Курсач (3). Характеристика рНметрії у виробництві кормового хлортетрацикліну
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
|
1.4.1Аерація культуральної рідини в стерильних умовах. Ступінь бактеріальної очищення повітря, що подається на аерацію культураль- ної рідини, у багатьох випадках повинен бути вищим, ніж для повітря, що подається в «чисті» приміщення на більш відповідальних стадіях фарма- цевтичного виробництва хлортетрацикліну. У повному обсязі схема отримання стерильного стиснутого повітря багатостадійна і включає в себе фільтр на вході в компресор, компресop, теплообмінники для охолодження і нагрівання повітря, передфільтр, фільтр тонкого очищення. Найбільш відповідальним вузлом в цьому переліку є фільтр тонкого очищення, який повинен задовольняти наступні вимоги: забезпечити гарантію 100% видалення бактерій з сухого і вологого повітря; мати досить тривалий термін служби (не менше 1 року); працювати при низькому вихідному перепаді тиску в продовженні тривалого періоду часу; мати властивості, що дозволяють періодично здійснювати стерилізацію паром; бути простим в обслуговуванні; мати надійне ущільнення фільтруючого елемента. По механізму фільтрації фільтри тонкого очищення підрозділяються на поверхневі і глибинні. Глибинні фільтри утримують відокремлювані частинки в усьому об’ємі фільтруючого матеріалу. Для їх виготовлення в даний час використовують волокнисті, порошкові і пресовані матеріали, а також пластик на паперовій або азбестовій основі. Імовірність затримки мікроорганізмів в таких фільтрах пов'язана з товщиною фільтруючого шару, внаслідок чого ступінь ефективності знаходиться в діапазоні 90-99%. Теоретично не можна видалити з повітряного потоку 100% мікроорганізмів, які в ньому перебувають. Тому застосування глибинних фільтрів можливо тільки на стадії попередньої фільтрації. Поверхневим фільтрам властива абсолютна ефективність (100%). Механізм їх дії подібний до роботи сита. Частинки і мікроорганізми не можуть подолати мембрану, так як вона має пори, розмір яких менше, ніж розмір цих часток і мікроорганізмів. Як правило, мембрани виготовляють у вигляді простих листів з ефіру целюлози, чистої целюлози, неорганічних мікроволокон, покритих смолами, поліпропілена, нейлону, капрону, фторопласту та інших матеріалів, виготовленних як одне ціле. Розміри пор мембран в цих матеріалах лежать в широкому діапазоні від 0,1 мкм до 5 мкм. Для стерилізуючих фільтрів повітря, що подається в ферментери, як правило, використовують мембрани з розмірами пор 0,22мкм. Більшість фільтрів витримують протягом 1 року багаторазову стерилізацію при режимі 121° С протягом 30 хв, або 141° С протягом 10 хв. 1.4.2 Регулювання параметрів процесу біосинтезу. Управління технологічним процесом мікробіологічного синтезу полягає в підтримці на заданих рівнях значень основних технологічних параметрів. Найбільш широко застосовують такі контури управління: регулювання температури культуральної рідини шляхом змін параметрів теплоносія; контроль і регулювання концентрації розчиненого кисню шляхом вимірювання витрати повітря, що подається на аерацію або числа обертів мішалки; підтримання тиску в ферментере шляхом відкриття або закриття клапана на лінії виходу повітря; стабілізація рН шляхом додавання кислоти або лугу; підтримання рівня піни у заданих межах шляхом внесення піногасника, зниження витрати повітря або зменшення числа оборотів мішалки; підтримку на заданому рівні концентрації інгредієнтів субстрату в культуральній рідині шляхом їх додавання в ферментер. Регулювання температури суспензії в ферментаторі Процес забезпечується за рахунок подачі в «рубашку» апарата теплоносія-суміші води і пари, що транспортується циркуляційним насосом. Регулювання температури теплоносія в діапазоні від 0 до 150° С з точністю до 0,5° С забезпечується за рахунок встановлення потрібної температури на стійці управління. Пароповітряна суміш, пройшовши через зворотний клапан і інжектор, в якому відбувається змішування води і пари, надходить у рубашку ферментера. Після виходу з рубашки, теплоносій надходить на вхід циркуляційного насоса. Надлишок теплоносія, що утворюється за рахунок конденсації пари, відводиться через відрегульований на певний тиск клапан. Контроль рівня розчиненого кисню Розчинений кисень має винятково велике значення в процесах біосинтезу, характеризується інтенсивними швидкостями росту біомаси і підвищеними в’язкостями культуральної рідини, що характерно для процесів отримання антибіотиків. При анаеробному метаболізмі кисень відіграє роль акцептора електронів або водню за участю ферменту оксидази. Крім того, за допомогою оксигеназ кисень може вбудовуватися в молекулу вуглецевих субстратів при їх катаболизмі. Причому, кількість кисню, яка потрібна на одиницю біомаси, залежить від властивостей субстрата (вуглеводи вимагають меншої кількості кисню, а вуглеводні - значно більшого). Експериментально встановлено, що в разі ферментації бактерій і грибів, що використовують як джерело енергії вуг- леводи, на 1 г сухої біомаси потрібно 1 г кисню (теоретично для біосинтезу 3,39 г сухої біомаси-1 г кисню). Кисень є важко розчинним газом (8 мг / л при 25 ° С%; 7 мг / л при 35 ° C), причому наявність солей у рідині суттєво знижує розчинність в ній кисню. При високому вмісті біомаси в культуральній рідині (споживання кисню може досягати 50 г / л) необхідно інтенсивно поповнювати середовище розчиненим киснем. Датчики, що реєструють концентрацію розчиненого кисню та витримують багаторазову стерилізацію, засновані на методі полярографічного визначення дифузійного потоку кисню через напівпроникну мембрану, під якою розміщується анод (матеріал свинець або срібло) і катод (матеріал платина) в розчині електроліту . Датчики мають температурну компенсацію в діапазоні 0 50° С. Регулювання робочого тиску у ферментаторі Робочий тиск в ферментаторі може змінюватися від 0 до 2,5 атм. Результуючий сигнал від датчика тиску перетворюється в електричний сигнал і по команді від блоку управління за допомогою клапана зворотного тиску підтримує його в заданих межах. Контур тиску додатково оснащений контрольним манометром. Регулювання водневих іонів(рН) Концентрація водневих іонів (рН) -важливий параметр, який впливає на ріст мікроорганізмів і утворення кінцевого продукту. Бактерії зазвичай ростуть в діапазоні значень рН 4-8, дріжджі при рН 3-6, мікроскопічні гриби при рН 3-7. З різних причин рН в ході ферментації мають тенденцію до зміни, тому необхідна схема управління і підтримки рН на оптимальному рівні. Регулювання рН здійснюється автоматично додаванням кислоти або лугу за допомогою перистальтичних насосів (температурна компенсація 0-100 ° C). 1.4.3 Регулювання рівня піни Процес культивування аеробних мікроорганізмів супроводжується утворенням піни. Це пов'язано : по-перше, із введенням в рідину повітря; по-друге, з наявністю в складі культуральної рідини білків та інших поверхнево активних речовин,ьстабілізуючих бульбашки піни. У стійкій піні тривалість існування бульбашки 1-15 хв. Інтенсивне піноутворення пригнічує максимальне використання ємності біореактора, так як сприяє викиду піни і втрати цільового продукту. Крім того викид піни часто призводить до не стерильності продукту. Для піногасіння в даний час використовую різні методи: механічні (руйнування піни за рахунок ударної дії твердих поверхонь, впливу струменями рідини або газу, різка зміна тиску і інш.); хімічні (додавання поверхнево активних речовин, що зменшують міцність плівок, додавання речовин, що пов'язують піноутворювачі в поверхнево-неактивні комплекси); фізичні методи (електричне піногасіння, вплив коливань звукової або ультразвукової частоти та ін.); стабілізація рівня піни шляхом тимчасового зменшення подачі повітря або тимчасового припинення механічного перемішування, виведення надлишкової піни з біореактора. Найбільш ефективними на мою думку є хімічні і механічні способи піногасіння або їх комбінації. Проблему пінення можна вирішити, якщо залишити у верхній частині реактора достатній обсяг порожнього простору, в якому б лопалися бульбашки повітря, але це зменшить робочий об'єм реактора на 25-30%. Таким чином, регулювання рівня піни здійснюється декількома способами вплив на піну хімічними та фізико-хімічними методами; руйнування піни механічними, гідро- і аеродинамічними способами; руйнування піни коливаннями звукової та ультразвукової часто-ти; стабілізація рівня піни зменшенням витрат аеруючого повітря і зниженням числа оборотів мішалки. 1.5 Обробка, сушіння та фасування Для хімічного піногасіння найбільшого поширення отримали поліефірні препарати Пропінол Б-400 і адеканоль, поліметилсилоксани АС-60 та ін. В ході культивування хімічні піногасники можуть подаватися або за заздалегідь заданою програмою, або в міру необхідності при підвищенні рівня піни. Отриману культуральну рідину направляють на подальшу переробку по одному з двох способів. Перший з них : - культуральну рідину, що містить близько 3 % сухих речовин, концентрують вакуум-упарюванням до вмісту СВ 10- 12%; - у отриманий концентрат додають консервант - піросульфат натрію з розрахунку 2-3 кг на 1 м3 культуральної рідини і висушують в розпилювальній сушарці. Якщо вміст антибіотика в 1 кг сухого препарату виявляється вищим, ніж це встановлено технічними умовами (зазвичай воно коливається в межах 90-150 грама/кг), то отримуваний продукт підлягає стандартизації шляхом змішення з відповідною кількістю наповнювача. При стандартизації біовіта по активності як наповнювачі використовують тонкоподрібнені висівки, муку знежирену, кукурудзяну або соєву, або буряковий жом. Інший спосіб припускає проведення наступних технологічних операцій: Культуральну рідину в окремому збірнику обробляють розчином гашеного вапна з метою переведення розчиненого у воді хлортетрацикліну в осад у вигляді кальцієвої солі. Отриманий осад направляють на фільтр-прес. Осад з фільтр-преса вивантажують в бункер і за допомогою шнекорозгрузочного механізму він йде на грануляцію, а потім на сушку. Висушені гранули по трубопроводу пневмотранспортом збирають в окремий збірник і далі поступають на стадії дроблення і подрібнення. Отриманий продукт стандартизують також шляхом змішення з необхідною кількістю наповнювача. Препарати хлортетрацикліну розфасовують по 10-20 кг в двошарові паперові - мішки, поміщені в мішки з бязі. Зберігають в сухих затемнених приміщеннях при температурі не вище 25°С. Термін зберігання біовіта-20 встановлений в 6 міс, біовіта-40 і -80 - 1 рік з дня виготовлення. Готову культуральну рідину, що містить до 4,5 % сухих речовин, направляють на вакуум-упарювання, яке здійснюють при 50-60°С до вмісту 12-15%. Сконцентрована культуральна рідина поступає на розпилювальну сушарку і висушується при температурах вхідного теплоносія, що виходить, відповідно 160-200 і 70-80°С. В деяких випадках сушку культуральної рідини здійснюють спільно з наповнювачем, як який беруть сушений буряковий жом з розрахунку 250 кг на 1 м3 культуральної рідини. Отримувану при цьому пастоподібну масу висушують на вальцово-стрічковій сушарці або на сушарці з псевдокиплячим шаром. Екстракцію антибіотиків з культуральної рідини проводять ацетоном, бутанолом і іншими органічними розчинниками. Необхідно відзначити, що при екстракції антибіотиків використовують різні значення рН. Технологія виділення антибіотиків включає: екстракцію антибіотиків підходящими розчинниками, осадження і перекристалізація їх з різних середовищ, фракціонування на іонообмінних смолах, ліофільну і розпилювальну сушку готових препаратів. На екстракцію антибіотика в значній мірі впливає значення рН. Так, наприклад, при виділенні антрациклінових антибіотиків встановлено, що антраціклінові антибіотики взаємодіють із полімерними сорбентами по іонному і гідрофобному механізмах. Найбільш селективна сорбція відбувається на сегрегованому карбоксильному катіоні БДМ-12. Показано, що максимальне поглинання антрациклінового антибіотика знаходиться в області нейтральних значень рН, коли в системі сорбент - сорбат реалізуються як іонні, так і гідрофобні взаємодії. З культурального середовища антибіотики виділяють екстракцією органічними розчинниками, осадженням, адсорбцією. Очищення антибіотиків проводять повторною заміною розчинника, адсорбційно- хроматографічними методами, високоефективної рідини хроматографією(ВЕРХ). Від ступеня чистоти препарату, вологості, темпе- ратури, рН розчинника залежить стабільність антибіотика. Отже, технологічний процес одержання кормового хлортетрацикліну складається: Підготовка і стерилізація апаратури та дрібного приладдя; Підготовка і стерилізація поживного середовища; Одержання посівного матеріалу із спорового матеріалу продуцента; Ферментація посівного матеріалу із ферментаційним середовищем у ферментаторі; Виділення хлортетрацикліну; Фасування та маркування. РОЗДІЛ 2 МЕТОДИ ВИЗНАЧЕННЯ рН 2.1 Електрометричний метод визначення рН Метод заснований на тому, що при зануренні електроду в розчин відбувається обмін іонів між електродом і розчином, внаслідок чого на електроді виникає потенціал, величина якого залежить від концентрації водневих іонів в розчині. Його можна виміряти, якщо скласти гальванічний елемент з електрода, потенціал якого хочуть виміряти (індикаторний електрод), і допоміжного електрода з відомим потенціалом (електрод порівняння). У справжній час як індикаторний застосовують скляний і сурм'яний електроди, а в якості електродів порівняння - хлорсрібний і каломильний. Скляний електрод відноситься до типу мембранних електродів. Він виготовляється у вигляді скляної трубки, що закінчується тонкостінною кулькою зі спеціального складу. Всередину кульки поміщають внутрішній контактний електрод, упаяний в скляну трубку. Контактний електрод виготовлений з амальгованого платинового дроту і грає роль провідника струму. Кулька заповнена 0,1 н. розчином соляної кислоти. Для захисту від механічних пошкоджень кульки поміщають всередину трубки з отворами через які здійснюється доступ досліджуваного розчину до кульки і промивка скляного електрода. Скляна мембрана здатна обмінювати катіони, які в ній містяться (Na+, K +, Li +) на іони водню в розчині. Внаслідок цього обміну на внутрішній і зовнішній поверхнях скляної кульки встановлюється іонна рівновага, яка ви- діляє потенціал обох поверхонь кульки. Оскільки склад розчину всередині кульки залишається постійним, сума потенціалів внутрішнього контактного електрода і внутрішньої поверхні кульки постійна. Отже, потенціал скляного електрода залежить тільки від концентрації іонів водню в досліджуваному розчині. Потенціал скляного електрода в інтервалі рН від 1 до 10 є лінійною функцією величини рН і не залежить від присутністю в розчині окислювачів і відновників. Так як сума потенціалів внутрішньої кульки і контактного електрода невідома, то попередньо проводять калібрування скляного електрода по буферному розчину з рH, близьким до рH досліджуваного розчину.  1 – скляна мембрана (сенсорна частина електроду); 2 – іноді може утворюватися осад 3 - внутрішній розчин ( як правило, 0,1М соляна кислота) 4 - внутрішній електрод 5 - корпус електроду, виготовлений з або напівпровідного скла або пластику 6 - електрод порівняння 7 - з’єднання з розчином, що досліджується 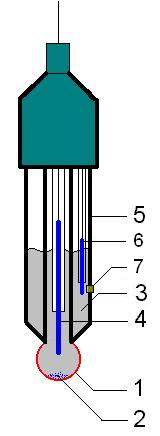 Сурм'яний електрод є металооксидним електродом, застосування якого засновано на наступному явищі. Якщо метал занурити в розчин, що містить іони цього ж металу, то внаслідок обміну між ними іонів на електроді виникне потенціал, величина якого залежить від концентрації іонів в розчині. Сурм'яний електрод являє собою метал, покритий тонким шаром оксиду металу. Необхідний шар оксиду виникає за рахунок окислення сурми киснем повітря. При зануренні електрода в розчин оксиду сурми (ІІІ) Sb2О3, перетворюється в слаборозчинний гідроксид Sb (ОН)з. Ступінь його розчинення, а отже, і величина потенціала електрода лінійно залежать від pH розчину, Перед визначенням рН перевіряють показання електрода по буферним розчинам. Хлорсрібний електрод виготовляють з срібного дроту, який шляхом анодної обробки в хлоридному розчині покривають тонким шаром хлориду срібла. Виготовлену таким чином дріт занурюють в насичений розчин хлориду калію. Потенціал хлорсрібного електроду є лінійною функцією логарифма активності хлорид-іонів в розчині. Так як концентрація Cl-іонів в насиченому розчині хлориду калію завжди постійна, то і розчинність хлориду срібла в ньому є постійною величиною, отже, і величина потенціала хлорсрібного електрода стійка, що дозволяє використовувати його в якості електрода порівняння. На рисунку 2.2 наведено детальну будову хлорсрібного електроду типу ЕВЛ–1–М3.  1 – срібна дротинка; 2 – кристали AgCl; 3 – гумовий корок і отвір для заливання розчину KCl; 4 – розчин KCl; 5 – азбестова нитка; 6 – крпус; 7 – капіляр. 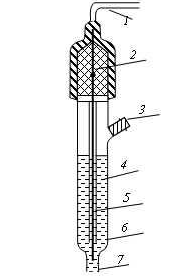 Рис. 2.2 Будова хлорсрібного електроду ЕВЛ–1–М3 У лабораторній практиці для вимірювання рН застосовують при- бори різних марок. Найбільш точними з них є рН-метри марок ЛПУ-01, РН-340(додаток 2), універсальний ЕВ-74 ( додаток 3). |
