Курсач (3). Характеристика рНметрії у виробництві кормового хлортетрацикліну
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
|
2.2 Визначення рН за допомогою рН-метра ЛПУ-01 Принцип роботи приладу заснований на вимірі ЕРС гальванічного елемента, складеного із скляного (індикаторного) і хлорсрібного (допоміжного) електродів. Шкала прибору градуйована в одиницях рH і мілівольтах. Межі вимірювання рН від 2 до 14. Для підвищення точності вимірювання прилад має чотири діапазони з вузькими інтервалами значення рН. У цих інтервалах похибка приладу не перевищує 1%; в інтервалі рН 2-14 вище + 2,5% від діапазону вимірювань. На рисунку 2.3 зображено схему рН – метра ЛПУ-01 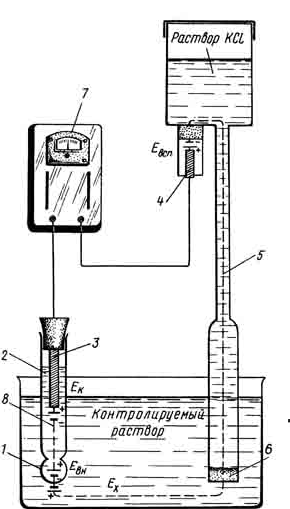 Рис. 2.3 Схема рН – метра ЛПУ-01: 1 – кулька із електродного стекла; 2 – розчин, який заповнює внутрішню проміжність електрода; 3 – внутрішній контактний електрод; 4 – допоміжний електрод; 5 – електролітичний контакт; 6 – пориста перегородка; 7 - рН – метр ЛПУ-01; 8 – скляний електрод. Прилад (рис. 2.3) складається з гальванічного елемента (датчика) і вимірювача. Всі частини датчика зібрані на штативі. На верхньому кінці штатива закріплений проточний допоміжний електрод, який помістили в поліетиленову посудину. У нижній частині штатива є рухомий столик для установки склянки з досліджуваним розчином і електродами. Електричний контакт між двома електродами здійснюється через стовпчик насиченого розчину хлориду калію, який витікає з поліетиленової посудини по гумовій трубці і скляному наконечнику в досліджуваний розчин. Розчин хлориду калію повільно (20 мл на добу) випливає через пористу перегородку наконечника, запобігаючи таким чином проникнення посторонніх іонів з досліджуваного розчину в посудину з допоміжним електродом. Необхідно стежити, щоб в трубці електроду не було бульбашок повітря, які порушують контакт контакт. Скляний електрод і наконечник кріпиться на кронштейн зажимами. У комплекті датчика є електролітичний контакт для вимірювань рН розчинів об'ємом до 1 мл. 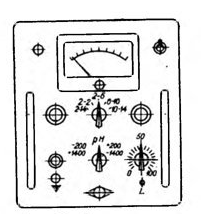 Рис. 2.4 Панель рН – метра ЛПУ-01 На панелі вимірювача (рис. 2.4) знаходиться шкала, яка показує 5 значень рН: від -2 до 2, від 2 до 6, від 6 до 10, від 10 до 14 і від-2 до 14, а також шкали для вимірювання EРС. На панелі також видно всі ручки для керування пристроєм. Перед початком роботи електроди ретельно промивають водою та висушують фільтрувальною папером. До гнізда за допомогою штекера підключають датчик, пристрій включений в мережу, тумблер встановлений "ввімкнуто"(при цьому загоряється контрольна лампочка) і прилад прогрівають 30 хв. Рукоятку перемикання «Види робіт» встановлюють в положення «рН», а рукоятку компенсатора температури - на потрібне значення температури. Вимірювання проводять при 20-30° С , так як при цій температурі відхилення в значеннях рH лежать в межах погрішності приладу. Після прогріву приладу приступають до його налаштуванні за стандартними буферним розчинам з відомим значенням рН. Буферні розчини готують із спеціальних фіксаналів. Для настройки беруть буферний розчин, рН якого близький до рH досліджуваного розчину. Буферний розчин наливають у склянку на 200 мл, столик на штативі відводять вліво, стакан підставляють під електроди, повертають стіл і опускають на нього склянку. Столик встановлюють на такій висоті, щоб електроди були занурені в розчин на глибину 2 - 4 см. Перемикач меж вимірювань ставлять проти потрібного діапазона вимірювань і через 0,5-1 хв. ручкою настройки по буферному розчині стрілку на шкалі підводять до поділки, відповідного значення рH буферного розчину. Вимірювання рН досліджуваного розчину проводиться в послідовності, прийнятій при настройці приладу. Якщо рН розчину абсолютно невідомий, то спочатку роблять орієнтоване визначення, ставлячи перемикач меж вимірювань в положення «2-14» і знімаючи відлік по шкалі, в одиницях рН від 2 до 14. Потім, не змінюючи розчину, перемикач встановлюють на позначку знайденого діапазону рH і відлік знімають за відповідною шкалою. У перервах роботи електроди тримають в дистильованій воді, так як при висиханні змінюється їх характеристика. При появі плівок на електродах їх промивають органічними розчинниками, розчинами кислот і лугів, а потім дистильованою водою. Похибка приладу за стандартними буферним розчином не вище 0,02 рН, а чутливість не нижче 0,01 рН. Перевірку нового приладу або нового скляного електрода проводять по буферним розчинам в перші кілька днів щоденно, а в подальшому - раз в тиждень. У виробничому контролі прилади використовують для визначення не тільки рН, а й титрованої кислотності методом електрометричного титрування. 2.3 Колориметричний метод визначення рН Метод заснований на застосуванні індикаторів, забарвлення яких залежить від величини рН. Ці індикатори інакше називають pH-індикаторами. Згідно теорія електролітичної дисоціації індикатори являють собою слабкі органічні кислоти або луги, у яких іони і не дисоційованні молекули мають різне забарвлення. Індикатори бувають однокольоровими (забарвлена одна форма) і двохкольоровими (забарвлені дві форми). Так, наприклад, фенолфталеїн, який являє собою слабку кислоту, є одноколірним індикатором, молекули якого безбарві, а аніони пофарбовані в малиновий колір. Фенолфталеїн є слабким електролітом, тому у нейтральному середовищі рівновага зміщується вліво. У кислому середовищі дисоціацію молекул фенолфталеїна пригнічують присутні в розчині іони водню, внаслідок чого фенолфталеїн також залишається безбарвним і його не дисоційовану молекулу називають кислотною формою індикатора. У лужному середовищі іони водню, які утворюються при дисоціації будуть зв'язуватися з гідроксильними іонами середовища і рівновага зміститься вправо, що призведе до накопичення аніонів індикатора, які забарвлять розчин в малиновий колір. У цьому випадку аніони індикатора, що зумовили забарвлення розчину, носять назву лужної форми індикатора. Аналогічним чином відбувається зміна забарвлення і ос новних індикаторів, до яких відноситься, наприклад, метил - оранж . Таким чином, забарвлення індикатора в розчині визначається співвідношенням концентрацій його іонів і не дисоціюючих молекул: R- / HR. У розчині завжди присутні обидві форми індикатора, але перехід забарвлення спостерігається тільки при визначеному співвідношенні обох форм. Отже, видима зміна забарвлення індикатора відбувається не при будь-якій зміні рН, а лише всередині певного діапазона його значень, які називаються інтервалом переходу індикатора. Інтервали переходу найбільш часто вживаних індикаторів наведені в таблиці 1.3. Знаючи інтервал переходу індикатора, можна за забарвленням розчину наближено визначити рН. Для цього спочатку по лакмусу встановлюють реакцію середовища. Якщо після додавання лакмусу розчин забарвиться в червоний колір, значить реакція кисла і потрібно брати індикатори з інтервалом переходу в кислому середовищі. Потім, послідовно проводячи проби з різними індикаторами, знаходять такий, при якому забарвлення розчину відповідає лужній формі індикатора. Значення рH розчину буде перебувати між інтервалами переходу двох останніх індикаторів. Наприклад, якщо при добавці метиленового червоного розчин забарвлюється у червоний колір, а при добавці метилового оранжевого - в помаранчевий, то рН розчину лежить в межах 3,1-4,2. Для орієнтуючого, визначення рН користуються універсальними індикаторами, що представляють собою суміш індикаторів з інтервалами переходу від сильно кислої до сильно лужної реакції середовища. pН-індикатори застосовують у вигляді розчинів, індикаторних олівців і індикаторних папірців. 2.4 Визначення рН за допомогою індикаторних папірців Заводи в Україні випускають два набори індикаторних папірців. Перший набір призначений для орієнтуючого виявлення рH. Він містить унаверсальну індикаторні папірці і кольорову шкалу порівняння. Для визначення рН смужку змочують досліджуваним розчином і порівнюють її колір зі шкалою. За збігом забарвлень знаходять приблизне значення рН розчину. Другий набір використовується для точного визначення рН. У ньому є кольорові смужки з цифрами, що вказують вузькі діапазони чутливості(1,8-3,6; 3,6-5,7; 5,7-7,4; ... 12,4-13,6 рH), і індикаторні папірці з відповідним інтервалом переходу. Встановивши наближене зпаченне рH розчину, беруть відповідну смужку індикаторного папірця, занурюють її в розчин до повного змочування, а потім колір середньої частини папірці порівнюють із забарвленням кольорових шкал, знаходячи межі рH, в яких відтінок шкали повністю збігається з забарвленням індикаторного папірця. Точність методу ке перевищує 0,1 рН. Отже, вимірювання показника рН можна проводити різними методами. Найбільш використовуваними є: Електрометричний метод (вимірювання за допомогою рН- метрів марок ЛПУ-01, 340, універсальний ЕВ-74); Колориметричний метод (вимірювання проводяться із додаванням індикаторів); Метод індикаторних папірців. РОЗДІЛ 3 ЗАСТОСУВАННЯ МЕТОДУ РН – МЕТРІЇ НА РІЗНИХ СТАДІЯХ ТЕХНОЛОГІЧНОГО ПРОЦЕСУ ОДЕРЖАННЯ ХЛОРТЕТРАЦИКЛІНУ У біотехнологічних виробництвах водневий показник (рН) відіграє дуже важливу роль, адже майже на всіх стадіях технологічного процесу потрібно знати його значення. Це потрібно знати для того, щоб враховуючи цей показник ми змогли його змінити, якщо він нас не влаштовує. На етапі підготовки поживного середовища показник рН повинен знаходитися у межах від 6,5 до 6,7. Для того, щоб у цьому переконатися ми маємо виміряти цей показник за допомогою електрометричного методу. Суть цього методу полягає у застосуванні рН – метра марки ЛПУ-01. Спочатку рН – метр відкалібровують ,промиваючи декілька разів електроди дистильованою водою. Потім готують поживне середовище, переливають його у склянку 100 мл і повільну занурюємо у нього електроди. Чекаємо доки на передній панелі остаточно зупиниться значення. Якщо отримане значення нас не задовольняє ми або підкислюємо середовище або додаємо крейду, для регуляції рН середовища. На цій стадії технологічного процесу значення рН повинно знаходитися у межах від 6,7 до 6,8. Як бачемо значення відрізняються дуже маленьким інтервалом, тому саме тут потрібно приділити особливу увагу, щоб точно виміряти значення. Вимірювання проводять на рН – метрі такої ж марки, як і у попередньому досліді. Досліджуваний розчин готують із спорового матеріалу продуцента ( недосконалого гриба) Streptomyces aureofaciens. Для зручності його переносять у мірний стакан об’ємом 100 – 200 мл. Прилад промиваємо після попереднього досліду шляхом занурення електродів у стакан із дистильованою водою. Потім відсуваємо столик рН – метра, знімаємо стакан із дистильованою водою і ставимо склянку із досліджуваним матеріалом. Столик повертаємо у вихідне положення і занурюємо електроди у нашу склянку із досліджуваним матеріалом. За аналогією чекаємо остаточної зупинки значення на передній панелі. Записуємо результат. На стадії ферментації показник рН повинен знаходитися у межах від 5,8 до 6,0. Саме на цій стадії показник рН має найбільше значення оскільки при його раптовому зниженні може відбутися розплавлення культуральної рідини. Це призведе до зупинки нагромадження антибіотика, що не припустимо на цьому етапі. Вимірювання проводять для ферментаційного середовища, яке разом із посівним матеріалом вносять у ферментатор із механічним перемішуванням. Так як ми вже провили вимірювання рН посівного матеріалу, то потрібно провести таке ж вимірювання і для ферментаційного середовища. Спочатку за аналогією промивають електроди рН – метра у дистильованій воді після попереднього вимірювання. Потім їх опускають у досліджуваний розчин і чекають остаточного зупинення значення. Визначення показника рН можна проводити і іншими методами, наприклад, колориметричним (застосування індикаторів) або за допомогою індикаторних папірців. Але ці методи не відповідають нашим вимогам, оскільки нам потрібно знати не наближені значення рН а точні, що дозволяє ли електрометричний метод. Отже, у біотехнологічних виробництвах антибіотиків на різних стадіях технологічного процесу потрібно вимірювати значення показника рН, для того, щоб уникнути окислювання середовище. Якщо це відбулося до досліджуваного розчину потрібно додати трішки крейди для устаткування значення рН. ВИСНОВКИ Технологічний процес одержання кормового хлортетрацикліну складається: 1)Підготовка і стерилізація апаратури та дрібного приладдя; 2)Підготовка і стерилізація поживного середовища; 3)Одержання посівного матеріалу із спорового матеріалу продуцента; 4)Ферментація посівного матеріалу із ферментаційним середовищем у ферментаторі; 5)Виділення хлортетрацикліну; 6)Фасування та маркування. Якщо, дотримуватися всіх вище зазначених рекомендацій щодо одержання хлортетрацикліну, можна домогтися максимального виходу антибіотику. Вимірювання показника рН можна проводити різними методами. Найбільш використовуваними є: • Електрометричний метод (вимірювання за допомогою рН- метрів марок ЛПУ-01, 340, універсальний ЕВ-74); • Колориметричний метод (вимірювання проводяться із додаванням індикаторів); • Метод індикаторних папірців. У біотехнологічних виробництвах антибіотиків на різних стадіях технологічного процесу потрібно вимірювати значення показника рН, для того, щоб уникнути окислювання середовище. Якщо це відбулося до досліджуваного розчину потрібно додати трішки крейди для устаткування значення рН. СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ Великая Е. И., Суходол В. Ф.: В 26 «Лабораторный практикум по курсу общей технологии бродильных производств (общие методы контроля)».- 2-е изд., перераб. И доп.-М.: Легкая и пищевая промышленость, 1983. – 312 с. Краснопольський Ю. М., Клещев Н. Ф.: К 78: Фармацевтическая биотехнология: Производство биологически активных веществ: учеб.пособие: в 2 ч. – Ч. 1 / Харьков : НТУ ХПИ, 2013. – 304 с. Калтинский А.В., Сазыкин Ю.О., Орехов С. Н., «Биотехнология» Московская медицынская академия им. И. М. Сеченова, 2005.- 215 с. М. С. Мосичев, А. А. Складнев, В. Б. Котов : М 81 « Общая технология микробиологических производств».- УДК 663.1.: Легкая и пищевая промышленость, 1982. – 165 с. http://www.likar.info/lekarstva/Tetratsiklina-gidrohlorid/ http://chem21.info/page/109070243027015207195039071130204014058181178204/ Додаток 1      Вихідна сировина рН, стерильність Підготовка пож. Сред.     рН =6,0 -7,0, темп. = 24-26°С, час = 30-40 год Пілготовка інокулята Пож. Середовище, продуцент      Темп. = 26±10С, час = 120 год Ферментація Пож. Серед., посівний матеріал     Швидкість і час фільтрації Фільтрація Біомаса, міцелій        Температура = 60-75°С , До рН = 8,8 Попередня обробка, натрієвого розчину Вапно     рН = 1,9-2,0 Екстракція Натрієвий розчин,бутилацетат     рН = 6,6—7,2 Перекристалізація Бутилацетатний екстракт, водний розчин дикарбоната натрія   Рис.1.1 ТЕХНОЛОГІЧНА СХЕМА ОДЕРЖАННЯ ХЛОРТЕТРАЦИКЛІНУ Додаток 2  Рис. 2.1 рН – метр марки РН-340 Додаток 3  Рис. 3.1 рН-метр марки ЕВ-74 |
