Миронов неорганика. Характеристика сырья и готовой продукции
 Скачать 208.15 Kb. Скачать 208.15 Kb.
|
1.2. Характеристика готовой продукции1.2.1. АммиакПо физико-химическим показателям аммиак должен соответствовать нормам, указанным в табл. 3 (ГОСТ 6221-75). Таблица 3. Аммиак
2. Физико-химические основы производстваСинтез аммиака из элементов осуществляется по уравнению: N2+3H2↔2NH3; ΔH<0 Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (ΔH298 = - 91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (ΔH725 =-112,86 кДж/моль). Согласно принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно (ΔS298=-198,13 кдж/моль К) и не благоприятствует протеканию реакции. Реакция синтеза аммиака протекает с уменьшением объема. Согласно уравнению реакции 4 моль исходных газообразных компонентов образуют 2 моль газообразного продукта. В условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком. Оценка условий термодинамического равновесия позволяет сделать вывод, что максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низкой температуре. Однако даже при очень высоких температура (выше 1000°С) процесс синтеза в гомогенной газовой фазе практически не осуществим. Синтез аммиака протекает с заметной скоростью только в присутствие катализатора, причем катализаторами данной реакции служат твердые вещества. Гетерогенный - каталитический синтез аммиака имеет сложный механизм, который может быть описан следующими стадиями: • диффузия молекул азота и водорода к поверхности катализатора; • хемосорбция молекул реагентов на поверхности катализатора; • поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействия между ними; • десорбция продукта; • диффузия продукта реакции (аммиака) в газовую фазу. Исследование кинетики и механизма реакции позволило сделать вывод о том, что лимитирующей стадией процесса является хемосорбция азота. Тогда механизм синтеза аммиака в сокращенной схеме: N2+Z ↔ ZN2 ZN2+3H2 ↔ NH3+Z N2+3H2 ↔ 2NH3 где Z - свободный центр поверхности катализатора, ZN2 - хемосорбированная частица. Скорость обратимой реакции получения аммиака из элементов на большинстве известных катализаторов описывается уравнением Темкина-Пыжева: 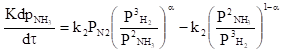 где k1 и k2 - константы скоростей образования и разложения аммиака; PN, PH, PNH - парциальные давления азота, водорода, аммиака; α - постоянная, удовлетворяющая неравенству 0<α<1 и характеризующая степень покрытия поверхности катализатора азотом. При проведении процесса при атмосферном давлении величина а для промышленных катализаторов в интервале температур 400-500°С равна 0,5. Скорость реакции синтеза аммиака зависит от температуры, давления и реакционной смеси. Оптимальными считают такие значения указанных параметров, при которых скорость процесса максимальна. Чтобы определить оптимальную температуру синтеза Тm, надо продифференцировать по температуре кинетическое уравнение (1), приравнять полученное выражение нулю и найти Тm. Выполнив эти действия, получим формулу: 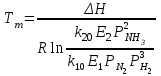 Из формулы (2) следует, что с увеличением содержания в циркуляционном газе аммиака и уменьшением содержания азотоводородной смеси оптимальная температура падает. Из уравнения Темкина-Пыжева видно, что скорость прямой реакции синтеза пропорциональна P1,5, а скорость обратной реакции пропорциональна P0,5. Отсюда очевидно, что с ростом давления наблюдаемая скорость процесса увеличивается. И термодинамические, и кинетические факторы свидетельствуют в пользу проведения процесса при высоких давлениях (увеличивается равновесный выход, повышается скорость синтеза). Конденсация аммиака также улучшается при высоком давлении. Вместе с тем повышение давления увеличивает расход электроэнергии на компрессию, повышает требования к машинам и аппаратам. Присутствие инертных примесей в реакционной смеси снижает общее давление, и с увеличением содержания метана, аргона и гелия в смеси уменьшает скорость реакции синтеза. Анализируя кинетическое уравнение (1), видим, что скорость прямой реакции обратно пропорциональна парциальному давлению аммиака, а для обратной реакции характерна прямая пропорциональность. Таким образом, с повышением содержания аммиака общая скорость реакции падает. Увеличение объемной скорости смеси приводит к уменьшению скорости прироста содержания аммиака и, тем самым, к увеличению средней скорости и повышению производительности процесса. Реакция синтеза аммиака обратимая, поэтому полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Условия равновесия процесса и кинетические закономерности его протекания на железных катализаторах обуславливают возможность превращения в аммиак только 20-40% исходной реакционной смеси. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза. Чтобы выделить аммиак, азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения аммиака. Достичь полной конденсации аммиака не удается; небольшая часть его остается в азотоводородной смеси. Не прореагировавшая азотоводородная смесь с остаточным аммиаком вновь возвращается на синтез аммиака. Обоснование выбора давления процесса синтеза аммиака. Выбор давления процесса синтеза аммиака диктуется рядом соображений. Термодинамические и кинетические факторы (равновесное содержание аммиака и скорость реакции) свидетельствуют в пользу высоких давлений. Конденсация аммиака из газовой смеси также облегчается при высоких давлениях. Однако при этом имеет место значительный расход энергии на компрессию и повышенные требования к машинам, аппаратам и арматуре. При пониженных давления упрощается аппаратурное оформление процесса, снижается расход энергии на компрессию, при этом несколько увеличиваются энергозатраты на циркуляцию газа и выделение аммиака. В качестве критерия оптимальности в работе были приняты приведенные затраты, которые складываются из себестоимости продукта и доли капиталовложений с учетом нормального коэффициента эффективности 3 = С + Е К/П где 3 - приведенные затраты, руб/т; С - себестоимость аммиака, руб/т; К - капитальные затраты на агрегат, руб.; Е - нормативный коэффициент эффективности, год-1; П-производительность агрегата по аммиаку, т/год. Проведенные расчеты показали, что при принятых исходных данных наиболее экономичным является среднее давление порядка 30 Мпа. Приведенные затраты с понижением давления увеличиваются, что связано с большими энергоматериальными и капитальными затратами на стадиях выделения аммиака из газовой смеси. Известно, что по мере увеличения объемной скорости газового потока содержание аммиака в выходящем газа уменьшается. Однако производительность катализатора увеличивается с увеличением скорости газа, так как снижение процентного содержания аммиака в выходящем газе компенсируется влиянием увеличения количества образующегося аммиака. Катализаторы синтеза аммиака. Высокую каталитическую активность в синтезе аммиака проявляют металлы VI, VII и VIII групп периодической системы. Наибольшей активностью обладают Fe, Ru, Re, Os. В промышленности нашли применение железные катализаторы, получаемые сплавлением оксидов железа с активаторами (промоторами) и последующими восстановлением оксидов железа. В качестве активаторов применяются оксиды кислотного и амфотерного характера - Al2О3. SiО2. TiО2 и др., а также оксиды щелочных и щелочноземельных металлов-К2О, Na20, CaO, MgO и др. По своему действию промотирующие добавки делятся на две группы: • структурообразующие (Аl2О3, SiO2, TiO2, MgO и др.), способствующие получению катализатора с высокоразвитой поверхностью, и модифицирующие (К20, Na2O, CaO и др.), обуславливающие высокую активность поверхности катализатора. Количество и соотношение добавляемых промоторов оказывает решающее значение в получении промышленных катализаторов высокой активности и устойчивости. Кроме промотирующих соединений в катализаторе содержится небольшое количество примесей (S, Р, Сu, Ni и т.д.), снижающих его активность, поэтому сырье для приготовления катализатора должно быть возможно более чистым. Активность катализатора, его структура и состав поверхности в значительной степени определяются условиями восстановления. Процесс восстановления катализатора можно описать суммарным уравнением: Fe3O4 + 4H2 → 3Fe + 4H2O; H>0 Катализатора синтеза аммиака необратимо отравляются сернистыми соединениями и хлором. Их концентрация в газе в сумме не должна превышать 5 10-5%. Кислородосодержащие соединения (H2O, СО, СО2) и кислород, присутствующие в азотоводородной смеси, являются сильными каталитическими ядами, снижающими активность катализатора обратимо. Их отравляющее действие пропорционально содержанию в них кислорода. Если в составе свежего газа имеются Кислородосодержащие примеси или масло, газ следует вводить в цикл перед вторичной конденсацией для удаления вредных соединений конденсирующимся NH3. Для получения катализатора высокой активности при восстановлении необходимо предотвращать повышение концентрации паров воды в газовой фаза. Поэтому процесс восстановления катализатора проводят при высокой объемной скорости, низком давлении, постепенном повышении температуры и высокой степени очистки газа восстановителя, поступающего на катализатор. В промышленных колоннах катализатор восстанавливают циркуляционной азотоводородной смесью при объемной скорости 5000-10000ч-1 и давлении 50-100 ат. Концентрация водяного пар в газе, выходящем из колонны синтеза, не должна превышать 3000 см3/м3. Основные условия высокой стабильной производительности установок синтеза аммиака: • высокая степень очистки азотоводородной смеси от каталитических ядов и инертных примесей; • поддержание соотношения N2:H2 близкого к 1: 3; • оптимальная температура процесса по длине каталитической зоны; • снижение содержания аммиака на входе в контактный аппарат; • совершенная конструкция контактного аппарата (колонна синтеза). Основные принципы управления процессом синтеза аммиака. Эксплуатация систем синтеза аммиака сложна из-за наличия многочисленных прямых и обратных связей между регулируемыми и регулирующими параметрами процесса. Наибольшая эффективность достигается при оптимизации таких параметров процесса, как давление, температурный режим, объемная скорость, состав газа, подаваемого в реактор синтеза аммиака, по основным компонентам (Н2, N2, NН3) и примесям (яды, инерты): 1) Факторы, изменение которых приводит к изменению давления в системе. Изменение температурного уровня в реакторе влечет за собой изменение одновременно двух величин: равновесного содержания аммиака и скорости реакции. Причем увеличение температуры приводит к снижению равновесного содержания и ускорению реакции синтеза аммиака. Поэтому в промышленных условиях, обеспечивающих предельную для данных условий степень превращения (близкую к равновесной), подъем температуру приводит к пропорциональному снижению степени превращения. Изменение газовой нагрузки на входе в реактор влияет на давление в системе следующим образом: при уменьшении нагрузки степень конверсии увеличивается, что вызывает повышение температуры в зоне катализа и, в свою очередь, к увеличению давления в системе. И наоборот, увеличение газовой нагрузки на реактор (в известных пределах) приводит к снижению давления в системе. Кроме того, при повышении объемных скоростей, с одной стороны, снижается степень конверсии, а с другой - температурный уровень в зане катализа и увеличивается производительность реактора по аммиаку. Последнее связано с тем, что уменьшение производительности реактора от снижения концентрации аммиака в выходящем газе компенсируется увеличением объемной скорости, так как в процентах это увеличение значительно больше снижения концентрации аммиака. Расход свежего синтез - газа в соотношении N2:H2=1: (2,5-3) зависит от режима работы, активности катализатора, заданной производительности установки. Синтез - газ, удаляемый из систему в виде аммиака и продувочных и танковых газов, непрерывно поступает от компрессора. При избытке синтез-газа давление в реакторе синтеза повышается до допустимого предела компрессора, а избыток его сбрасывается. Если же расход синтез - газа уменьшается (или недостаточен), вращение компрессора уменьшается и давление в системе снижается до достижения баланса между поступающим на синтез газом и получающимся аммиаком. Скорость реакции синтеза аммиака зависит от состава газовой смеси. оптимальным составом при равновесии, согласно закону действующих масс, является стехиометрический. Отклонение от равновесия ведет к более низкому значению оптимального соотношения вследствие влияния кинетических факторов. Максимальная скорость реакции в промышленных условиях наблюдается при соотношении Н2:N2=2,5-2,8. Поэтому в промышленных условиях при работе систем синтеза с предельным выходом аммиака (близким к равновесному) отклонение состава от оптимального соотношения приводит к снижению скорости процесса синтеза и, соответственно, к увеличению давления. Увеличение содержания аммиака в газе на входе в реактор (повышение температуры вторичной конденсации) приводит к увеличению давления, так как снижается скорость реакции синтеза за счет торможения процесса продуктом реакции (аммиаком). Уменьшение начальной концентрации аммиака приводит более высоким степеням превращения и соответственно к снижению давления в системе. Изменение содержания инертных газа в синтез - газе на входе в реактор приводит к изменению давления в системе за счет изменения эффективного давления, определяемого по уравнению: Рэфф=Робщ(1-i) 2 где i - содержание инертных газов, доли от общего объема. Изменение эффективного давления приводит соответственно к изменению степени конверсии и скорости реакции синтеза аммиака. Причем с ростом содержания инертных газов давление в системе синтеза увеличивается, а при их снижении - уменьшается. Изменение активности катализатора также приводит к изменению давления в системе. Температура, скорость процесса, чистота синтез - газа является основными причинами, приводящими к изменению активности катализатора. Так, при работе даже на чистом синтез - газе активность катализатора, подвергшегося действию высоких температур (530°С) в течении длительного времени, снижается необратимо за счет постоянно протекающих в катализаторе ре-кристаллизационных процессов. Оптимальным в системе синтеза аммиака является возможно более низкое давление, обеспечивающее заданную производительность агрегата по аммиаку с учетом затрат на выделение продукта из циркуляционного газа. 2) Изменение температурного уровня в зоне катализатора возможно за счет следующих факторов. Изменение давления. При повышении давления температурный уровень в реакторе повышается, так как возрастает степень превращения и соответственно тепловыделение, идущее на повышение температуры. Уменьшение давления приводит к снижению температуры. Изменение расхода свежего синтез - газа. При поступлении избыточного давления свежего синтез - газа наблюдается рост давления и соответственно повышение температуры в зоне катализа. При уменьшении расхода синтез - газа снижаются давление и температурный уровень в реакторе. Изменение газовой нагрузки на реактор. При снижении газовой нагрузки увеличивается степень конверсии и соответственно повышается температурный уровень в реакторе. Наоборот, увеличение газовой нагрузки снижает температуру в реакторе. Содержание аммиака на входе в реактор. Уменьшение содержания аммиака повышает температурный уровень в зоне катализатора, так как при этом увеличивается степень конверсии, а увеличение содержания аммиака во входящем газе наоборот снижает температурный уровень в реакторе. Содержание инертных газов в синтез - газе. Уменьшение содержания инертных газов приводит к повышению эффективного давления и соответственно повышение скорости процесса и степени конверсии, в результате чего температурный уровень в реакторе повышается. При увеличении содержания инертных газов температурный уровень в реакторе понижается. | |||||||||||||||||||||||
