Химия. Химические источники тока. Химические источники тока
 Скачать 178 Kb. Скачать 178 Kb.
|
|
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Законы электрохимии применяются для получения электрической энергии за счет преобразования энергии химических реакций в химических источниках тока. Достоинствами химических источников тока являются: высокий коэффициент полезного действия, бесшумность, безвредность, компактность, что позволяет их использовать в очень широком диапазоне. Различают химические источники первого и второго рода. К химическим источникам первого рода относятся устройства для прямого преобразования химической энергии в электрическую. После завершения химической реакции источники первого рода далее использоваться не могут. Это источники одноразового действия. К ним относятся сухие и наливные элементы. К химическим источникам второго рода относятся обратимые устройства для преобразования химической энергии в электрическую. После завершения химической реакции возможно под действием внешнего источника тока вернуть такой источник в рабочее состояние. К источникам второго рода относятся аккумуляторы. К химическим источникам тока относятся и топливные элементы - устройства для преобразования химической энергии в электрическую, в которых восстановитель и окислитель хранятся вне элемента и в процессе работы подаются к инертным электродам. Химические источники тока характеризуются электродвижущей силой (ЭДС), напряжением, мощностью, ёмкостью и энергией, которую элемент может отдать в процессе работы во внешнюю цепь, также важной характеристикой химического источника тока является сохраняемость. Электродвижущая сила элемента определяется значениями катодного и анодного потенциалов. Напряжение элемента меньше ЭДС из-за поляризации электродов (изменения величины их потенциалов в процессе работы) и оммических потерь на сопротивление проводников первого и второго рода внутри элемента. При разряде элемента поляризация электродов возрастает, а напряжение постепенно снижается. Чем меньше снижается напряжение при разряде элемента, тем больше возможностей его применения. Ёмкость элемента – это количество электричества, которое источник тока отдает при разряде. Она определяется массой реагентов и степенью их превращения. С увеличением тока разряда и снижением температуры ёмкость элемента снижается. Энергия элемента равна произведению его ёмкости на напряжение. Она возрастает с увеличением количества реагентов и с увеличением температуры. Удельная энергия – это энергия элемента, отнесенная к единице массы или объёма элемента. Более высокую удельную энергию можно получить в элементах с большим значением ЭДС, малой эквивалентной массой веществ и высокими степенями превращения реагентов. Сохраняемость – срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Химические источники первого рода В химических источниках первого рода восстановителями (анодами) обычно служат цинк или магний, в последнее время стал использоваться литий. В качестве окислителей (катодов) используют оксиды металлов (марганца, меди, ртути, серебра), хлориды меди и свинца, сульфид железа, а также кислород воздуха. Сухие химические источники тока первого рода называются так потому, что в них используется не жидкий электролит, а густая электролитная паста. Примером сухого элемента может быть марганцево-цинковый солевой элемент – элемент Лекланше (Рис.1). Его применяют для питания радиоаппаратуры, средств связи, магнитофонов, карманных фонарей и т.п. Анодом в этом элементе служит цинковый электрод, который является корпусом элемента. Катод – графитовый стержень с впрессованным в него диоксидом марганца MnO2. В качестве электролита используется паста, содержащая хлорид аммония NH4Cl с добавкой муки или крахмала. 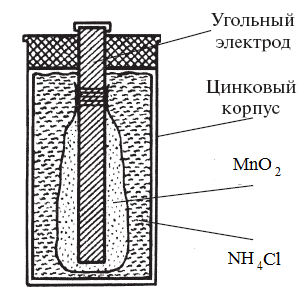 Рис.1. Схема марганцево-цинкового сухого солевого элемента (элемент Лекланше) Краткая схема элемента записывается следующим образом: (– ) A: Zn ǀ NH4Cl ǀ MnO2, C: K (+) На аноде происходит окисление цинкового корпуса Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2NH4Cl → [Zn(NH3)2]Cl2 + 2H+. На катоде восстанавливается диоксид марганца: MnO2 + ē + H+ → MnO(OH) Суммарное уравнение токообразующей реакции имеет вид: Zn0 + 2NH4Cl + 2MnO2 → [Zn(NH3)2]Cl2 + 2MnO(OH). Достоинства этого источника тока: недорогой, компактный, относительно безвредный, легко собирается в батарею, напряжение 1,3 В, удельная энергия 45 Вт·ч/кг. Недостатки: напряжение заметно падает во времени, особенно при отрицательных температурах, малый срок хранения (до 6 месяцев). В настоящее время большее распространение получили щелочные сухие источники тока. Ртутно-индиевый щелочной элемент. Анодом является электрод, изготовленный из сплава висмута и индия. Катод – угольный электрод с нанесенным на него оксидом ртути. Электролит – гидроксид калия, загущенный мукой или крахмалом. Краткая схема элемента: (– ) A: Bi; In ǀ KOH ǀ HgO, C: K (+) На аноде окисляется индий: In0 – 3ē → In3+; ионы индия связываются в комплексное соединение: 2In3+ + 6KOH + 6H2O → 2K3[In(OH)6] + 6H+ с последующим разложением комплексного соединения и образованием оксида индия: 2K3[In(OH)6] → In2О3 +6КОН + 3Н2О. На катоде восстанавливается оксид ртути: HgO + 2ē + 2H+ → Hg + H2O. Суммарная токообразующая реакция: 2In0 + 3HgO → 3Hg + In2О3. Применяется в наручных часах, в аппаратуре, где важно стабильное напряжение. Достоинства: имеет малые размеры, высокую удельную энергию (77 – 109 Вт·ч/кг), стабильное напряжение (1,17 В) и большой срок хранения (5 - 10 лет). Может работать при температуре до -20 0С. Серьезным недостатком является образование токсичной ртути и сложности утилизации отработавших элементов. Похожим на ртутно-индиевый элемент в устройстве и в работе является ртутно-цинковый сухой элемент. Анодом является цинковый корпус, в остальном устройство элемента такое же: (– ) A: Zn ǀ KOH ǀ HgO, C: K (+) На аноде происходит окисление цинка: Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+. На катоде восстанавливается оксид ртути: HgO + 2ē + 2H+ → Hg + H2O. Суммарная токообразующая реакция: Zn0 + 2КОН+ 2Н2О + HgO → К2[Zn(OH)4] + Hg. Характеристики: удельная энергия до 135 Вт·ч/кг, ЭДС 1,36 В, рабочая температура от -12 до +80 0С. Достоинства: стабильное напряжение, большой срок хранения, высокая удельная энергия, низкое внутреннее сопротивление. Недостатки: наличие токсичной ртути, сложность утилизации отработавших элементов. Применение: источники питания в электронных часах, кардиостиму-ляторах, слуховых аппаратах, фотоэкспонометрах, военных приборах ночного видения, переносной радиоаппаратуре военного назначения, в космических аппаратах. В настоящее время из-за токсичности ртути запрещены к использованию. Марганцево-цинковый щелочной элемент по своему устройству похож на элемент Лекланше, но в качестве электролита в нем используется гидроксид калия. Схема элемента: (– ) A: Zn ǀ КОН ǀ MnO2, C: K (+) На аноде происходит окисление цинка: Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+. На катоде восстанавливается диоксид марганца: MnO2 + ē + H+ → MnO(OH) Суммарное уравнение токообразующей реакции имеет вид: Zn0 + 2КОН+ 2Н2О + 2MnO2 → К2[Zn(OH)4] + 2MnO(OH). Достоинства: сохраняемость от 1,5 до 3 лет, удельная энергия 67 – 99 Вт·ч/кг, напряжение 1,5 В, рабочая температура от -40 до +55 оС. Используется в пультах дистанционного управления, в часах. Медно-окисный щелочной элемент В этом элементе вместо оксида токсичной ртути используется менее опасный оксид меди. Схема элемента: (– ) A: Zn ǀ KOH ǀ CuO : K (+) На аноде происходит окисление цинка: Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+. На катоде восстанавливается оксид меди: CuO + 2ē + 2H+ → Cu + H2O. Суммарная токообразующая реакция: Zn0 + 2КОН+ 2Н2О + CuO → К2[Zn(OH)4] + Cu. Характеристики элемента: удельная энергия 84 – 127 Вт·ч/кг, ЭДС 1,15 В, рабочая температура от -30 до +45 оС. Достоинствами являются высокая удельная энергия, способность работать в широком диапазоне температур, относительная безопасность, большой срок хранения. Недостатки: низкое напряжение, высокая цена. Аналогичное строение и принцип действия имеет серебряно-окисный сухой щелочной элемент. Схема элемента: (– ) A: Zn ǀ KOH ǀ Ag2O : K (+) На аноде происходит окисление цинка: Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+. На катоде восстанавливается оксид серебра: Ag2O + 2ē + 2H+ → 2Ag + H2O. Суммарная токообразующая реакция: Zn0 + 2КОН+ 2Н2О + Ag2O → К2[Zn(OH)4] + Ag. Достоинствами элемента являются высокое напряжение (1,6 В), долгий срок хранения (2 – 3 года), высокая удельная энергия, низкое внутреннее сопротивление, относительная безопасность. Недостатком серебряно-окисного элемента является высокая стоимость из-за использования в нем соединений серебра. Элемент используется в слуховых аппаратах, в радиоаппаратуре. Широкое распространение получил воздушно-цинковый сухой источник тока. В нем на катоде вместо оксидов металлов используется катализатор восстановления кислорода. Воздух подается в элемент через специальное отверстие. Схема элемента: (– ) A: Zn ǀ KOH ǀ O2, C: K (+) На аноде происходит окисление цинка: Zn0 – 2ē → Zn2+ с последующим связыванием ионов цинка в комплексное соединение: Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+. На катоде восстанавливается кислород воздуха: О2 + 4Н+ + 4ē → 2Н2О. Суммарная токообразующая реакция: 2Zn0 + 4КОН + 2Н2О + О2 → 2К2[Zn(OH)4]. Достоинства элемента: легкий, компактный, безопасный, стабильное напряжение 1,25 В, высокую удельную энергия более 450 Вт·ч/кг, рабочая температура от -20 до +35 оС. Недостатки: из-за высыхания электролита имеет небольшой срок хранения. Если воздух поступает на катод постоянно, элемент имеет высокий саморазряд, что также уменьшает срок хранения. Для устранения названных недостатков изготовляют элементы с плотно закрывающимся отверстием для подачи воздуха. В этом случае срок хранения элемента увеличивается до 3-х лет. Применяется, главным образом, как источник питания для слуховых аппаратов. Наливные источники тока, в отличие от сухих элементов, могут храниться долго без саморазряда, в рабочее состояние приводятся в момент заполнения элемента электролитом. Примером наливного элемента служит медно-хлоридно-магниевый источник тока. Анод изготовлен из магния, на катоде находится хлорид одновалентной меди. В качестве электролита используется хлорид натрия. Схема элемента: (– ) A: Mg ǀ NaCl ǀ CuCl: K (+) При попадании в элемент воды начинается химическая реакция. На аноде окисляется магний: Mg0 – 2ē → Mg2+; на катоде происходит восстановление хлорида меди: 2CuCl + 2ē → 2Cu0 + 2Cl-. Суммарная реакция: Mg0 + 2CuCl → 2Cu0 + MgCl2. Характеристики элемента: напряжение 1,3 В, удельная энергия 38 – 50 Вт·ч/кг, срок хранения в сухом виде – до 10 лет. После заполнения элемента водой он может работать 16 – 18 часов, так как имеет высокий саморазряд. Используется в качестве аварийных источников тока. Серебряно-магниевый наливной элемент состоит из магниевого анода, на катод нанесен слой хлорида серебра, а в качестве электролита заливается водный раствор хлорида натрия. Схема такого элемента: (– ) A: Mg ǀ Н2О, NaCl ǀ AgCl: K (+) При попадании в элемент воды начинается химическая реакция. На аноде окисляется магний: Mg0 – 2ē → Mg2+; Соли магния подвергаются гидролизу, то есть взаимодействуют с водой: Mg2+ + Н2О → MgОН+ + Н+. На катоде восстанавливается хлорид серебра: AgCl + ē → Ag0 + Cl-. Суммарная реакция имеет вид: Mg0 + 2AgCl + Н2О → MgОНCl + Ag0 + НCl. Такой элемент имеет высокую электропроводность – до 120 Вт·ч/кг, высокое напряжение – до 1,8 В, может работать от -20 до +60 оС. Также к его достоинствам можно отнести доступность, невысокую стоимость и безопасность. Недостаток – после заполнения водой имеет высокий саморазряд, может работать до 20 дней. Используется для питания аварийных систем подводных лодок, подводных прожекторов, аварийных маяков, мин, торпед, сигнальных устройств, радиогидроакустических буев и т. п В настоящее время получили распространение литиевые элементы с неводными электролитами, такими как пропиленкарбонат и диметоксиэтан. Литиевые источники работают на твердом электролите, что позволяет при минимальных размерах батареи получить сравнительно большую ёмкость и увеличить срок их службы. Достоинства таких элементов – большой срок службы (до 10 лет), удельная энергия до 600 Вт·ч/кг, высокое рабочее напряжение – до 3,5 В, способны работать в широком диапазоне температур. Литиевые элементы используются в имплантируемых слуховых аппаратах, кардиостимуляторах и водителях ритма сердца, в электронной аппаратуре, портативных компьютерах, кинокамерах и военной технике. 3. Химические источники второго рода В химических источниках второго рода (аккумуляторах) превращения энергии окислительно-восстановительной реакции в электрическую энергию могут проходить многократно, так как реакции на электродах являются обратимыми. После разрядки аккумулятор можно подключить к внешнему источнику постоянного тока, провести электролиз, в результате чего источник тока вновь будет готов к работе. Наиболее распространены кислотные свинцовые аккумуляторы. Такой аккумулятор состоит из нескольких электродов (положительных и отрицательных) и разделительных пористых пластин, изготовленных из материала, не взаимодействующего с кислотой, препятствующих замыканию электродов (сепараторов), которые погружены в электролит. Электроды представляют собой плоские решётки из металлического свинца. В современных аккумуляторах электродные решётки изготавливаются не из чистого свинца, а из сплава свинца с сурьмой с содержанием её 1—2 % для повышения прочности и эксплуатационных характеристик. В эти решётки запрессован порошок оксида свинца PbO. Применение порошков увеличивает поверхность раздела электролит – твердое вещество, тем самым увеличивает электрическую ёмкость аккумулятора. В качестве электролита используют 32 – 39 %-ный раствор серной кислоты H2SO4. Электрическая проводимость электролита зависит от концентрации серной кислоты и при комнатной температуре максимальна при плотности электролита 1,23 г/см³. Чем больше проводимость электролита, тем меньше внутреннее сопротивление аккумулятора, и, соответственно, ниже потери. Однако, на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, плотность до 1,29−1,31 г/см³, это связано с тем, что при низких концентрациях электролит может замёрзнуть, при замерзании образуется лёд, который может разорвать банки аккумулятора. При добавлении электролита в новый аккумулятор происходит реакция: PbO + H2SO4 → PbSO4 + H2O. Затем аккумулятор необходимо зарядить. Для этого его подключают к внешнему источнику постоянного тока. Под действием тока идет электролиз сульфата свинца. На катоде происходит восстановление: PbSO4 + 2ē → Pb0 + SO42-; на аноде происходит окисление: PbSO4 – 2ē + 2Н2О → PbО2 + SO42- + 4Н+. Суммарная реакция зарядки аккумулятора: 2PbSO4 + 2Н2О → PbО2 + Pb0 + 2H2SO4. Во время зарядки аккумулятора плотность электролита (следовательно, и концентрация кислоты) возрастает. После того, как весь сульфат свинца израсходуется в процессе электролиза, начинается электролиз воды: на катоде: 2Н2О + 2ē → Н20↑ + 2ОН-; на аноде: 2Н2О – 4ē → О20↑ + 4Н+. В этот момент из-за выделяющихся газов электролит «вскипает». Это нежелательное явление, при заряде его следует, по-возможности, избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Потери воды в результате электролиза восполняют доливкой в банки аккумулятора дистиллированной воды. Необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли. После зарядки аккумулятора его отключают от источника постоянного тока. Аккумулятор готов к использованию. Схема кислотного аккумулятора: (– ) A: Pb0 ǀ H2SO4ǀ PbО2: K (+) При работе (разрядке) аккумулятора тот электрод, который во время зарядки был катодом, при работе аккумулятора станет анодом (полюс отрицательный), на нем будет происходить окисление образовавшегося свинца: Pb0 + H2SO4 – 2ē → PbSO4 + 2Н+. Электрод, который во время зарядки аккумулятора был анодом, при работе станет катодом (полюс положительный), на нем будет происходить восстановление диоксида свинца: PbО2 + 2H2SO4 + 2ē → PbSO4 + 2Н2О + SO42-. Суммарное уравнение реакции разрядки аккумулятора: PbО2 + Pb0 + 2H2SO4 → 2PbSO4 + 2Н2О. Электродный потенциал катодного процесса равен +1,68 В, анодного процесса – 0,36 В. ЭДС аккумулятора равна 1,68 – (– 0,36) = 2,04 В. Характеристики аккумулятора: удельная энергия 30 – 60 Вт·ч/кг; рабочее напряжение 2 В; коэффициент полезного действия (КПД) 80 – 90 %, работает в диапазоне температур от – 40 до + 40 оС. Достоинства: высокий КПД, относительно стабильное напряжение, простой, недорогой. Недостатки: невысокая удельная энергия, высокий саморазряд при хранении, малый срок службы (2 – 5 лет), негерметичный, что часто приводит к утечке электролита – агрессивной жидкости, свинец – токсичный тяжелый металл, после окончания срока эксплуатации аккумулятор необходимо утилизировать на специальных предприятиях. Свинцовые аккумуляторы имеют большие размеры, очень тяжелые. Хранить свинцовые кислотные аккумуляторы необходимо только в заряженном состоянии, так как их хранение в разряженном состоянии быстро приводит к потере работоспособности аккумулятора. Для приготовления или разбавления электролита необходимо использовать только дистиллированную воду, так как присутствующие в обычной воде соли жёсткости (гидрокарбонаты, сульфаты и хлориды кальция и магния) значительно ухудшают параметры аккумулятора и снижают срок его службы. Нельзя допускать разряд аккумулятора ниже напряжения 1,75 В, так как это значительно снизит срок его эксплуатации. Большое распространение получили и щелочные никель-железные и никель-кадмиевые аккумуляторы. В таких аккумуляторах железный или кадмиевый электроды являются анодами, а катод изготовлен из гидроксида никеля (III) Ni(OH)3 (или его частично дегидратированной формы NiO(OH) – гидрата окиси никеля). В качестве электролита используется 20 – 23 %-ный раствор гидроксида калия КОН. Схема щелочного аккумулятора: (– ) A: Fe0 (Cd0) ǀ КОНǀ Ni(OH)3: K (+) При работе аккумулятора происходят следующие процессы: на аноде – окисление железа (или кадмия) Fe0 (Cd0) – 2ē + 2 OH- → Fe(OH)2 (Cd(OH)2); на катоде – восстановление гидроксида никеля (III) Ni(OH)3 + ē → Ni(OH)2 + OH-. Суммарное уравнение реакции работы щелочного аккумулятора: Fe0 (Cd0) + 2Ni(OH)3 → Fe(OH)2 (Cd(OH)2) + 2Ni(OH)2. Процесс зарядки происходит при подключении аккумулятора к источнику постоянного тока. При этом на катоде происходит восстановление гидроксида кадмия (железа): Fe(OH)2 (Cd(OH)2) + 2ē → Fe0 (Cd0) + 2ОН-; на аноде окисляется гидроксид никеля (II): Ni(OH)2 + OH- – ē → Ni(OH)3. Суммарное уравнение реакции зарядки щелочного аккумулятора: Fe(OH)2 (Cd(OH)2) + 2Ni(OH)2 → Fe0 (Cd0) + 2Ni(OH)3. Характеристики щелочных аккумуляторов: ЭДС никель-кадмиевого аккумулятора равна 1,45 В, для никель-железного – 1,48 В. Удельная энергия у железо-никелевого аккумулятора – до 20 Вт·ч/кг, у никель-кадмиевого – чуть выше – 45 – 65 Вт·ч/кг. Рабочее напряжение 1,35 – 1,0 В. Срок службы – более 10 лет. Саморазряд у железо-никелевых аккумуляторов составляет 20 – 40 % в месяц, у никель-кадмиевых – до 10 % в месяц. Рабочий диапазон температур от –40 до +40 оС. Достоинствами щелочных аккумуляторов являются большой срок службы, высокая механическая прочность, герметичность, меньшие размеры (по сравнению с кислотным аккумулятором), можно хранить разряженными, при зарядке практически не нагревается. Разогрев аккумулятора в процессе зарядки свидетельствует о завершении процесса и необходимости отключить аккумулятор от внешнего источника тока. Недостатки щелочных аккумуляторов: невысокий КПД 50 – 60 %, невысокое напряжение, низкая удельная энергия, высокая стоимость. Кадмий является токсичным металлом, поэтому никель-кадмиевые аккумуляторы после завершения эксплуатации требуют утилизации на специальных предприятиях. Используются в различной аппаратуре связи, использующей большой ток, радиоприемниках, электронной аппаратуре, для питания электрокаров, погрузчиков, для питания цепей управления трамваев и троллейбусов, в качестве бортовых аккумуляторных батарей самолётов и вертолётов, в фонарях для дайвинга, для резервного электропитания при наличии условий для зарядки, в системах электрооборудования пассажирских вагонов и т.п. Для повышения срока службы рекомендуется заряжать аккумулятор только после полной его разрядки (то есть, когда рабочее напряжение станет менее 1,0 В). В последнее время получили распространение никель-металлгидридные аккумуляторы. В таких аккумуляторах анодом является водородный металлгидридный электрод, (обычно гидрид никель-лантан или никель-литий), катодом – оксид (или гидрат оксида) никеля. В качестве электролита используют раствор гидроксида калия. Схема аккумулятора: (– ) A: МН ǀ КОНǀ NiО(OH): K (+) При работе аккумулятора на аноде происходит окисление гидрида металла по реакции: MН + OH- – ē → M + Н2О, на катоде восстанавливается гидрат оксида никеля: NiО(OH) + ē + Н2О → Ni(OH)2 + OH-. Суммарное уравнение реакции работы аккумулятора: MН + NiО(OH) → М + Ni(OH)2. При зарядке аккумулятора проходят следующие реакции: на катоде восстанавливается водород с образованием гидрида металла M + Н2О + ē → MН + OH-; на аноде окисляется гидроксид никеля (II) Ni(OH)2 + OH- – ē → NiО(OH) + Н2О. Суммарное уравнение реакции зарядки аккумулятора: М + Ni(OH)2 → MН + NiО(OH). Характеристики никель-металлгидридного аккумулятора: ЭДС 1,26 В, рабочее напряжение 1,2 В, удельная энергия 60 – 70 Вт·ч/кг, КПД 60 – 70 %, срок службы 2 – 5 лет, саморазряд 20 – 40 % в месяц, рабочий диапазон температур от -40 до +60 оС. Достоинства: экологически безопасный, компактный, большая, чем в никель-железный аккумуляторах, удельная энергия, нет «эффекта памяти» при зарядке не окончательно разрядившегося аккумулятора. Недостатки: небольшой срок службы, высокий саморазряд, разогрев аккумулятора при его зарядке. Никель-цинковые аккумуляторы состоят из цинкового анода и катода на основе гидрата оксида никеля, в качестве электролита используется раствор гидроксида калия. (– ) A: Zn0 ǀ КОНǀ NiO(OH): K (+). На аноде происходит окисление цинка с последующим образованием комплексного соединения: Zn0 – 2ē → Zn2+; Zn2+ + 2КОН + 2Н2О → К2[Zn(OH)4] + 2H+ на катоде – восстановлении гидрата оксида никеля: NiО(OH) + ē + Н2О → Ni(OH)2 + OH-. Суммарное уравнение реакции работы аккумулятора: Zn0 + 2 NiО(OH) + 2Н2О + 2КОН → К2[Zn(OH)4] + 2Ni(OH)2. При зарядке аккумулятора происходят обратные реакции: на катоде восстанавливается цинк: К2[Zn(OH)4] + 2ē → Zn0 + 2К+ + 4ОН-; на аноде окисляется гидроксид никеля (II): Ni(OH)2 + OH- – ē → NiО(OH) + Н2О. Суммарное уравнение реакции зарядки аккумулятора: К2[Zn(OH)4] + 2Ni(OH)2 → Zn0 + 2КОН + 2NiО(OH) + 2Н2О. Достоинства аккумулятора: высокое рабочее напряжение 1,6 В, удельная энергия 50 – 70 Вт·ч/кг, высокий КПД 70 – 75 %, экологическая безопасность. Недостатки: малый срок службы (всего 200 – 300 циклов заряд – разряд). Применяются в цифровых фотоаппаратах. Бромно-цинковый аккумулятор состоит из цинкового анода, угольного катода, адсорбирующего жидкий бром. В качестве электролита используется раствор бромида цинка. Схема аккумулятора: (– ) A: Zn0 ǀ ZnBr2ǀ Br2, C: K (+). При работе на аноде происходит окисление цинка: Zn0 – 2ē → Zn2+; на катоде восстанавливаются молекулы брома: Br2 + 2ē → 2Br-. Суммарное уравнение реакции имеет вид: Zn0 + Br2 → ZnBr2. Процесс зарядки представляет собой электролиз бромида цинка. На катоде восстанавливается цинк: Zn2+ + 2ē → Zn0; на аноде окисляются ионы брома: 2Br- – 2ē → Br2. Суммарное уравнение реакции имеет вид: ZnBr2 → Zn0 + Br2. Характеристики аккумулятора: удельная энергия 70 – 145 Вт·ч/кг, КПД 65 – 75 %, ЭДС 1,82 В, рабочее напряжение 1,7 В, рабочий диапазон температур 25 – 50 оС. Достоинства: высокая удельная энергия и КПД, высокое напряжение, недорогой. Недостатки: малый срок службы (до 2-х лет), небольшой рабочий диапазон температур, содержит токсичный бром. Серно-натриевый аккумулятор в качестве анода использует натрий, катод – сера в смеси с графитом. Электролитом служит твердый алюминат натрия, который при высоких температурах плавится и обеспечивает ионную проводимость. Схема аккумулятора: (– ) A: Na0 ǀ Na2O·xAl2O3ǀ S, C: K (+). При работе аккумулятора на аноде происходит окисление натрия: Na0 – ē → Na+; на катоде восстанавливается сера с образованием сульфид-ионов: S0 + 2 ē → S2-. Суммарное уравнение реакции работы серно-натриевого аккумулятора: 2 Na0 + S0 → Na2 S. Зарядка аккумулятора представляет собой процесс электролиза сульфида натрия. На катоде восстанавливается натрий: Na+ + ē → Na0; на аноде окисляются сульфид-ионы: S2- – 2ē → S0. Суммарное уравнение реакции зарядки серно-натриевого аккумулятора: Na2 S → 2Na0 + S0. Характеристики аккумулятора: удельная энергия 100 – 150 Вт·ч/кг, КПД 70 – 75 %, ЭДС – 2,1 В, рабочее напряжение 1,8 В, срок службы 3 – 5 лет, работает при температуре + 300 оС. Достоинства: работает при высоких температурах, высокая удельная энергия, КПД, напряжение, достаточно большой срок службы. Недостатки: очень дорогой, содержит щелочной металл, который в случае разрушения аккумулятора при высоких температурах может привести к пожару. Применяются для энергетического сдвига. Аккумуляторы накапливают энергию, например, в ночное время суток, в дневное время энергия используется. Таким образом, происходит экономия и перенос использования энергии с периода час-пик в период минимального расхода энергии. В последние годы получили широкое распространение литий-ионные и литий-полимерные аккумуляторы. В литий-ионном аккумуляторе в качестве анода используется литий. В качестве катодов используются кобальтат лития LiCoO2, литий-марганцевая шпинель LiMn2O4 или литий феррофосфат LiFePO4, так как ионы лития легко встраиваются в кристаллическую решетку этих материалов. Этот аккумулятор использует неводный электролит: этиленкарбонат или диэтиленкарбонат. При работе таких аккумуляторов на на аноде происходит окисление металлического лития, его ионы встраиваются в кристаллическую решетку катода, на котором происходит их восстановление. Зарядка аккумулятора представляет обратный процесс. Литий-полимерные аккумуляторы представляют собой усовершенствованные литий-ионные аккумуляторы. В них в качестве электролита используется полимерный материал с включением гелеобразного литий-проводящего наполнителя. Характеристики: рабочее напряжение 2,5 – 3 В, удельная энергия 80 – 120 Вт·ч/кг, КПД 60 – 70 %, число циклов заряд – разряд – 500 – 600. Саморазряд – до 3 % в месяц. Диапазон рабочих температур – от –20 до +60 оС. Достоинства: высокое и стабильное рабочее напряжение, отсутствие «эффекта памяти», высокая удельная энергия, низкий саморазряд, компактные размеры. Недостатки: малый срок службы, возможность воспламенения и взрыва при перезарядке (особенно в старых моделях), работают при невысоких токах. Применяются в современной бытовой электронной технике: компьютерах, ноутбуках, сотовых телефонах, радиоуправляемых моделях, цифровых фотоаппаратах, видеокамерах, также в в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. 4. Топливные элементы представляют собой устройства, в которые непрерывно и раздельно подаются к электродам восстановитель (топливо) и окислитель. На электродах проходят химические реакции, которые и являются источником энергии. Удельная энергия топливных элементов значительно выше энергии гальванических элементов. В качестве восстановителя обычно используют жидкое или газообразное топливо (водород, оксид углерода (II), метан, метанол) или мелко распыленное твердое топливо (уголь, кокс). В качестве окислителя обычно используют кислород воздуха. Рассмотрим устройство и принцип работы кислородно-водородного щелочного топливного элемента. Электроды такого элемента выполнены из никеля, который служит проводником электронов и является катализатором процессов окисления водорода и восстановления кислорода. Электроды сделаны в виде решеток, чтобы увеличить площадь поверхности. На анод подается водород, на катод – кислород воздуха. В качестве электролита используют раствор гидроксида калия. Схема щелочного топливного элемента: (– ) A: Н20 ǀ КОНǀ О2: K (+) На аноде происходит окисление водорода: Н2 – 2ē → 2Н+; на катоде восстанавливается кислород: О2 + 4Н+ + 4ē → 2Н2О. Суммарное уравнение реакции: 2Н2 + О2 → 2Н2О. Характеристики топливного элемента: ЭДС 1,23 В, КПД 60 – 70 %, удельная энергия до 800 Вт·ч/кг, работает при температурах 25 – 100 оС. Достоинства: высокая эффективность, экологическая безопасность. Недостатки: большие габариты, необходимость использовать источник водорода, взрыво- и пожароопасность элемента. Разработаны и другие виды топливных элементов. Например, топливный элемент, использующий в качестве электролита раствор фосфорной кислоты, может работать при температуре 200 оС, а топливные элементы, использующие в качестве электролита расплавы солей (Li2CO3, Na2CO3) или твердые ионные проводники (ZrO2+Y2O3), могут работать при температуре до 500 оС. Установки, состоящие из батареи топливных элементов, системы хранения, обработки и подачи топлива и окислителя, отвода продуктов реакции, называются электрохимической энергоустановкой. КПД таких установок составляет 60 – 70 %, что вдвое превышает КПД тепловых машин, они не загрязняют окружающую среду. В последнее время уделяется большое внимание разработке электрохимических установок, работающих на водороде и метане, для электромобилей. Ознакомиться с другими химическими источниками тока можно по ссылке https://ru.wikipedia.org/wiki/Химический_источник_тока |
