лабораторная физика. Лаба 6. I. Теоретическая часть 1 Определение понятия химических источников тока
 Скачать 114.5 Kb. Скачать 114.5 Kb.
|
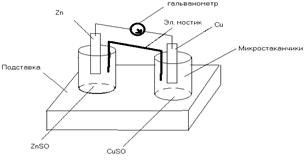
I. Теоретическая часть: 1)Определение понятия химических источников тока. Гальванический элемент- это система, состоящая из двух электродов в растворы электролитов, в которой за счет протекания ОВР возникает электрический ток, т.е. наблюдается превращение химической энергии в электрическую. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуется в процессе его работы. После расхода реагентов элемент не может больше работать. Таким образом, этот источник тока одноразового действия, поэтому его ещё называют первичным химическим источником тока. 2) Двойной электрический слой на границе раздела металл-раствор. 3)Уравнения Нернста. Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры выражается уравнением Нернста: Z -число электронов, участвующих в электродном процессе. После подстановки, а уравнение значений 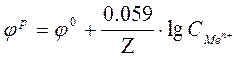 ,где ,где 4)Определение понятия анода и катода. Электрод с меньшим значением Электрод с большим значением 5)Вычисление ЭДС химических источников тока. ЭДС – это максимальная разность потенциалов между электродами, которая достигается при работе гальванического элемента: II Экспериментальная часть: Опыт 1. Тема: «Составление медно-цинкового гальванического элемента». Задание: сравнить значение теоретической ЭДС с экспериментальным значением. Результаты опыта: Значение ЭДС гальванического элемента, определенное экспериментально составляет 0,5В. Вычислим теоретическое значение ЭДС. Для этого:
1.Составим схему собранного элемента гальванического. Вычислим равновесные электродные потенциалы цинка и медиДля этого: а) Из справочных данных найдем значения стандартных электродных потенциалов: б) Рассчитываем значения равновесного потенциала 2.Установим анод и катод. Запишем процессы, протекающие на аноде и катоде: Поскольку Катод: На цинковом электроде будет протекать процесс окисления, то есть этот электрод будет анодом: Анод: Уравнения токообразующей реакции. а) В молекулярном виде: а) В ионном виде: Определим ЭДС гальванического элемента. Таким образом, Опыт 2. Тема: «Направление протекания О.В.Р.». Задание: определить направление протекания окислительно-востановительных реакции. Результаты опыта: 1.Рассчитаем прямую реакцию: Составим уравнения полуреакций окисления и восстановления для протекающей Окислительно-востановительной реакции. 2 Считая данные реакции токообразующеми при работе гальванического элемента, выпишем из таблицы значения соответствующих стандартных потенциалов и вычислим ЭДС прямой реакции: 11.Рассчитаем обратную реакцию: Составим уравнения полуреакций окисления и восстановления для протекающей Окислительно-востановительной реакции. Считая данные реакции токообразующеми при работе гальванического элемента, выпишем из таблицы значения соответствующих стандартных потенциалов и вычислим ЭДС прямой реакции: Уравняем данную реакцию методом электронно-ионного баланса Вывод:в ходе данной лабораторной работы мы ознакомились с электролитическими процессами, протекающими на электролитами, а так же изучили устройство медно-цинкового гальванического элемента. Министерство образования и науки РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Ижевский государственный технический университет имени М.Т. Калашникова» Факультет «Приборостроительный» Кафедра «Химия и химическая технология» Лабораторная работа № 6 «Химические источники тока» Выполнил студент гр. Б02-280-2 Титов М.Г Проверил к.т.н., доцент кафедры ХХТ Семакина Н. В. Ижевск, 2020 |