Лекция 7. Кислотные аккумуцляторы.. Аккумуляторы Аккумулятором называют
 Скачать 161 Kb. Скачать 161 Kb.
|
|
Лекция 7. Аккумуляторы Аккумулятором называют химический источник тока многократного действия. При разряде аккумулятора химическая энергия активных веществ, входящих в состав катода, анода и электролита, преобразуется в электрическую энергию, при этом активные вещества превращаются в продукты разряда. При заряде аккумулятора подводимая электрическая энергия расходуется на регенерацию продуктов разряда. В зависимости от состава электролита аккумуляторы бывают кислотными и щелочными. В кислотных аккумуляторах электролитом служит водный раствор серной кислоты (Н2SO4), в котором некоторая часть молекул последней распадается на положительные ионы водорода (Н2+) и отрицательные ионы кислотного остатка (SO4--). При этом раствор в целом остаётся электрически нейтральным. При погружении в электролит пластины из чистого свинца положительные ионы (Pb++) переходят в раствор электролита. Часть этих ионов, вступая в реакцию с ионами кислотного остатка, образуют нейтральные молекулы сульфата свинца (PbSO4), оседающего на пластине, что повышает концентрацию положительных ионов водорода в электролите. Сама пластина ввиду избытка электронов заражает отрицательно (отрицательный электрод). Если в электролит погрузить вторую пластину из диоксида свинца (PbO2), то ввиду повышенной концентрации ионов водорода диоксид свинца частично переходит в раствор, образуя положительные четырёхвалентные ионы свинца (Pb++++) и отрицательные ионы гидроксида (НО-). Сама пластина из-за избытка положительных ионов свинца заряжается положительно (положительный электрод). Повышение концентрации серной кислоты увеличивает потенциалы положительного и отрицательного электродов относительно электролита. Электродвижущая сила Е такого простейшего аккумулятора определяется разностью равновесных потенциалов положительного и отрицательного электродов относительно электролита и не зависит от размеров и конструкции самих электродов. При подключении к аккумулятору нагрузки под действием ЭДС во внешней цепи будет протекать ток, обусловленный перемещением электронов от отрицательного электрода, присоединяя на свой внешний энергетический уровень по два электрона, становятся двухвалентными ионами, которые, вступая в реакцию с отрицательными ионами кислотного остатка, образуют молекулы сульфата свинца. При уменьшении числа электронов на отрицательном электроде нарушается равновесное состояние, в результате чего новые положительные ионы свинца (Рb++) переходят в раствор электролита и вступают в реакцию с ионами кислотного остатка. Ток внутри аккумулятора обусловлен перемещением положительных ионов водорода к положительному электроду. При этом в результате взаимодействия ионов водорода с отрицательными ионами гидроксида образуются молекулы воды. Следовательно, при разряде аккумулятора на обоих электродах выделяется сульфат свинца и уменьшается плотность электролита. При заряде аккумулятора сульфат на одном электроде превращается в свинец, а на другом – в диоксид свинца РbО2, причём концентрация Н2SO4 в электролите повышается. Протекающие в кислотных аккумуляторах обратимые процессы можно изобразить следующим образом: Pb+РbО2+2H2SO42PbSO4+2H2O. При разряде равновесие сдвигается слева направо, а при заряде справа налево. Кроме того, при заряде на отрицательном электроде возможно восстановление ионов водорода и образование газообразного водорода. Электродвижущая сила полностью заряженного кислотного аккумулятора, зависящая от плотности электролита, лежит в пределах 2,06…2,15 В. плотность электролита заряженного аккумулятора составляет 1,21…1,3 г/см3. Верхний уровень плотности относится к стартерным аккумуляторам, эксплуатируемым в зимнее время. Изменение температуры незначительно влияет на ЭДС. Повышение температуры на 10C увеличивает ЭДС на 0,002…0,003 В. При разряде аккумулятора напряжение между его выводами всегда меньше ЭДС за счёт падения напряжения на омическом сопротивлении и поляризации электродов. Омическое сопротивление аккумулятора, представляющее собой сумму омических сопротивлений электролита, электродов и других токоведущих частей, не зависит от силы разрядного тока. Под поляризации электрода понимают разность между потенциалом электрода относительно электролита при разряде (или заряде) и его значением при равновесии. Отношение суммы поляризации положительного и отрицательного электродов к силе разрядного тока называется поляризационным сопротивлением. Это сопротивление зависит от силы тока. Внутреннее сопротивление аккумулятора при разряде rр представляет собой сумму поляризационного и омического сопротивлений. Поляризация аккумулятора связана, прежде всего, с изменением плотности электролита непосредственно у электродов, так как образование сульфата свинца, имеющего существенно больший объём по сравнению со свинцом или диоксидом свинца, затрудняет диффузию серной кислоты к активной массе электродов. Уменьшение плотности электролита непосредственно у пластин тем больше, чем больше разрядный ток. Кривые изменения напряжения во времени при разряде и заряде неизменным током показаны на рис. 1.3. Р 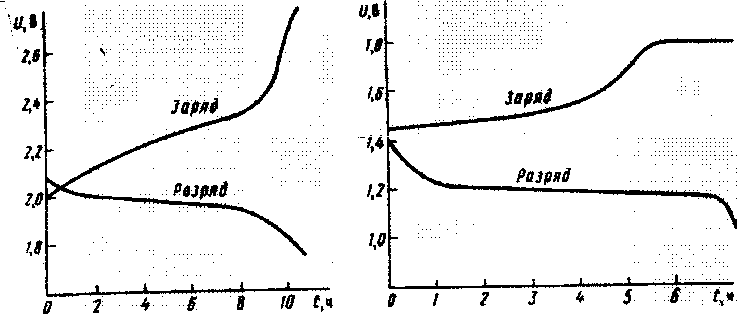 ис. 1.3. Напряжение и ЭДС кислотного аккумулятора при разряде и заряде. ис. 1.3. Напряжение и ЭДС кислотного аккумулятора при разряде и заряде.Как видно из рис. 1.3, разрядное напряжение быстро спадает до 2,0 В, затем медленно понижается до 1,8 В, после чего наблюдается резкое снижение напряжения. Предельное значение разрядного напряжения, до которого можно разряжать аккумулятор стационарного типа, составляет 1,8 В для режимов разряда не короче одночасового (аккумуляторов типа СН для режимов разряда не короче трёхчасового) и 1,75 В для более коротких режимов разряда. Дальнейший разряд приводит к образованию крупнокристаллического сульфата свинца на пластинах, что исключает возможность последующего эксплуатационного заряда аккумулятора. Номинальным напряжением принято считать напряжение 2,0 В. Количество электричества (Ач), которое может отдать полностью заряжённый аккумулятор при нормальных условиях разряда, указанных для него, называется номинальной ёмкостью. Под номинальной ёмкостью стационарных аккумуляторов, применяемых на предприятиях связи, понимают то количество электричества, которое он может отдать при 10 – часового режима разряда (СЦ) неизменном токе и температуре электролита +25С (для аккумуляторов типа СН принята температура +20С). Величина тока 10 - часового режима разряда численно равна частному от деления номинальной ёмкости на 10. Ёмкость аккумулятора зависит от его конструкции, количества активных материалов и режима разряда (тока разряда и температуры окружающей среды). При увеличении разрядного тока ёмкость, которую может отдать аккумулятор до достижения его предельного разрядного напряжения, уменьшается, так как при этом возрастают его поляризации и омические потери (например, для аккумулятора типа СН номинальной ёмкостью С10=72 Ач при часовом режиме разряда током 18 А завод – изготовитель гарантирует ёмкость С3=54 Ач). Поляризация и омическое сопротивление аккумулятора возрастают также с понижением температуры электролита. Под удельной ёмкостью аккумулятора понимают отношение его номинальной ёмкости к объёму или массе. Под энергией аккумулятора А понимают произведение его ёмкости С на среднее напряжение при разряде Ucp(A=Cucp). Отношение энергии аккумулятора, которую он отдаёт при разряде, к энергии, необходимой для его заряда А3при определённых условиях, называется отдачей по энергии (КПД аккумулятора). При заряде кислотного аккумулятора неизменным по величине током напряжение его сравнительно быстро возрастает до 2,10…2,15 В (рис. 1.3). Затем напряжение медленно растёт до 2,3…2,35 В по мере восстановления активной массы пластин и повышении плотности электролита. При напряжениях выше 2,4…2,5 В начинается бурное выделение водорода и кислорода, связанное с электролизом воды. К концу заряда, когда восстановление активных масс пластин закончено, энергия заряда расходуется только на электролиз воды. При этом напряжение на аккумуляторе остаётся неизменным. Температура электролита существенно влияет на напряжение во время его заряда. Понижение температуры, вызывающее увеличение его внутреннего зарядного сопротивления, приводит к повышению напряжения на нём. Следует отметить, что при низких температурах (близких к нулевой) не удаётся осуществить заряд кислотного аккумулятора, так как напряжение на нём сразу возрастает до значения, при котором начинается электролиз воды. В отключённом состоянии (без нагрузки) заряженный аккумулятор теряет часть запасной им ёмкости. Это явление носит название саморазряда. Саморазряд аккумулятора увеличивается с повышением плотности электролита и его температуры. На предприятиях связи в настоящее время находят широкое применение, как стационарные кислотные аккумуляторы, так и стартёрные. Каждый кислотный аккумулятор состоит из сосуда, изготовленного из кислотоустойчивого материала (стекло, пластмасса, деревянные сосуды, выложенные внутри свинцом), положительного и отрицательного электродов (пластин), разделителей между ними – сепаратов, электролита и токоведуших частей. В стационарных аккумуляторах открытого типа С и СК, не имеющих крышек, электролит непосредственно соприкасается с окружающим воздухом. Такие аккумуляторы требуют частой доливки воды и хорошо вентилируемого помещения. Положительными электродами в них служат поверхностные пластины, т.е. работающие за счёт своего поверхностного слоя. Такой электрод состоит из свинцовой пластины, на поверхности которой электрически формируется слой активной массы (PbO2). Для увеличения активной поверхности положительные пластины имеют ребристую форму. Отрицательными электродами в этих аккумуляторах служат коробчатые пластины. Пластины этого типа представляют собой решётку, в ячейках которой помещается активная масса. Для предотвращения выпадания активной массы из ячеек пластины закрываются перфорированными свинцовыми листами. В стационарных аккумуляторах закрытого типа положительные и отрицательные электроды представляют собой пастированные пластины (аккумуляторы типа СН). В пастированных электродах активная масса удерживается в решётке из свинцово-сурьмяного сплава толщиной 1…4 мм. Аккумулятор типа СН имеет в крышке специальную пробку, задерживающую аэрозоли серной кислоты. В аккумуляторах несколько отрицательных пластин соединяют параллельно. Между ними помещают положительные пластины, также соединённые параллельно. Параллельное соединение одноимённых пластин позволяет увеличить ёмкость аккумулятора. Каждая группа положительных и отрицательных пластин работает как одна пластина, площадь которой равна сумме площадей, проницаемых для раствора электролита (из вулканизированного каучука – ми пор, поливинилхлорида – ми пласт и стекловолокна). В условных обозначениях стационарных аккумуляторов открытого типа буква С обозначает «стационарный», две буквы СК указывают, что аккумуляторы пригодны для коротких режимов разряда большими токами. Число, стоящее после букв, указывает номер аккумулятора (С10=5328 Ач). минимальное время разряда аккумуляторов типа СК составляет 0,5 ч. при этом разрядный ток не должен превышать 25 А. на номер аккумулятора. Следовательно, допустимый разрядный ток аккумулятора СК-148 при длительности разряда 0,5 ч составит 148х25=3700 А, а ёмкость, которую он при этом может отдать, С0,5=0,5х3700=1850 Ач. удельная энергия аккумуляторов типа С и СК составляет 10…23 Втч/кг. Промышленность выпускает аккумуляторы типа С и СК ёмкостью от 36 до 5328 Ач (45 типов). В условном обозначении аккумуляторов закрытого типа СН, выпускаемых в Югославии цифры указывают не номер аккумулятора, а непосредственно его номинальную ёмкость С10 (аккумуляторы типа СН72…СН-1152). Эти аккумуляторы имеют несколько лучшие удельные показатели по сравнению с аккумуляторами типа СК и также пригодны для коротких режимов разряда. В настоящее время на предприятиях связи применяется в основном один способ эксплуатации батарей, составленных из аккумуляторов типа С, СК и СН – непрерывный подзаряд. При этом способе эксплуатации в условиях нормального электроснабжения (при наличии сети переменного тока) аппаратура питается от этих выпрямительных устройств. Полностью заряженная аккумуляторная батарея получает непрерывный подзаряд от этих выпрямительных устройств или от отдельного стабилизированного выпрямительного устройства (для компенсации саморазряда). Напряжение содержания (непрерывного подзаряда) аккумуляторной батареи определяется в зависимости от числа последовательно соединённых аккумуляторов из условия обеспечения напряжения 2,2 В2% на аккумулятор. При этом ток подзаряда 0,03А, где - индексный номер аккумулятора. В настоящее время в основном применяются послеаврийный (после её разряда на нагрузку) заряд батарей в две степени. На первой ступени заряд осуществляется стабильным зарядным током зар<0,25xC10до тех пор, пока напряжение на аккумуляторе не повысится до 2,30…2,35 В. На этой ступени заряда аккумулятор получает основной заряд энергии. Вторая ступень заряда происходит при стабильном напряжении 2,2 В на аккумулятор. Заряд считается законченным, когда зарядный ток спадает до 0,02…0,03 А на индексный номер аккумулятора. В переносной аппаратуре связи, а также на сельских АТС небольшой ёмкости, применяются щелочные аккумуляторы, которые в отличие от кислотных, могут эксплуатироваться при низких отрицательных температурах окружающей среды. Наибольшее применение находят щелочные никель-кадмиевые (НК) и никель-железные (НЖ) аккумуляторы. Активная масса положительных электродов состоит из гидроксида никеля (Ni Ooh), активная масса отрицательных электродов – соответственно из кадмия или железа. Электролитом служит раствор гидроксида калия КОН плотностью 1190…1210 кг/м3 с добавкой 20 г/л гидроксида лития (LiOH). Ёмкость КН-аккумуляторов при температуре – 20С составляет не менее 0,6 номинальной ёмкости. НК и НЖ-аккумуляторы чаще всего выполняются с ламельными электродами. Ламели – плоские коробочки из стальной никелированной перфорированной ленты, в которые набивают активную массу. Ламели закрепляют в рамки. Они образуют пластины электродов. Аккумуляторы, помещённые либо в стальные никелированные, либо в полиэтиленовые сосуды, представляют собой аккумуляторы закрытого типа (подобно кислотным аккумуляторам типа СН). В аппаратуре связи находят применение также герметичные никель-кадмиевые аккумуляторы без ламельными электродами. Герметичные аккумуляторы разделяют на дисковые (обозначаются Д), цилиндрические (ЦНК) и удельными значениями ёмкости и энергии, меньшим значением внутреннего сопротивления. Однако по сроку службы они уступают ламельным аккумуляторам. Электродвижущая сила щелочных аккумуляторов ниже, чем у кислотных, у полностью заряженного КН-аккумулятора ЭДС составляет 1,30...1,35 В; у НЖ-аккумулятора – 1,35…1,40 В. Кривые изменения напряжения на зажимах КН-аккумулятора при его разряде и заряде показаны на рис 1.4.  Рис. 1.4. Напряжение щелочного аккумулятора при разряде и заряде. Номинальное напряжение КН-аккумулятора составляет 1,2 В, напряжение в конце разряда – 1 В, конечное напряжение заряда – 1,75…1,8 В. НЖ-аккумуляторы, по сравнению с никель-кадмиевыми, характеризуются большим внутренним сопротивлением, меньшими удельными ёмкостью и энергией и большим саморазрядом. Кроме того, заряд НЖ-аккумуляторов должен производиться относительно большими зарядными токами, что делает их непригодными для эксплуатации в режиме непрерывного подзаряда. В современной технике находят применение щелочные серебряно-цинковые аккумуляторы, активными веществами в которых являются оксид серебра (AgO) и цинк, электролитом – раствор КОН. СЦ-аккумуляторы характеризуются высокой удельной энергией (до 130 Втч/кг), малым внутренним сопротивлением (тысячные доли ома) и малым саморазрядом. Номинальное их напряжение равно 1,5 В. недостатками СЦ-аккумуляторов являются высокая стоимость и малый срок службы (10…100 циклов заряда – разряда). Современные типы аккумуляторов В настоящее время на предприятиях связи наиболее широкое распространение получили свинцовые аккумуляторы (никель-кадмиевые АБ применяются только в особых случаях при жестких требованиях по температуре). Это связано с высокими технико-экономическими показателями свинцовых (кислотных) АБ – большой удельной энергоемкостью и малой стоимостью на единицу количества электричества. К достоинствам свинцовых аккумуляторов относятся также их высокая надежность и относительно низкие эксплуатационные затраты. Срок службы стационарных аккумуляторов может достигать 12... 15 лет, стартерных – 4…5 лет. По конструктивным особенностям аккумуляторы делятся на две большие группы – закрытого типа и герметичные. Закрытые негерметичные аккумуляторы (ЗНА) выпускают в настоящее время некоторые зарубежные фирмы. Основными представителями рынка негерметичных аккумуляторов для электросвязи являются корпорация COSLIGHT в Китае (серия GF), северо-американское предприятие «Телеком» (Nort American Telecom (серии OPzS, OPzL, Ogi, UPS, OpzS, Ogi), OLDHAM France (серии OPzS, LIC, UTC, NTC и др.) и т.д. [1, 2]. Все ЗНА можно условно разделить на два типа: конструкция с избыточным объемом электролита; конструкция с возможностью долива воды. Корпуса таких аккумуляторов выполняются из прозрачной пластмассы. Герметичные аккумуляторы изготавливаются из непрозрачной пластмассы. На верхней крышке расположены выходные клеммы и регулирующий клапан. Часто этот клапан скрыт декоративно-защитной панелью и его трудно обнаружить. Регулирующий клапан имеет принципиальное отличие от пробки ЗНА, хотя в некоторых моделях выглядит как заливная пробка. Он осуществляет одностороннее пропускание газов из бака аккумулятора наружу, снимает избыточное давление, но препятствует проникновению газообразных примесей внутрь бака. Герметичные аккумуляторы в зависимости от способа связи электролита делят на два типа: аккумуляторы с микропористым сепаратором, который пропитывается сернокислотным электролитом. Капиллярная структура сепаратора предотвращает вытекание электролита. По такому принципу строятся аккумуляторы фирм OLDHAM France (АБ типа OPzS, TC, EG, ESPACE и др.), YUASA и CHLORIDE; аккумуляторы с желеобразным силиконовым электролитом нетекучей, вязкой консистенции. Сепаратор в этом случае изготавливается аналогично «классическим» аккумуляторам. По такому принципу строятся аккумуляторы VARTA и HAGEN [3 и 4]. Во время эксплуатации закрытых и герметичных аккумуляторов обязательно должны соблюдаться следующие условия. 1. Содержание в режиме «плавающего заряда», т.е. превышение напряжения выпрямителя содержания над ЭДС АБ при любых изменениях этой ЭДС должно быть равно 0,14 В/элемент. Последнее равно напряжению поляризации кислотного аккумулятора. Величина ЭДС ЗНА и герметичных аккумуляторов различна. У герметичных она выше за счет более высокой концентрации электролита. Поэтому напряжение «плавающего заряда» в нормальных условиях равно: ЭДС + напряжение поляризации = 2,14+ 0,14 = 2,28 В/элемент. 2. Нестабильность напряжения «плавающего заряда» должна быть не более 1 %, поскольку рекомбинация газа наиболее эффективна при малом газовыделении. При большом газовыделении избыток нерекомбинированного газа сбрасывается через клапан, что отрицательно сказывается на долговечности АБ. 3. Требуется температурная компенсация напряжения «плавающего заряда». Понижение напряжения «плавающего заряда», как и понижение температуры, ведут к саморазряду и уменьшению гарантированного времени разряда до конечного напряжения. 4. Конечное напряжение разряда закрытых аккумуляторов может быть ниже, чем у открытых, благодаря лучшей диффузии активных веществ. Кроме того, эти аккумуляторы допускают разряд при низких температурах (рис. 15), хотя отдают при этом меньшую емкость. Несоблюдение перечисленных условий приводит к значительному сокращению срока службы АБ. Так, повышение температуры на 10 оС сокращает срок службы герметичных АБ в два раза, если номинальные параметры рассчитаны на температуру +20 оС. На закрытые батареи температура оказывает меньшее влияние, но оно тоже существенно. Электрические характеристики аккумуляторов 1. Емкость аккумулятора – это количество электричества, которое можно получить от аккумулятора в определенных условиях разряда. Номинальная емкость аккумулятора, приведенная к условному 10-часовому режиму разряда при температуре среды 20 оС, зависит от ряда факторов: тока разряда Iр, времени разряда tр и соответствующего ему коэффициента отдачи по емкости hQ, температуры окружающей среды tср: (1) где hQ находится в пределах от 0,51…1,0 (см. подраздел 3.1, табл. 10). 2. Номинальное напряжение аккумулятора – это напряжение на выводах полностью заряженного аккумулятора в течение первого часа разряда током 10-часового режима разряда при температуре электролита 20 С (Uэл.ном = 2 В). 3. Напряжение в конце разряда равно Uэл.кр = 1,75…1,8 В. При разряде аккумулятора токами, превышающими ток 10-часового режима разряда, напряжение в процессе разряда будет понижаться быстрее, чем в 10-часовом режиме и достигнет уровня 1,8 В, когда с аккумулятора еще не снята номинальная емкость. В таких случаях показателем окончания разряда является величина напряжения на одном элементе. 4. Величина напряжения для заряда должна быть больше ЭДС (E), так как зарядному току приходится преодолевать внутреннее сопротивление аккумулятора (напряжение поляризации, равное IзRвн): Uзар = = E + Iз Rвн = (2,14 + 0,14) В. 5. Внутреннее сопротивление аккумулятора Rвн складывается из сопротивления аккумуляторных пластин, сепаратора и электролита. Внутреннее сопротивление увеличивается по мере разряда в силу уменьшения плотности электролита, а также в связи с образованием сульфата свинца. Омическое сопротивление одного полностью заряженного элемента составляет примерно 0,0036 Ом, а в состоянии полного разряда – 0,007 Ом. 6. Плотность электролита заряженного аккумулятора составляет 1,25…1,3 г/см3, в состоянии разряда – 1,05 г/см3. Свинцовые кислотные аккумуляторы. План: Общее сведение об аккумуляторах, назначение; Типы аккумуляторов, конструкция; Электролит; Понятие об электрохимических процессах при заряде и разряде; Контрольные вопросы. 1.Аккумуляторами называются химические источники тока, предназначены для многократного использования. При разряде аккумулятора химическая энергия активных веществ, входящих в состав пластин «+» и «-» (электродов) и электролита, преобразуется в электрическую, при этом активные вещества превращаются в продукты разряда. При заряде аккумулятора подводимая электрическая энергия расходуется на регенерацию продуктов разряда. Современная техника располагает целым рядом электронакопительных устройств. Это: свинцовые, железо – никелевые, никель – кадмиевые, серебряно – цинковые, серно – натриевые, медно – литиевые и другие виды аккумуляторов. Наиболеераспространёнными являются свинцовые аккумуляторы. Экономичнее свинцового аккумулятора до сих пор ничего не изобретено. Широкое распространение они получили благодаря высокой надёжности и не высокой цене. Эксперты ООН считают, что в обозримом будущем свинцовые аккумуляторы сохранят своё значение как один из самых удобных источников электрической энергии. 2.Промышленностью (стран СНГ) выпускаются кислотные аккумуляторы различных типов. Для электропитания аппаратуры связи получили широкое применение стационарные аккумуляторы типов С, СК, СН. Находят также применение стартерные и другие типы аккумуляторов. Выпускается не менее 45 разновидностей аккумуляторов типов С и СК ёмкостью от 36 до 5328 А.ч. С – «стационарный»; СК – «стационарный», предназначенный для коротких режимов разряда большими токами. Аккумуляторы, имеющие в условном обозначении букву «К», отличаются тем, что у них соединительные шины между выводами имеют большое сечение. Аккумуляторы от С-1 до С-4 выполняются с соединительными шинами, допускающие короткие режимы разряда. СЗ Буква «3» - закрытое исполнение сосуда (бака); СЭ Буква «Э» - аккумулятор собран в эбонитовом баке. Число, стоящее вслед за буквами, указывает номер аккумулятора. Например: С-1, С-2, С-3, С-4, С-5 (индекс чередуется поочерёдно); С-6, С-8, С-10, С-12, . . . С-20 (индекс чередуется через «2»); С-24, С-28, С-32, С-36, . . . С-148 (индекс чередуется через «4»). Те же индексы используются для аккумуляторов типа СК. Номер (индекс) аккумулятора умноженный на число 36 даёт значение номинальной ёмкости при 10-часовом режиме разряда. СН - стационарный с намазными пластинами. Это аккумуляторы закрытого типа. Выпускаются ёмкостью от 40 до 800 А.ч. Число в обозначении аккумулятора – номер аккумулятора, получается как частное от деления номинальной ёмкости на число 40. Другими словами, номер аккумулятора * 40 = номинальная ёмкость аккумулятора типа СН. Пример: СН-1, СН-2, СН-3, СН-4, СН-5, СН-6, СН-8, СН-10, СН-20. Каждый кислотный аккумулятор состоит из сосуда, из кислотоустойчивого материала (стекло, пластмасса, керамика, деревянные сосуды, выложенные внутри свинца), положительного и отрицательных электродов (пластин), разделителей между ними – сепараторов, электролита и токоведущих частей. Блоки пластин (электродов) погружены в водный раствор серной кислоты (электролит). Электроды располагаются так, что каждый положительный электрод находится между двумя отрицательными, т.е. число «-» пластин на одну больше чем «+» пластин. Крайние пластины «-». Отводы от пластин одной полярности привариваются к мостикам, связывающим все группы этой полярности. Положительные пластины делятся на поверхностные (в аккумуляторах С и СК) и пастированные (в СН) . В стационарных аккумуляторах открытого типа С и СК электролит непосредственно соприкасается с окружающим воздухом. Такие аккумуляторы требуют частой доливки воды и хорошо вентилируемого (воздуха) помещения. Положительные пластины поверхностного типа работают за счёт своего поверхностного слоя. Такой электрод состоит из свинцовой пластины, на поверхности которой электрохимически формируется (при заряде) слой активной массы (РbO2). Для увеличения активной поверхности положительные пластины имеют ребристую форму. Отрицательные пластины в аккумуляторах С и СК – коробчатые пластины, представляют собой решётку, в ячейках которой помещается активная масса. Для предотвращения выпадения активной массы из ячеек пластин закрываются перфорированными свинцовыми листами. В аккумуляторах закрытого типа положительные и отрицательные электроды представляют собой пастированные пластины (аккумуляторы типа СН). В пастированных электродах активная масса удерживается в решётке из свинцово – сурьмяного сплава, толщиной 1. . . 4 мм. Аккумулятор типа СН имеет в крышке специальную пробку, задерживающую аэрозоли серной кислоты. В аккумуляторах несколько отрицательных пластин соединяют параллельно. Между ними помещают положительные пластины, также соединенные параллельно. Параллельное соединение одноимённых пластин позволяет увеличить ёмкость аккумулятора. Каждая группа «+» и «-» пластин работает как одна пластина, площадь которой равна сумме площадей, параллельно соединённых пластин Горизонтальные перемычки, соединяющие одноимённые пластины в банке, называют баретками. Сепараторы изготавливают из материалов, проницаемых для раствора электролита (из вулканизированного каучука - мипор, поливинилхлорида – мипласт (получаемый спеканием порошкообразной поливинилхлоридной смолы(широко используется)) и стекловолокна). 3. Аккумуляторы заливают электролитом, состоящим из водного раствора серной кислоты. Используется чиситал, аккумуляторная серная кислота (допустимая величине примесей нормируется). Дистиллированная вода должна отвечать требованиям по допустимости вредных примесей в соответствии с ГОСТ 6709-72. Дистиллированную воду следует хранить в закрытых стеклянных, полиэтиленовых или фторопластовых сосудах. Для первоначальной заливки в новые аккумуляторы типов С, СК, СН применяются электролит с удельным весом (плотностью) 1180 кг/м^3 (1,18 г/см^3 ) при температуре 25ºC. Полностью заряженные аккумуляторы С и СК имеют электролит плотностью 1210кг/м^3 (1,21 г/см^3), а типа СН – 1220кг/м^3 (1,22 г/см^3). При разряде плотность электролита снижается до 1,15÷1,17 г/см^3. Для приготовления раствора электролита следует пользоваться эбонитовыми, керамическими, винилпластовыми или деревянными, выложенными освинцованным листом, сосудами (баками). Стеклянные сосуды от нагревания могут лопнуть. Необходимо серную кислоту вливать в воду тонкой струёй, непрерывно размешивая раствор электролита стеклянной палочкой. ---- Концентрация или плотность электролита является точным критерием степени разреженности аккумулятора. Измеряется плотность электролита прибором – ареометром. ---- Многие вещества, например, незначительное количество солей железа, попадая в электролит ускоряют выделение водорода и увеличивают саморазряд аккумулятора. Поэтому при приготовлении электролита следует использовать только дистиллированную воду и использовать неметаллическую посуду. 4.Аккумуляторы являются химическими источниками электрической энергии. Зарядом аккумулятора называется превращение электрической энергии в химическую, а разрядом – химической в электрическую. Процесс разряда – является обратное заряду, когда сам аккумулятор отдаёт свой заряд во внешнюю электрическую цепь потребителю электроэнергии. Рассмотрим химические реакции при заряде и разряде кислотных (свинцовых) аккумуляторов. В растворе электролита происходит распад некоторой части молекул на положительные ионы водорода и отрицательные кислотного остатка. При разряде аккумулятора губчатый свинец отрицательного электрода вступает в реакцию с ионами кислотного остатка серной кислоты, в результате на «-» электроде осаждается сульфат свинца конечными продуктами реакции вблизи «+» электрода является сульфат свинца и вода. При заряде под действием электрического тока внешнего источника на отрицательном электроде восстанавливается губчатый свинец, а на положительном электроде – двуокись свинца. Водород воды раствора электролита взаимодействует с кислотным остатком сульфата свинца, в результате чего в растворе повышается содержание серной кислоты. Таким образом, суммарный процесс в свинцовом аккумуляторе при его разряде и заряде можно выразить уравнением: Pb (-) + PbO2 (+) + 2H2SO4 (разряд)→←(заряд) Pb (-)SO4 + Pb(+)SO4 + 2H2O Кроме того, при заряде на отрицательном электроде возможно восстановление ионов водорода и образование газообразного водорода. Контрольные вопросы Назовите активное вещество положительного электрода и отрицательного электрода кислотного аккумулятора в составлении заряда? Расшифровать условные обозначения аккумуляторов: С - ? СК -? CH -? Какие типы пластин используются в стационарных кислотных аккумуляторах типа С, СК, СН? Из чего состоит электролит кислотного аккумулятора? Назовите величину плотности электролита: Вновь приготовленного; В конце заряда; В конце разряда. 6 . Можно ли по величине плотности электролита судить о состоянии аккумулятора (о степени его разреженности)? Контрольные вопросы: Что является показателем состояния аккумулятора (заряда или разряда)? Почему по величине Е практически трудно судить о разряженности или заряженности аккумулятора? Оказывает ли температура электролита существенное влияние на величину? Что произойдет в аккумуляторе, если пользоваться « глубокими разрядами »? Поясните, что такое сульфатация пластин. Почему сульфатация пластин является очень вредной, значительной неисправностью, к чему она приводит? Назовите показатели заряда аккумулятора, их значения. Что происходит в кислотном аккумуляторе при его заряде, если напряжение на аккумуляторе достигает значения 2,4В/на элемент? Назовите условия снятия номинальной емкости. Почему «глубокие разряды» малыми токами длительное время, (когда напряжение не достигло предельно допустимого значения U к.р., а емкость уже отдана), вредны для аккумуляторов типа С? Как влияет величина тока разряда и время разряда на величину отдаваемой емкости? Если время разряда 0,5 часа, какая доля от номинальной емкости будет отдана аккумулятором? В долях единицы, в %. Почему снижение температуры tºC ведет к понижению отдаваемой емкости и наоборот? Чему равна номинальная емкость аккумуляторов С – 1 и СК – 1? С – 2 и СК – 3? С – 10 и СК – 10? Укажите формулу, по которой можно, определить, какой номинальной емкостью должен обладать аккумулятор, если он разряжается в условии разряда, отличающихся от номинальных условий (т.е. в более коротких режимах разряда). Что увеличивает саморазряд кислотных аккумуляторов? Назовите факторы, влияющие на величину отдачи кислотного аккумулятора. Литература: Бушуев В.М. Электропитание устройств связи: Учебник для техникумов – М.; Радио и связь, 1986. – 240С. Пионтковский Б.А., Серяков Н.И. Электропитание предприятий проводной связи: Учебник для техникумов – М.: Радио и связь, 1972.-С Л1. С 38 – 41 |
