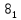химия ананьев. Химические свойства оксидов, оснований, кислот и солей. Получение кислот и солей Студент(ка) гр. 2282
 Скачать 68.08 Kb. Скачать 68.08 Kb.
|
|
мМИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №1 по дисциплине «Химия» Тема: Химические свойства оксидов, оснований, кислот и солей. Получение кислот и солей
Санкт-Петербург 2022 Цель работы. Ознакомление с методами получения оксидов, оснований, кислот, солей и изучение их химических свойств. Оксиды__Оксиды'>Основные теоретические положения Оксиды Оксиды – химические соединения, состоящие из двух элементов , один из которых кислород в степени окисления “-2”. Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2O), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды в свою очередь делятся на основные, кислотные и амфотерные.
Основания Основания – это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы (OH−) (по кол-ву (OH−) определяется кислотность). По растворимости в воде различают: Основания, растворимые в воде – щелочи (гидроксиды щелочных и щелочно-земельных металлов) Основания, нерастворимые в воде, например  , Fe(OH , Fe(OH , ,  Основания реагируют с кислотными оксидами и кислотами с образованием соли и воды и не реагируют с основными оксидами и щелочами Нерастворимые основания разлагаются при нагревании Кислоты Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода (H +) и анионы кислотных остатков . По наличию кислорода в своем составе кислоты делятся на бескислородные и кислородосодержащие. Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений, образуют соли и выделяют водород. (Водород не выделяется при взаимодействии металлов с азотной и концентрированной серной кислотами.) Кислоты реагируют с основными оксидами и основаниями, образуя соль и воду. Соли Соли – электролиты, при диссоциации которых образуются катионы основных остатков и анионы кислотных остатков. Соли делятся на средние, кислые и основные.
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида. Соли взаимодействуют с металлами. Более активные металлы (более активные восстановители) вытесняют менее активные из растворов их солей: 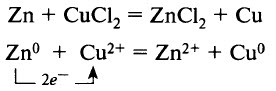 Растворы солей реагируют со щелочами Соли реагируют с кислотами Растворы солей реагируют друг с другом, если в результате реакции выпадает осадок (образуется нерастворимая соль):  Некоторые соли разлагаются при нагревании. Как правило, при нагревании разлагаются соли летучих кислот. Например, карбонаты (кроме карбонатов щелочных металлов) разлагаются с образованием углекислого газа и оксида металла: Протокол наблюдений
Выводы: Проделав лабораторную работу, можно сделать вывод о том что: Посредством реакции обмена можно получить различные гидроксиды, смешав растворы щёлочи и растворимой средней соли. Разные растворы нерастворимых оснований и щёлочей, взаимодействуя с соляной кислотой, производят растворимые средние соли и воду. Реакция между ними обменная (реакция нейтрализации). Растворы нерастворимых оснований реагируют (обменная реакция) с растворами щелочей, образуя при этом комплексные соли. При этом растворы гидроксидов цинка, хрома и алюминия реагировали как с щёлочью, так и с соляной кислотой, это доказывает амфотерность данных оснований Zn(OH  Cr(OH Cr(OH Al(OH Al(OH ). ).Растворы двух растворимых средних солей взаимодействуют, при этом получаются новые средние соли, одна из которых нерастворима. Основные кислоты образуются при реакции обмена растворимой средней соли с избытком щёлочи. При реакции обмена основной соли с щёлочью образуется нерастворимое основание и средняя соль. А при реакции обмена между основной солью и кислотой образуется новая средняя соль и вода. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


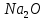
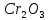 ,Z 𝑛𝑂,
,Z 𝑛𝑂, 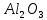 ,
, 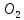 , 𝐶𝑂2, 𝑆𝑖𝑂2
, 𝐶𝑂2, 𝑆𝑖𝑂2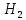 O
O