Лабораторная работа по химии №1 Отчет. химия ананьев. Химические свойства оксидов, оснований, кислот и солей. Получение кислот и солей Студент(ка) гр. 2282
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №1 по дисциплине «Химия» Тема: Химические свойства оксидов, оснований, кислот и солей. Получение кислот и солей
Санкт-Петербург 2022 Оксиды'>Цель работы. Ознакомление с методами получения оксидов, оснований, кислот, солей и изучение их химических свойств. Основные теоретические положения Оксиды Оксиды – химические соединения, состоящие из двух элементов , один из которых кислород в степени окисления “-2”. Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2O), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды в свою очередь делятся на основные, кислотные и амфотерные.
Основания Основания – это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы (OH−) (по кол-ву (OH−) определяется кислотность). По растворимости в воде различают: Основания, растворимые в воде – щелочи (гидроксиды щелочных и щелочно-земельных металлов) Основания, нерастворимые в воде, например 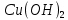 , Fe(OH , Fe(OH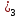 , , 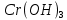 Основания реагируют с кислотными оксидами и кислотами с образованием соли и воды и не реагируют с основными оксидами и щелочами Нерастворимые основания разлагаются при нагревании Кислоты Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода (H +) и анионы кислотных остатков . По наличию кислорода в своем составе кислоты делятся на бескислородные и кислородосодержащие. Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений, образуют соли и выделяют водород. (Водород не выделяется при взаимодействии металлов с азотной и концентрированной серной кислотами.) Кислоты реагируют с основными оксидами и основаниями, образуя соль и воду. Соли Соли – электролиты, при диссоциации которых образуются катионы основных остатков и анионы кислотных остатков. Соли делятся на средние, кислые и основные.
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида. Соли взаимодействуют с металлами. Более активные металлы (более активные восстановители) вытесняют менее активные из растворов их солей: 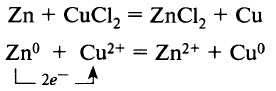 Растворы солей реагируют со щелочами Соли реагируют с кислотами Растворы солей реагируют друг с другом, если в результате реакции выпадает осадок (образуется нерастворимая соль): 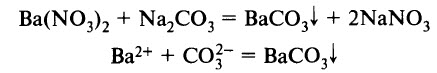 Некоторые соли разлагаются при нагревании. Как правило, при нагревании разлагаются соли летучих кислот. Например, карбонаты (кроме карбонатов щелочных металлов) разлагаются с образованием углекислого газа и оксида металла:     Протокол наблюдений
| |||||||||||||||||||||||||||||||||||||||||||||||||||

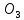
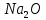
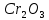 ,Z 𝑛𝑂,
,Z 𝑛𝑂, 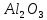 ,
, 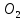 , 𝐶𝑂2, 𝑆𝑖𝑂2
, 𝐶𝑂2, 𝑆𝑖𝑂2