|
Белки. химия белка (Не знаю ответ, ответ был дан выше)
Билет 2, 13
Первичная структура белка и связи, ее стабилизирующие. Написать трипептид лиз-ала-фен.
|
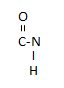 Первичная структура белка – линейная последовательность аминокислотных остатков в полипептидной цепи. Первичная структура белка – линейная последовательность аминокислотных остатков в полипептидной цепи.
Связи: пептидная
Полипептидная цепь имеет два неоднаковых конца:
- первая аминокислота содержит свободную α-аминогруппу (N–конец); последняя аминокислота имеет свободную карбоксигруппу (С–конец).
Поэтому первичную структуру можно представить себе как последовательность (чередование) пептидных связей и α-углеродных атомов аминокислот, а радикалы аминокислот находятся сбоку от этой цепочки.
(принцип построения трипептида см выше)
|
К какому полюсу при электрофорезе будут передвигаться белки с преобладанием диаминовых аминокислот при рН 7.0
|
Аминогруппа – положительно заряжена => белки с преобладанием диаминовых аминокислот будут двигаться к аноду (отрицательно заряженный полюс)
|
Что такое нуклеозид, его отличие от нуклеотида. Написать формулы.
|
Нуклеозид = азотистое основание + углевод
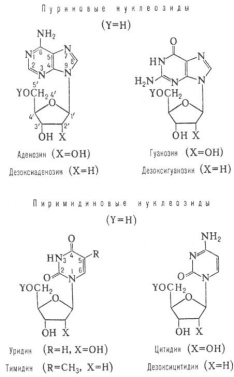
Нуклеотид = нуклеозид + фосфорная кислота (Н3РО4)
|
Характеристика альбуминов и глобулинов.
|
Альбумины
|
Глобулины
|
простые глобулярные белки
|
простые глобулярные белки
|
Молекулярная масса 70 000 дальтон
|
Молекулярная масса
150 000 Д
|
Растворимы в воде
|
Нерастворимы в воде
|
ИЭТ 5
|
ИЭТ 7
|
Высаливаются 100% сульфатом аммония (NH2SO4)
|
Высаливаются 50% сульфатом аммония (NH2SO4)
|
Синтезируются в печени
|
Синтезируются в печени и В-лимфоцитами (γ-глобулины = АТ)
|
Много в организме
|
|
|
Имеют ряд фракций (α1, α2, β, γ)
|
Депо Б, осморегуляция, неспецифическая защита, транспорт (лекарств, металлов, холестерина, билирубина, гормонов), антиоксидантный эффект
|
Каталитическая, транспортная, иммунологическая, защитная (Б острой фазы воспаления)
|
|
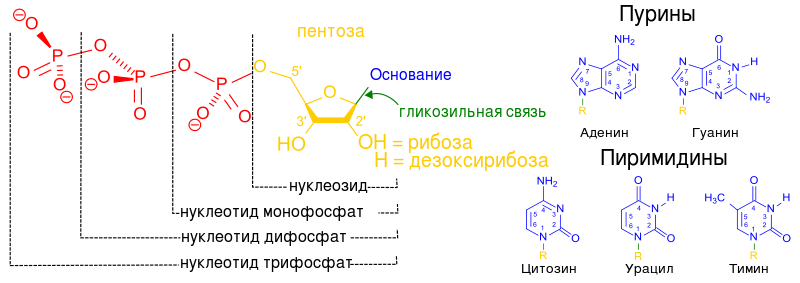
Написать азотистые пуриновые основания, входящие в состав ДНК, назвать их.
|
|
Билет 3, 14
Классификация белков. (+в билете 14 -Характеристика глобулинов)
|
Белки
Простые
|
Сложные
|
Альбумины
|
Гемопротеины
|
Глобулины
|
Флавопротеины
|
Гистоны
|
Магнийпорфирины
|
Протамины
|
Сu-содержищие
|
Протеиноиды
|
…
|
(характеристику глобулинов см выше)
|
Третичная структура белка и связи, ее стабилизирующие. Белки известной третичной структурой.
|
Третичная структура белка – трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи:
Гидрофобные взаимодействия (между гидрофобными R аминокислот(АК) внутри структуры растворимых в воде белков)
Ван дер Ваальсовы силы (между прилегающими друг к другу атомами)
Водородные (между гидрофильными группами (-ОН, -СОNH2, -SH) и любыми другими гидрофильными группами)
Ионные (между отрицательно заряженными карбоксильными (-СООН-) группами R аспарагиновой и глутаминовой кислот и положительно заряженными группами R лизин, аргинина, гистидина)
Ковалентные дисульфидные (между SH-группами двух остатков цистеина) – стабилизируют структуру
Белки с третичной структурой: миоглобин
|
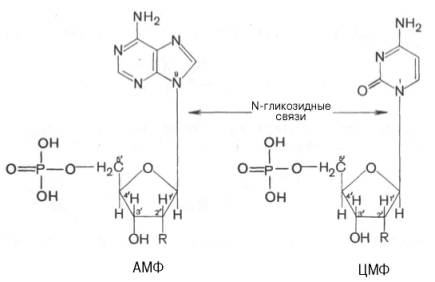
Что такое адениловая система. Написать компоненты адениловой системы.
|
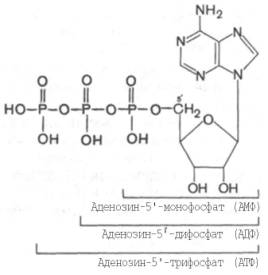 Адениловая система – система адениловых нуклеотидов, которая включает в себя АТФ, АДФ, АМФ, неорганический фосфат и ионы Mg2+. Адениловая система – система адениловых нуклеотидов, которая включает в себя АТФ, АДФ, АМФ, неорганический фосфат и ионы Mg2+.
Роль: энергообмен (для синтеза, активного транспорта, мышечной работы…)
Компоненты:
АТФ, АДФ, АМФ, неорганический фосфат и ионы Mg2+
|
Какой заряд несут белки сыворотки крови, если ИЭТ альбумина 4,7; глобулина 6,7. рН крови 7,36.
|
Отрицательный заряд, т.к. ИЭТ <7 => кислая среда, а кислые белки отрицательно заряжены.
|
Билет 4, 15
Денатурация: понятие, виды, значение, факторы, ее вызывающие.
|
(денатурацию см выше)
|
Биологическая роль и первичная структура ДНК.
|
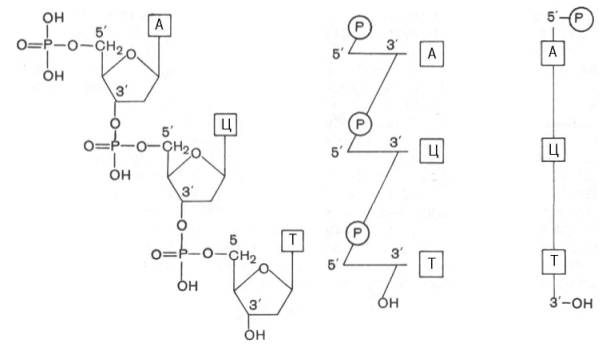 Первичная структура ДНК – последовательность расположения мононуклеотидов в цепи. Первичная структура ДНК – последовательность расположения мононуклеотидов в цепи.
Связь: 3’,5’-фосфодиэфирная
Биологическая роль: универсальный хранитель и источник наследственной информации
|
Написать и назвать трипептид цис-тир-иле. В какой области рН он будет находиться в изоэлектрическом состоянии.
|
(принцип построения трипептида см выше)
ИЭТ = 7, т.к. нет дополнительных положительно или отрицательно заряженных групп.
|
Сложные белки. Характеристика хромо- и нуклеопротеинов.
|
(сложные белки см выше)
(характеристику хромопротеинов см выше)
Характеристика нуклеопротеинов
Состав: Б+Нуклеиновая кислота
Виды: дезоксирибонуклеопротеины (ДНП), рибонуклеопротеины (РНП)
Локализация: ДНП – в ядре, митоходриях; РНП – в цитоплазме, ядрышке
Функции: хранение информации (т.к. в состав входит ДНК или РНК), компактизация (т.к. ДНП входит в состав мононуклеосом, которые являются составной частью хромосомы)
Белковый состав ДНП – гистоны имеют 5 классов Н1 (богаты лизином), Н2А (богатые аргинин+лизин), Н2В (умеренно богатые арг+лиз), Н3 (богатые арг), Н4 (богатые глицином+арг)
|
Написать и назвать нуклеотид, где азотистым основанием является аденин.
|
(принцип построения нуклеотида см выше)
Название: аденозинмонофосфат
|
Билет 5
Характеристика простых белков. Характеристика альбуминов.
|
Простые белки – построены из остатков аминокислот и при гидролизе распадаются только на свободные аминокислоты.
Группы простых белков: альбумины, глобулины, гистоны, протамины, протеиноиды
Сложный белок
|
Характеристика
|
Липопротеины
|
= Б+липид
Липиды в составе: нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды
Виды: ЛП (Л>Б), ПЛ (Л<Б)
Где встречаются: в составе клеточной мембраны и внутриклеточных мембран ядра, митохондрий, микросом, в свободном состоянии в плазме крови
Примеры: тромбопластический белок ткани легких, липовителлин желтка
Функции: ПЛ – структурная, комплексная организация миелиновых оболочек, нервной ткани, хлоропластов, фоторецепторной и электронно-транспортной систем, палочек и колбочек сетчатки; ЛП - транспорт холестерина
Где синтезируются: в печени или слизистой оболочке кишечника
Липопротеины сыворотки крови: ЛП низкой плотности (ЛПНП), ЛП очень низкой плотности (ЛПОНП), ЛП высокой плотности (ЛПВП), ЛП очень высокой плотности (ЛПОВП), ЛП промежуточной плотности (ЛППП)
|
Хромопротеины
|
= простой белок+окрашенный небелковый компонент.
Виды:
Гемопротеины (глобулярный Б+Fe)
Цвет: красный
Пример: гемоглобин (4цепи Б глобина+4гема = четвертичная структура), миоглобин (третичная структура), цитохромы, каталаза, пероксидаза
Флавопротеины (Б+ КоФермент (ФМН или ФАД))
Цвет: желтый
Пример: ксантиноксидаза, альдегидоксидаза, СДГ, транспортирующий электроны флавопротеин
Магнийпорфирины (Б+Mg)
Цвет: зеленый
Примеры: хлорофилл
Б+Cu
Цвет: голубые
Б+А витамин
Цвет: оранжевый
Пример: родопсин
Функция: участие в фотосинтезе, дыхании, транспорте О2 и СО2, ОВР, свето- и цветовосприятие.
|
Нуклеопротеины
|
= Б+Нуклеиновая кислота
Виды: дезоксирибонуклеопротеины (ДНП), рибонуклеопротеины (РНП)
Локализация: ДНП – в ядре, митоходриях; РНП – в цитоплазме, ядрышке
Функции: хранение информации (т.к. в состав входит ДНК или РНК), компактизация (т.к. ДНП входит в состав мононуклеосом, которые являются составной частью хромосомы)аа
Белковый состав ДНП – гистоны имеют 5 классов Н1 (богаты лизином), Н2А (богатые аргинин+лизин), Н2В (умеренно богатые арг+лиз), Н3 (богатые арг), Н4 (богатые глицином+арг)
|
Гликопротеины
|
= Б(полипептид)+углевод(олигосахарид)
Виды: ПГ (У>Б), ГП (У<Б), ГАГ
Связи: О-гликозидные, N-гликозидные, эфирные гликозидные связи со свободными СООН-группами глутаминовой и асарагиновой кислот.
Примеры ГАГ: гиалуроновая кислота, гепарин
Примеры ГП: белковые гормоны, мембранные сложные белки, иммуноглобулины, белки плазмы крови, интерфероны…
Функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, защитное, гормональное, антивирусное действие
Где синтезируются: в рибосомах ЭПС(в цистронах), затем присоединяются сахарные цепи, и далее белок транспортируется до мембран клетки
|
Фосфопротеины
|
= Б+Фосфорная кислота
Пример: казеиноген молока, фосфитин, ихтулин
Где находится: желток, белок, икра рыб, клетки ЦНС
Функция: источники энергетического и пластического материала в процессе эмбриогенеза, постнатального роста и развития организма.
|
Металлопротеины
|
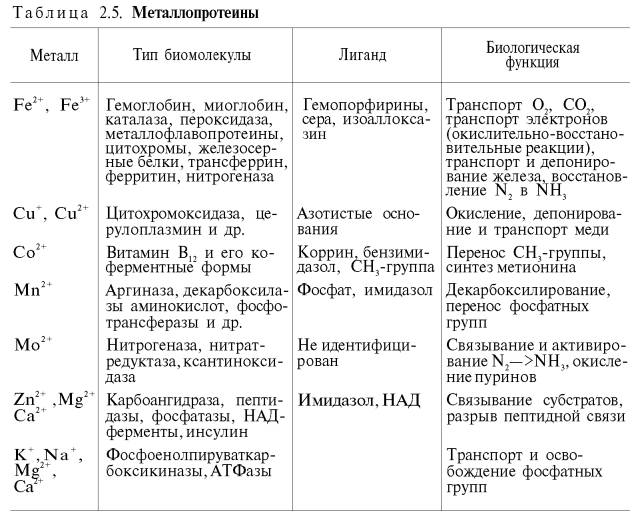
|
(характеристику альбуминов см выше)
|
Биологическая роль и структура РНК.
|
Рибонуклеиновые кислоты (РНК) - одноцепочечные молекулы разной длины.
Структура РНК:
1) Первичная: Последовательность нуклеотидов различных РНК, содержащихся в клетке определяется последовательностью нуклеотидов в ДНК-матрице.
2) Вторичная
3) Третичная
Виды:
1) Рибосомальные РНК (рРНК) составляют до 80-90% от всей РНК клетки. Они содержатся в рибосомах - внутриклеточных органеллах, принимающих участие в биосинтезе белка.
2) Матричные РНК (мРНК) составляют около 5% общей массы рибонуклеиновых кислот клетки.
Молекулярная масса колеблется: от300 тыс до 2млн.
Функция: перенос генетической информации, записанной в ДНК, на синтезируемый белок.
Нуклеотидный состав мРНК подобен нуклеотидному составу одного из участков цепи ДНК (кодоген в ДНК определяет кодон в мРНК)
Находятся: в ядре (где они синтезируются) и в цитоплазме.
3) Транспортные РНК (тРНК)
Функции: доставка аминокислот к рибосомам, взаимодействие с мРНК и рибосомами в процессе биосинтеза белка.
Для перноса каждой аминокислоты имеется своя собственная тРНК, а для некоторых из них известно несколько тРНК и общее число видов тРНК доходит до 60.
|
Вторичная структура белка.
|
Вторичная структура белка – это размещение в пространстве отдельных участков полипептидной цепи, эти участки могут быть упорядоченными (α–спираль и β–структура) и неупорядоченными.
Виды:
α–спираль.
Закручивание молекулы белка в спираль (правозакрученная) выгодно энергетически, так как способствует более плотной упаковке молекулы в пространстве и уменьшению ее свободной энергии (2-ой закон термодинамики).
Связи: дисульфидные и водородные.
На 1 шаг спирали приходится 3,6 остатка аминокислот, длина шага 5,44нм, радиус спирали 0,25 нм. Некоторые белки спирализованы на 100%, другие вовсе лишены спиралей. Факторы, которые мешают образованию α–спиралей:
расположение подряд нескольких одноименно заряженных аминокислот (взаимное отталкивание), или аминокислот с большими радикалами (пространственное несоответствие).
аминокислота пролин, которая является фактически иминокислотой и резко меняет направление полипептидной цепи.
β – структуры - складчатый слой.
Связи: водородные.
Подобную структуру имеют фибриллярные белки (коллаген).
Неупорядоченные структуры - это неупорядоченное расположение белковой цепи в пространстве.
|
К какому полюсу при электрофорезе будут передвигаться белки с преобладанием дикарбоновых аминокислот при рН 7,0. Написать трипептид асп-ала-глу.
|
Аминогруппа – положительно заряжена => белки с преобладанием диаминовых аминокислот будут двигаться к аноду (отрицательно заряженный полюс)
(принцип построения трипептида см выше)
|
Соединить два мононуклеотида дезокси-адениловую и дезокси-цитидиловую кислоты.
|
(принцип соединения мононуклеотидов см выше)
| |
|
|
 Скачать 5.67 Mb.
Скачать 5.67 Mb.