|
|
Белки. химия белка (Не знаю ответ, ответ был дан выше)
Билеты к зачету по теме «ХИМИЯ БЕЛКА» (Не знаю ответ, ответ был дан выше)
Билет 1, 12
Классификация аминокислот по характеру радикала.
|
Классификация 1.
Алифатические:

|
Глицин
|
Gly
|

|
Аланин
|
Ala
|

|
Валин *
|
Val
|

|
Лейцин *
|
Leu
|

|
Изолейцин *
|
ILe
|
OH-содержащие

|
Серин
|
Ser
|

|
Треонин *
|
Thr
|
СООН-содержащие

|
Аспарагиновая кислота (аспартат)
|
Asp
|

|
Глутаминовая кислота (глутамат)
|
Glu
|
NH2CO-содержащие

|
Аспарагин
|
Asn
|

|
Глутамин
|
Gln
|
NH2-содержащие

|
Лизин *
|
Lys
|

|
Аргинин
|
Arg
|
S-содержащие

|
Цистеин
|
Cys
|

|
Метионин*
|
Met
|
Ароматичиские

|
Фенилаланин *
|
Phe
|

|
Тирозин
|
Tyr
|
Гетероциклические

|
Триптофан *
|
Trp
|

|
Гистидин
|
His
|
Иминокислота
-

|
Пролин
|
Pro
|
Классификация 2.
Неполярные R
Глицин
|

|
Аланин
|

|
Валин
|

|
Лейцин
|

|
Изолейцин
|

|
Пролин
|

|
Полярные, незаряженные R
Серин
|

|
Треонин
|

|
Цистеин
|

|
Метионин
|

|
Аспаргин
|

|
Глутамин
|

|
Ароматические R
Фенилаланин
|

|
Тирозин
|

|
Триптофан
|

|
Отрицательно заряженные R
Аспарагиновая кислота
|

|
Глутаминовая кислота
|

|
Положительно заряженные R
-

|
Денатурация белка. Факторы, ее вызывающие. Виды денатураций. Значение.
|
Денатурация белка – потеря нативной конформации под действием различных факторов, сопровождающийся утратой свойств и специфической функции белков. (первичная структура не нарушается).
Внешнее проявление денатурации: потеря растворимости (особенно в ИЭТ), повышенная вязкость раствора, увеличение количества свободных SH-групп, ищменение характера рассеивания рентгеновских лучей.
Факторы:
Высокая температура (более 50оС), увеличивающая тепловое движение атомов в молекуле и => приводящая к разрыву слабых связей
Интенсивное встряхивание раствора, => соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и => изменению конформации этих молекул
Органические вещества (этиловый спирт, фенол, мочевина) способны взаимодействовать с функциональными группами белков, => к конформационным изменениям
Кислоты и щелочи, изменяя рН среды, => вызывают перераспределение связей в молекуле белка
Соли тяжелых металлов (медь, ртуть, свинец) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), => изменяя их конформацию и активность
Детергенты – вещества, содержащие гидрофобный углеводородный R и гидрофильную функциональную группу (амфифильное вещество). Гидрофобные R белков взаимодействуют с гидрофобными R детергентов, => изменение конформации белков.
Виды:
Обратимая денатурация (ренатурация) – процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
Необратимая денатурация – процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Значение:
1) при получении ферментов или других биологически активных белковых препаратов
2) при отравлениях солями тяжелых металлов
|
На примере 2х мононуклеотидов показать, как они соединяются в полинуклеотидную цепь.
|
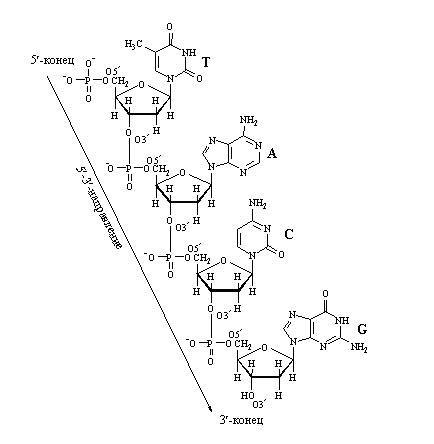
(принцип связи двух мононуклеотидов тот же)
|
В какой области pH (кислой, щелочной, нейтральной) находится ИЭТ трипептида гис-лиз-тре? Написать трипептид, указать N- и С- концевые аминокислотные остатки в молекуле.
|
В щелочной, т.к. гистидин и лизин – положительно заряженные аминокислоты (содержат аминогруппу).
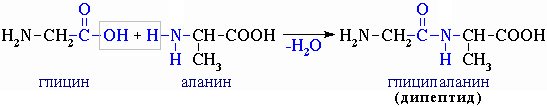
Окончания у АК: ил-ил-ин
(принцип построения трипептида тот же)
|
Характеристика хромо- и фосфопротеинов.
|
Хромопротеины = простой белок+окрашенный небелковый компонент.
Виды:
Гемопротеины (глобулярный Б+Fe)
Цвет: красный
Пример: гемоглобин (4цепи Б глобина+4гема = четвертичная структура), миоглобин (третичная структура), цитохромы, каталаза, пероксидаза
Флавопротеины (Б+ КоФермент (ФМН или ФАД))
Цвет: желтый
Пример: ксантиноксидаза, альдегидоксидаза, СДГ, транспортирующий электроны флавопротеин
Магнийпорфирины (Б+Mg)
Цвет: зеленый
Примеры: хлорофилл
Б+Cu
Цвет: голубые
Б+А витамин
Цвет: оранжевый
Пример: родопсин
Функция: участие в фотосинтезе, дыхании, транспорте О2 и СО2, ОВР, свето- и цветовосприятие.
Фосфопротеины = Б+Фосфорная кислота
Пример: казеиноген молока, фосфитин, ихтулин
Где находится: желток, белок, икра рыб, клетки ЦНС
Функция: источники энергетического и пластического материала в процессе эмбриогенеза, постнатального роста и развития организма. 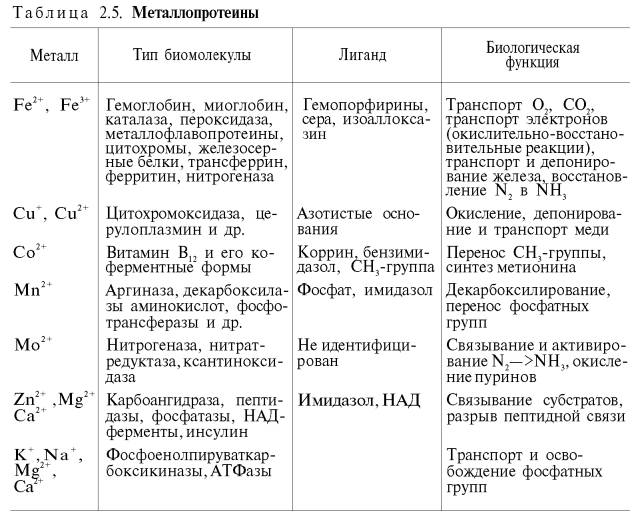
| |
|
|
 Скачать 5.67 Mb.
Скачать 5.67 Mb.