|
|
Белки. химия белка (Не знаю ответ, ответ был дан выше)
Билет 6
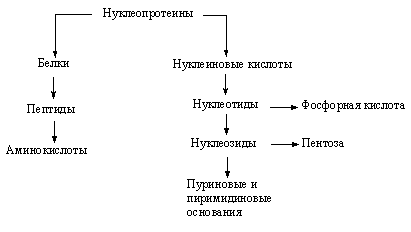
Гидролиз нуклеопротеинов. Продукты полного и неполного гидролиза.
|
Гидролиз нуклеопротеинов
|
Образование пептидной связи и особенности.
|
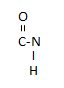 Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Особенности: связь ковалентная, не разрушается при денатурации
|
В какой области рН находится ИЭТ дипептида глу-глу. Написать дипептид.
|
Глутаминовая кислота содержит отрицательно заряженную группу СООН- => рН <7
(принцип построения дипептида см выше)
|
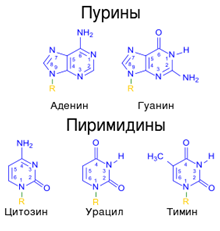
Написать формулу комплементарных пар азотистых оснований.
|
А=Т (У), Г=Ц
|
Классификация аминокислот по химическому строению.
|
На основе химического строения радикалов
Алифатические(Гли, Ала, Вал, Лей, Иле)
OH-содержащие (Сер, Тре)
СООН-содержащие (Асп, Глу)
NH2CO-содержащие (Асн, Глн)
NH2-содержащие (Лиз, Арг)
S-содержащие (Цис, Мет)
Ароматические (Фен, Тир)
Гетероциклические (Три, Гис)
Иминокислота (Про)
|
Билет 7
Сложные белки. Характеристика глико- и липопротеинов.
|
(сложные белки см выше)
Характеристика гликопротеинов
Состав: Б(полипептид)+углевод(олигосахарид)
Виды: ПГ (У>Б), ГП (У<Б), ГАГ
Связи: О-гликозидные, N-гликозидные, эфирные гликозидные связи со свободными СООН-группами глутаминовой и асарагиновой кислот.
Примеры_ГАГ'>Примеры ГАГ: гиалуроновая кислота, гепарин
Примеры ГП: белковые гормоны, мембранные сложные белки, иммуноглобулины, белки плазмы крови, интерфероны…
Функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, защитное, гормональное, антивирусное действие
Где синтезируются: в рибосомах ЭПС(в цистронах), затем присоединяются сахарные цепи, и далее белок транспортируется до мембран клетки.
Характеристика липопротеинов
Состав: Б+липид
Липиды в составе: нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды
Виды: ЛП (Л>Б), ПЛ (Л<Б)
Где встречаются: в составе клеточной мембраны и внутриклеточных мембран ядра, митохондрий, микросом, в свободном состоянии в плазме крови
Примеры: тромбопластический белок ткани легких, липовителлин желтка
Функции: ПЛ – структурная, комплексная организация миелиновых оболочек, нервной ткани, хлоропластов, фоторецепторной и электронно-транспортной систем, палочек и колбочек сетчатки; ЛП - транспорт холестерина
Где синтезируются: в печени или слизистой оболочке кишечника
Липопротеины сыворотки крови: ЛП низкой плотности (ЛПНП), ЛП очень низкой плотности (ЛПОНП), ЛП высокой плотности (ЛПВП), ЛП очень высокой плотности (ЛПОВП), ЛП промежуточной плотности (ЛППП)
|
Факторы устойчивости белка.
|
Факторы устойчивости:
Наличие заряда белковой молекулы
Находящаяся вокруг белка водная оболочка (зависит от заряда: альбумины – большую имеют, глобулины – меньшую)
|
ИЭТ. Свойства белка в ИЭТ.
|
Изоэлектрическая точка ( ИЭТ )– это такое значение pH, при котором белок
является электро-нейтральным (приобретает 0 заряд).
Степень ионизации функциональных групп этих R зависит от рН среды:
При рН 7 (нейтральная)
|
При рН <7 (кислая)
|
При рН >7 (щелочная)
|
– все ионногенные группы белка в ионизированном состоянии
|
– повышение концентрации Н+ приводит к подавлению диссоциации СООН-групп и снижению отрицательного заряда белков
(-СОО-+Н+ -СООН)
|
– связывание избытка ОН- с протонами, образующимися при диссоциации (NH3++ОН -NH20 + Н2О)
|
Для кислых белков ИЭТ - в кислой среде (pH<7), для основных (катионных) – в щелочной среде (pH>7).
Свойства белка в ИЭТ:
Вязкость (лучше растворимы, имеющие положительный или отрицательный суммарный заряд, чем в ИЭТ)
Быстро выпадают в осадок (заряженные белки могут двигаться в заряженном поле: положительные к катоду, отрицательные к аноду, в ИЭТ – не двигаются)
Метод определения ИЭТ: Электрофорез белков основан на их способности двигаться в электическом поле (чем меньше масса и больше заряд тем их подвижность выше), это свойство используется для разделения сложных по белковому составу биологических жидкостей - сыворотки крови и т.д.
|
Написать и назвать трипептид глу-глу-лиз. Указать N- и С- концевые аминокислотные остатки в молекуле.
|
(принцип построения трипептида см выше)
|
Соединить два мононуклеотида ТМФ и д-ГМФ. Написать для них второе название.
|
(см выше)
|
Билет 8
Функция белков в организме.
|
Функции Б:
Структурная (пластическая)
Ферментативная (каталитическая)
Регуляторная (гормоны)
Рецепторная
Иммунологическая (АТ)
Защитная (Б свертывающей системы крови, Б острой фазы воспаления)
Транспортная (альбумины)
Сократительная (миозин, актин, тропомиозин)
Дыхательная
Обезвреживающая
Геннорегуляторная
Потенциал мембраны
Обеспечение хорошего зрения
…
Последнее место) энергетическая
|
Третичная структура белка и связи, ее стабилизирующие.
|
(третичную структуру см выше)
|
В какой области рН находится ИЭТ трипептида глу-ала-фен. Написать трипептид.
|
(построение трипептидов см выше)
|
Назвать и написать комплементарные пары азотистых оснований.
|
(комплементарные пары см выше)
|
Белковый компонент нуклеопротеинов.
|
Белковый компонент нуклеопротеинов - протамины или гистоны, обладающие, основным характером.
Белковый состав ДНП – гистоны имеют 5 классов Н1 (богаты лизином), Н2А (богатые аргинин+лизин), Н2В (умеренно богатые арг+лиз), Н3 (богатые арг), Н4 (богатые глицином+арг)
|
Билет 9
Классификация аминокислот по заменимости.
|
Классификация аминокислот по заменимости
Заменимые
|
Незаменимые
|
Частично заменимые
|
Условно заменимые
|
Могут синтезироваться в организме
|
Поступают только с пищей
|
У детей незаменимые, у взрослых – заменимые
|
Синтезируются из незаменимых аминокислот
|
Оставшиеся
|
8(+2)
Валин, лейцин, изолейцин, метионин, фенилаланин, лизин, треонин, триптофан
(+ аргинин, гистидин)
|
аргинин, гистидин
|
Цистеин, тирозин
|
|
Факторы устойчивости белка.
|
(факторы устойчивости белка см выше)
|
Виды РНК, их молекулярный вес, локализация в клетке, биологическая роль.
|
Смотри выше
|
Определить характер среды в растворе дипептида глу-фен. Написать его.
|
Глутаминовая кислота содержит отрицательно заряженную группу СООН- => рН <7
(принцип построения дипептида см выше)
|
Соединить два мононуклеотида: АМФ и ЦМФ. Написать для них второе название.
|
(принцип связи мононуклеотидов см выше)
Аденозинмонофосфат (адениловая кислота),
цитидинмонофосфат (цитидиловая кислота)
|
Билет 10
Вторичная структура белка и связи, ее стабилизирующие.
|
(вторичную структуру белка см выше)
|
Что такое нуклеопротеины и из каких компонентов они состоят.
|
(характеристику нуклеопротеинов см выше)
|
Электрические свойства белков. ИЭТ. В какой области рН трипептид вал-фен-лей будет находиться в изоэлектрическом состоянии. Написать его.
|
(ИЭТ см выше)
рН=7, т.к. аминокислоты не содержат дополнительной амино- или карбоксо- групп
(принцип построения трипептида см выше)
|
Определить, в состав ДНК или РНК могут входить адениловая и уридиловая кислоты. Написать строение этих кислот.
|
В состав РНК, т.к. в составе ДНК нет азотистого основания урацил, который входит в состав уридиловой кислоты. В ДНК урацил заменяется тимином.
(принцип построения мононуклеотида см выше)
|
Классификация аминокислот.
|
Классификация аминокислот:
По химическому строению радикалов:
По природе заряда аминокислоты:
Нейтральные АК- радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы).
Основные АК – избыток аминогрупп
Кислые АК – избыток карбоксильных групп.
По полярности радикалов:
неполярные (гидрофобные);
полярные (гидрофильные);
ароматические (большей частью неполярные);
отрицательно заряженные
положительно заряженные
|
Билет 11
Физико-химические свойства белков. Растворимость, молекулярный вес, форма белковой молекулы.
|
Физико – химические свойства белков.
Растворимость
Большинство белков – гидрофильны и водорастворимы, что связано с наличием гидрофильных (полярных – заряженных и незаряженных групп в составе аминокислот).
Эти группы притягивают диполи воды и вокруг молекулы белка образуется “водяная оболочка” (шуба), которая удерживает белковую молекулу в растворе.
Молекулярная масса: от 6 000 до 1 000 000Д и выше. Полимеры аминокислот с массой менее 6000 называют пептидами.
Например: альбумины 70 000, глобулины 150 000.
Методы определения молекулярной массы белков: ультрацентри-фугирование, гельфильтрация, аминокислотный анализ.
Форма белковой молекулы:
Фибриллярные - нитевидные молекулы, скрепленные друг с другом поперечными связями и образующие длинные волокна или слоистые структуры.
Обладают высокой механической прочностью, нерастворимы в воде.
Функции: структурные и защитные.
Примеры: кератин волос и шерсти, фиброин шелка, коллаген сухожилий.
Глобулярные - одна или несколько полипептидных цепей свернуты в компактную структуру сферической формы, или глобулу.
Хорошо растворимы в воде.
Примеры: почти все ферменты, транспортные белки крови и многие запасные белки.
|
Правила Чаргаффа. Химическое строение азотистых оснований.
|
Правила Чаргаффа:
Молярная доля пуринов = молярной доле пиримидинов (А+Г=Ц+Т)
Количество Аденина и Цитозина = количеству Гуанина и Тимина (А+Г=Ц+Т)
Количество Аденина = количеству Тимина, а количество Гуанина = количеству Цитозина (А=Т, Г=Ц)
Таксономическое значение для характеристики вида играет коэффициент специфичности:
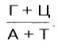 Для животных и большинства растений – ниже 1 (от 0,54 до 0,94), у микроорганизмов – колеблется (от 0,45 до2,57) Для животных и большинства растений – ниже 1 (от 0,54 до 0,94), у микроорганизмов – колеблется (от 0,45 до2,57)
|
В какой области рН находится ИЭТ трипептида цис-мет-тре. Написать и назвать его.
|
рН=7, т.к. у данных АК нет дополнительных положительно или отрицательно заряженных групп
(принцип построения трипептида см выше)
|
Характеристика протаминов и гистонов (аминокислотный состав, внутриклеточная локализация, ИЭТ, биологическая роль).
|
(См выше)
|
На примере двух мононуклеотидов показать, как они соединяются в полинуклеотидную цепь. Назвать их.
|
(принцип связи мононуклеотидов см выше)
| |
|
|
 Скачать 5.67 Mb.
Скачать 5.67 Mb.