химия cәттілік жуз алдык(1) (копия). Химия фармацевтикалы пндер кафедрасы
 Скачать 1.78 Mb. Скачать 1.78 Mb.
|
|
*КОЛЛИГАТИВТІК ҚАСИЕТТЕР*1*16*1* #183 *!Қан плазмасына гипертонды болатын ерітінді * 0,1 % NaCl-нің ерітіндісі *+B) 10,0 % NaCl-нің ерітіндісі * 0,15М NaCl-ді ерітіндісі * 0,9 % NaCl-нің ерітіндісі * 0,01М NaCl-ді ерітіндісі #184 *!Қан плазмасына изотонды болатын ерітінді * 1,0 М NaCl-нің ерітіндісі * 10,0 % NaCl-нің ерітіндісі * 0,1% М NaCl-ді ерітіндісі *+ 0,9 % NaCl-нің ерітіндісі * 0,01 М NaCl-ді ерітіндісі #185 *!Қан плазмасына гипотонды болатын ерітінді * 1,0 М NaCl-нің ерітіндісі * 10,0 % NaCl-нің ерітіндісі * 0,15 М NaCl-ді ерітіндісі * 0,9 % NaCl-нің ерітіндісі *+ 0,01 % NaCl-ді ерітіндісі #186 *!Ағзаның осмостық қысым әсерінен белгілі бір пішін және иілгіштігін сақтауын қамтамасыз ететін жасушаның серпімділігі *лизис *+тургор *гемолиз * плазмолиз * деплазмолиз #187 *!Гипотонды ерітіндідегі жасушаның ісініп, содан соң жарылу құбылысы *диализ *тургор *+гемолиз * плазмолиз * деплазмолиз #188 *!Гипертонды ерітіндідегі жасушаның жиырылу құбылысы *гемолиз *тургор *диализ *+ плазмолиз * деплазмолиз #189 *!Қан тамырына егу үшін қолданатын ерітінді *аса қаныққан *гипертонды *+изотонды * гипотонды * қаныққан #190 *!Вант-Гофф заңы бойынша ерітінді концентрациясы тәуелді * еріткіштің ерітінді бетіндегі қаныққан бу қысымының өзгеруіне *ерітіндінің қату температурасының төмендеуіне * ерітіндінің қайнау температурасының жоғарылауына *+ ерітіндінің осмостық қысымына * диффузия құбылысына #191 *!Рауль заңының математикалық өрнегі *+  *PV = CRT * C1V1 = C2V2 *π = CRT * c =  #192 *!Ерітіндіде жоғары молекулалық қосылыстардың болуынан туындайтын осмостық қысымның бір бөлігі * ерітінді бетіндегі еріткіштің қаныққан бу қысымы *+онкотикалық қысым * осмостық қысым * ерітіндіні изотондау * тургор #193 *!Осмостық қысымы стандартпен салыстырғанда жоғары ерітінді *+гипертонды *гипотонды *изотонды * физиологиялық * қаныққан #194 *!NaCl-ның 10,0 % ерітіндісіндегі эритроцитте байқалатын құбылыс *гемолиз *+плазмолиз *деплазмолиз * тепе-теңдік жағдай * эндоосмос #195 *!NaCl-ның 0,1% ерітіндісіндегі эритроцитте байқалатын құбылыс *+гемолиз *плазмолиз *диализ *тепе-теңдік жағдай * экзосмос #196 *!Вант-Гофф заңы:  RT RT* а = fC  қайнау қайнау 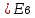 * 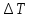 қату қату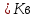 * i= 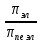 #197 *!Бірдей молярлық концентрацияда бірдей бөлшектер саны бар ерітінділер * Na2SO4 және NaCI *Na2CO3 және Na Br * NaBr және K2SO4 *+ NaCI және K Br * NaCI жәнеNa3PO4 #198 *!Тамақ өнеркәсібінде жиі пайданылатын ас содасының формуласы * С6Н12О6 * NаCI *KNO3 *+ NaHCO3 * Na2CO3 *КОМПЛЕКСТІ ҚОСЫЛЫСТАР *1*20*1* #199 *![Co(CN)4(H2O)2] – комплексті иондағы комплекстүзушінің тотығу дәрежесі * +4 * +5 *+ +3 * +6 * +2 #200 *! [CrCI2CN(H2O)3]комплексті қосылыстағы комплекстүзушінің тотығу дәрежесі *+ +3 * +6 * +4 * +5 * +2 #201 *!Комплекстүзуші Со(III) болғандағы [Co(NО2)3 (NH3)2]хкомплексті ионның заряды * 3+ *3- *+0 * 2- * 1+ #202 *! Комплекстүзуші Pt (IV) болғандағы [PtCI(OH)5]х комплексті ионның заряды * 2+ *+ 2- *4+ * 3- * 3+ #203 *!Калий монобромопентанитроплатинат (IV) қосылысының формуласы * K[PtBr(NO2)5] *[PtBr(NO2)5]K *+K2[Pt(NO2)5Br] * [Pt(NO2)5]KBr * [KBr][Pt(NO2)5] #204 *!Натрий пентацианомоноамминферрат(II) қосылысының формуласы * Na[Fe(CN)5NH3] *Na2[Fe(CN)6NH3] *Na(NH3) [Fe(CN)6] * [Fe(CN)6NH3]Na *+ Na3[Fe(CN)5NH3] #205 *!Нитрокомплексті қосылыс * [Cd(NH3)4]CI2 *K[Al(OH)3H2O] *+K2 Na[Co(NO2)6] * [Pt(NH3)4][PtCI6] * [CoBr(NH3)5]SO4 #206 *!Бромопентаамминкобальт (III) сульфатына сәйкес келетін формула *+ [CoBr(NH3)5]SO4 * [CoBr][(NH3)5] ∙SO4] *[Co(NH3)5]BrSO4 * (NH3)5[Co BrSO4] * Co[Br(NH3)5SO4] #207 *!Катионды комплексті қосылыс * Ca[Al(OH)5H2O] *[Co(NH3)3(NO2)3] *[PtCI3(NH3)3] *+ [Cr(CNS)2H2O(NH3)3]Br * Ca[Al(OH)5H2O] #208 *!Ацидокомплексті қосылыс *K[Al(OH)3H2O] * [CoBr][(NH3)5] ∙SO4] *[PtCI(NH3)3]CI * Ca[Al(OH)5H2O] *+ К3[Fe(СN)6] #209 *!Анионды комплексті қосылыс *+ Na3[Cо(NO2)6] *[Cu(NH3)4]SO4 *[PtCI(NH3)3]CI *[Pt(NH3)2Cl4] * [Cr(H2O)3(CN)3] #210 *!Бейтарап комплексті қосылыс * K2[PtCI6] *Co(NO2)2(NH3)3]CI *[PtCI(NH3)3]CI *[PtCI3(NH3)3]Br *+ [PtCI4(NH3)2] #211 *!Монодентатты лигандалар орналасқан қатар * NH3,OH-,SO32- *CO32-,NO2-,CN- *H2O,OH-,SO42- * СО, CO32-,Br- *+ OH-, CI-, Br- #212 *![Co(NH3)5СI]CI2 комплексті қосылыстың ішкі сферасы * Со2+ *+ [Co(NH3)5СI]2+ *Co3+ * 5NH3 және CI- * 2CI- #213 *!Берілген лиганданың комплекстүзушімен түзетін байланысының саны *комплексті ионның заряды *орталық атомның координациялық саны *+лиганда дентаттылығы *орталық атомның валенттігі *орталық атомның тотығу дәрежесі #214 *! [Co(NH3)5СI]CI2 комплексті қосылыстағы лиганда * Со2+. *[Co(NH3)5СI]2+. *Co3+. *+ 5NH3 және CI-. * 2CI-. #215 *!Комплексті қосылыстағы орталық атом өзін қоршай орналасқан лигандалармен … құрайды * сыртқы координациялық сфераны *комплекті қсылысты *+ішкі координациялық сфераны *қос тұзды * орта тұзды #216 *!Орталық атомның лигандамен түзетін байланысының жалпы саны *комплексті ионның заряды *+орталық атомның координациялық саны *лиганда дентаттылығы *орталық атомның валенттігі *орталық атомның тотығу дәрежесі #217 *!Комплексті қосылыстағы орталық атом өзін қоршай орналасқан лигандалармен … құрайды * сыртқы координациялық сфераны *комплекті қсылысты *+ішкі координациялық сфераны *қос тұзды * орта тұзды #218 *!Орталық атомның лигандамен түзетін байланысының жалпы саны *комплексті ионның заряды *+орталық атомның координациялық саны *лиганда дентаттылығы *орталық атомның валенттігі *орталық атомның тотығу дәрежесі *ТОТЫҒУ-ТОТЫҚСЫЗДАНУ РЕАКЦИЯЛАР *1*27*2* #219 *!Әрекеттесетін заттар құрамындағы элемент атомдарның тотығу дәрежесі өзгере жүретін реакцияларды ... деп атайды *кинетикалық *стехиометриялық *+ тотығу-тотықсыздану *иондық *тотығу #220 *!Кез-келген тотығу-тотықсыздану реакциясы екі жартылай реакциядан тұрады, олар *гидролиз және диссоциация *ионданужәне диссоциация *+тотығу және тотықсыздану *жылудың бөлінуі және жұтылуы *ассоциация және диссоциация #221 *!Тотықтырғыштар – атом, молекула және ион, олар реакцияда *тотығу дәрежесін арттырады *+ электрон қосып алады *тотығады *электронды береді *тотығу дәрежесі валенттілігіне сай келеді #222 *!Тотығу-тотықсыздану реакцияларының түрлері *алмасу, ыдырау және қосылу *молекулалық, иондықжәне электрондық *+молекулааралық, молекулаішілікжәне диспропорциялық *эфирлеу, бейтараптану және радикалдық *иондық, радикалды және алмасу #223 *!Берілгендерден диспропорциялық реакцияны таңдаңыз * S + 2HNO3(конц) = H2SO4 + 2NO↑ *Mg + S = MgS *2H2O2 = 2H2O+ O2↑ *+ 6KOH + 3S = K2SO3+ 2K2S +3H2O * Cu + 4HNO3= Cu(NO3)2 + 2NO2+ 2H2O #224 *!Берілген тотығу-тотықсыздану реакциялардан диспропорциялық реакцияға жататыны * 2Р + 5О2 = Р2О5 * 2С2Н5CI + 2Na = C4H10 ↑+ 2NaCI *+CI2 + 2KOH = KCI + KCIO3 + H2O * C6H6 + 3CI2 = C6H6CI6 * NaOH + HCI = NaCI + H2O #225 *! Суда және сутек пероксидінде оттектің тотығу дәрежелері * -2 және +2 * -2 және +2 *+-2 және -1 * +2 және 0 * -1/2 және 0 #226 *!Калий хроматында және калий дихроматында хромның тотығу дәрежелері *++6 және +6 * +6 және +3 * +3 және +6 * -6 және +6 * +2 және +3 #227 *!Калий перманганатында және натрий манганатында марганецтің тотығу дәрежелері *++7 және +6 * +6 және +7 * +6 және +4 * -7 және +7 * +2 және +4 #228 *! CrCI3 + H2O2 + NaOH→Na2CrO4 + H2O + NaCI реакциясындағы Н2О2 –тің көрсететін қасиеті *еріткіш *орта түзеді *+ тотықтырғыш *тотықсыздандырғыш *катализатор #229 *!KMnO4 + Н2О2 +H2SO4→MnSO4 +K2SO4+O2+H2О реакциясындағы Н2О2–тің көрсететін қасиеті *еріткіш *орта түзеді * тотықтырғыш. *+тотықсыздандырғыш *катализатор #230 *!Берілгендерден тотықсыздандырғыш та, тотықтырғышта қасиет көрсететін қосылыстар * H2О, Li, HNO3 *+H2О2, SO2, HNO2 *F2, HF, HCIO * Na, Ne, O3 * HNO2, Mg, Cu #231 *!Күшті тотықтырғыш қасиет көрсететін әлсіз қышқыл * HF *+ HCIO4 *HCIO * HNO3 * H2SO4 #232 *!Молекуласының құрамында тотықтырғыш та, тотықсыздандырғыш та бар қосылыс қатысатын тотығу-тотықсыздану реакциясы * 4FeS2 + 11O2= 2Fe2O3+ 8SO2↑ *+2KCIO3= 2KCI + 3O2 *CuO + CO = Cu + CO2 ↑ * NaOH + HCI = NaCI + H2О * CaO + H2О= Ca(OH)2 #233 *!Калий перманганаты қышқылдық ортада тотықсызданады *манганат-ионына MnO42- * марганец (II) MnO оксидіне *+марганец Mn2+ионына * марганец (IV) MnO2 оксидіне *марганец (III) Mn2O3 оксидіне #234 *!Этиленнің калий перманганатымен бейтарап ортада тотығуынан түзілетін өнімдер *+ HOCH2CH2OH + MnO2↓+ KOH *CH3CH2OH + K2MnO4 *CH3CH2OH + MnO2↓+ KOH * CH3COOK + Mn(CH3COO)2 * HOH2C- CHOH-CH2OH + MnO2+ KOH #235 *!Калий дихроматы қышқылдық ортада тотықсызданады *хромат ионына CrO42- *тетрагидросохромит-ионына [Cr(OH)4]- *хром (III) Cr2O3оксидіне *+хром Cr3+ катионына *хром Cr2+ катионына #236 *!Салыстыруға алынатын жартылай реакцияның 2Н++2е→Н2 стандартты тотығу-тотықсыздану потенциалы тең (В) * 8,31 * +0 * 22,4 * 6,02∙1023 * 0,118 #237 *!Стандартты тотығу-тотықсыздану потенциалынын есептейді * Менделеев теңдеуімен * Ломоносов теңдеуімен *+ Нернст теңдеуімен * Ле-Шателье теңдеуімен * Авогадро теңеуімен #238 *!Металл және оның өз тұзы ерітіндісінің бөліну бет аралығында пайда болатын потенциал секірмесі * стандартты сутектік электродтың потенциалы * мембрандық потенциал *+ электродтық потенциал * диффузиондық потенциал *электрқозғаушы күш #239 *!Стандартты потенциалы шартты түрде нольге тең электрод * шыны * хлоркүмісті * каломельді * хингидрон *+ стандартты сутекті #240 *!Бірінші текті электрод * мембранамен бөлген екі ерітінді * заттың тотыққан және тотықсызданған түрлері бар ерітіндіге батырылған күміс электроды *+ жақсы еритін өз тұзының ерітіндісіне батырылған металл пластинкасы * өзінің нашар еритін тұзымен қапталып, осы тұзбен аттас ионы бар ерітіндіге батырылған металл * заттың тотыққан және тотықсызданған түрлері бар ерітіндіге батырылған платина #241 *!Гальваникалық элементтің электрқозғаушы күші * гальваникалық элементті құрайтын электродтардың потенциалдарының қатынасы * гальваникалық элементті құрайтын электродтардың потенциалдарының көбейтіндісі * оң зарядталған электродтың потенциалы * гальваникалық элементті құрайтын электродтардың потенциалдарының қосындысы *+ гальваникалық элементті құрайтын электродтардың электродтық потенциалдарының айырымы #242 *!Гальваникалық элементтің электрқозғауыш күшін есептейтін формула * Е = φ1 + φ2 *+ Е = φ1 – φ2 * Е = φ1 * φ2 * Е = φ1 / φ2 * Е = φ2 / φ1 #243 *!Заттар арасында ең күшті тотықтырғыш *балқытқыш қышқыл *+фтор *оттек *платина *мыс #244 *!Күшті тотықсыздандырғышқа жатады *марганец оксиді(IV),көміртек оксиді(IV) * cу, концентрлі күкірт қышқылы *калий перманганаты, калий хроматы *+аммиак, сілтілік және сілтілік–жер металдары *галогендер молекулалары #245 *!Тотықтырғыш та ,тотықсыздандырғыш та қасиеттерді көрсететін заттар * H2O,Li,HNO3 * H2O, SO2, HNO2 *F2,HF, HCIO *Na, Ne, O3 * HNO2, Mg, Cu * IА-IIA ТОП ЭЛЕМЕНТТЕРІ*1*25*1* #246 *!Химиялық реакцияларда тотықтырғыш ретінде қолданатын зат * Cr2O3 * СrO * K2WO4 *+ K2Сr2O7 * MoO3 #247 *! Калий дихроматы қай ортада тотықтырғыш қасиетін көрсетеді * бейтарап * әлсізсілтілік * күштінегіздік * + қышқылды * әлсізқышқылды #248 *!Төменгі схема бойынша 2МеNO3 →600 M2O + 2NO2 + ½O2 қай элементтің нитраты ыдырайды * +Li * Na * K * Rb * Cs #249 *!Натрий ионын ашуға қолданатын калий дигидроантимонатынқосқанда қандай зат пайда болады * K2HSbO4 * K2Na2SbO4 * Na3SbO4 * +NaH2SbO4 * Na2HSbO4 #250 *! Калий ионын ашуға қолданатын натрийдің гексанитрокобальтатын (III) қосқанда қандай зат пайда болады * Co(NO2)3 * Na3[Co(NO2)6] * K3[Co(NO2)6] * +K2Na[Co(NO2)6] * KNO3 #251 *!Калий ионын ашуға қолданатын натрийдің гексанитрокобальтаты (III) қандай түсті тұңба береді * ақ * көк *қызыл *жасыл *+сары #252 *!Калий иондары жалынды қай түске бояйды * сары * ақ *көк * жасыл * +күлгін #253 *!Натрий иондары жалынды қай түске бояйды * көк * жасыл * күлгін * +сары * көкжасыл #254 *!Асқазан қышқылы жоғарлағанда натрийдің қай тұзын қолданады * Na2SO4 * NaCl * +NaHCO3 * Na3PO4 * Na2CO3 #255 *!Қорғасын, барий тұздарымен уланғанда беретін және іш айдағыш глаубер тұзының формуласы * CaSO4•2H2O * CuSO4•5 H * MgSO4•7 H2O * FeSO4•7 H2O *+Na2SO4•10H2O #256 *!Жүрек жұмысы бұзылғанда калийдің қай тұзын қолданады * K2SO4 * +KCl * K2CO3 * K3PO4 * NaCl #257 *!Калий хроматы барий- ионымен сары түсті кристалдық тұңба, ал аммоний сульфаты –ақ түсті түңба береді . Осы тұңбалардың формулалары *+BaCrO4, BaSO4 * BaCrO4, BaCO3 * BaSO4, BaCO3 * BaCrO4, Ba3(CrO3)2 * BaCO3 , Ba(CrO2)2 #258 *!Комплексті қосылыстың Na2[Cu(OH)4] түсі қандай * ақ * қара * жасыл *+ көк * қоңыр #259 *! Амфотерлық қасиеті бар негіз * NaOH * Mg(OH)2 * + Be(OH)2 * Ca(OH)2 * Sr(OH)2 #260 *!Берилий гидроксиді ериді * NH4Cl * KCl * KNO3 * K2CO3 * +NaOH #261 *!Ca(OH)2ериді * H2O * NaOH * +HCl * KNO3 * KOH #262 *!Кальций карбонаты ериді * H2O * NaOH * NН4OH * NaNO3 * +HCl #263 *!Кальций ионы жалын түсін қай түске бояйды * көк * жасыл * күлгін * сары *+ қызыл #264 *!Аммоний оксалатын кальций- иондарына қосқанда қандай тұңба түзіледі * CaCO3 * +CaC2O4 * K3[Fe(CN)6] * Ca2[Fe(CN)6] * (NH4)2C2O4 #265 *!Тіс ұнтағын дайындағанда кальцийдің қай тұзын қолданады * Сa3(PO4)2 * CaSiO3 * +CaCO3 * CaSO4 * CaCl2 #266 *!Стенокардия ауруында тамырды кеңіту үшін натрийдің қай тұзын қолданады * NaCl * NaNO2 *+ NaNO3 * Na2SO4 * Na3PO4 #267 *!Суда аз еритін және ортакүшті негіз қай элементтің гидроксиді * Na * Са *+ Mg * Sr * K #268 *!Іш айдатқыш тұзы ( ашты немесе ағылшын тұзы) * CaSO4 •2H2O * CuSO4 •5H2O * CaSO4 *+ MgSO4 •7H2O * FeSO4 •7H2O #269 *!Сүйекте кальций иондарының сіңіруіне және шығуына әсер ететін дәрумен * С *А *+Д *В1 *В6 #270 *!Қай металдың оксиді асқазан қышқылдығын төмендетеді,қышықлдармен уланғанда ем ретінде пайдаланады , тіс ұнтағының құрамына кіреді *Na2O *K2O *+MgO *CaO *SiO2 2 ДЕҢГЕЙДІ ТЕСТЕР *БУФЕРЛІК ЖҰЙЕЛЕР *2*36*2* #271 *!Күшті бір негізді қышқылдың сутек иондарының концентрациясын есептейтін формула *+[H+] = Cк-ты *[H+] = Cк-ты - [OH-] *[H+] =  *[H+] = 14 - [OH-] *[H+] = [OH-] #272 *!Бейтарап орта үшін дұрыс *+[H+] = [OH-] *[H+] = 14 - [OH-] *[H+] [OH-] *[H+] [OH-] = 14 *[H+] [OH-] #273 *!Аз мөлшерде хлорлы сутек қышқылын гидрокарбонатты буферлік ерітіндіге қосқанда қай компоненті онымен әрекеттеседі *H2CO3 *+NaHCO3 *Na2CO3 *CaCO3 *K2CO3 #274 *!Ацетатты буферлік жұйеде сутек иондарының концентрациясын есептейтін теңдеу * +  *  *  *  *  #275 *!Гидрокарбонатты буфердің құрамына кіретін қосылыстар *+H2CO3 и NaHCO3 *Na2CO3 и K2CO3 *Na3PO4 и Na2HPO4 *CaCO3 и H2CO3 *K2CO3 и CaCO3 #276 *!Фосфатты буфердің құрамына кіретін қосылыстар *Na3PO4 и H3PO4 *+Na2HPO4 и NaH2PO4 *NaH2PO4 *Na3PO4 и Na2НPO4 *Ca3(PO4)2 #277 *!Аммиакты буфердің құрамына кіретін қосылыстар *NH4NO3 и (NH4)2SO4 *(NH4)2CO3 и NH4Cl *+NH4Cl и NH4OH *(NH4)2SO4 *NH4OH и HCl #278 *!Қай ерітіндіде мына қатынас сақталады [H+] < [OH-] *+NaOH *KCl *HCl *CH3COOH * H3PO4 #279 *!Қай ерітіндіде мына қатынас сақталады [H+] > [OH-] *NaOH *KOH *+HCl *KCl *NH4OH #280 *!25°С таза суда сутек иондарының концентрация [H+] тең (моль/л) *10-14 *+10-7 *107 *101 *7 #281 *! Сон – концентрациясы нешеге тең , егер Сн+ = 10-4моль/л болса *14 *10-14 *10-7 *+10-10 *10-4 #282 *!Сулы ерітінділерде сутектік көрсеткіш рН-ты анықтауға болады *–ln Cн+ * + –lg Cн+ *lg Cн+ *ln Cн+ *–logВ C #283 *!Сүйық ерітінділерде рН пен рОН- тың қосындысы тең *10-14 *10-7 *1 *7 *+14 #284 *! Бейтарап сулы ерітінділерге қандай талап қойылады *[Н+] > 10-7 *[Н+] < 10-7 *+[Н+] = 10-7 *pH = 14 *pH = 1 #285 *!Реакция орталығы қышқыл жаққа ығысуы аталады *осмос *+ацидоз *алколоз *гидролиз *нейтрализация #286 *! Реакция орталығы сілтілік жаққа ығысуы аталады *ацидоз *+алколоз *гидролиз *гомеостаз *нейтрализация #287 *!Сулы ерітіндіде рОН-ы тең 11, ал сутек иондарының концентрациясы тең болады (моль/л) *10-1 *+10-3 *10-5 *10-9 *10-11 #288 *!Қышқылды буфердің компоненттері ол *күшті қышқыл *күшті негіз *+әлсіз қышқыл және әлсіз қышқылдың күшті негізбен тұзы * күшті қышқыл және күшті қышқылдың күшті негізбен тұзы *әлсіз негіз бен әлсіз қышқылдың әлсіз негізбен тұзы #289 *!Негіздік буферге жатады *NaH2PО4, Na2HPО4 *PtCOOH, PtCOONa *+NH4ОH, NH4Cl *Н2СО3, NаНСО3 *СН3СООН, СН3СООNа #290 *!Ерітіндінің рОН-ы тең 13, реакция орталығы қандай *+қышқылды *сілтілік *әлсізсілтілік *әлсізқышқылды *бейтарап #291 *!Натрий гидроксидінің концентрациясы СNаОН = 0,001 моль/л , сонда рН-ы тең *10-2 *2 *9 *+11 *10-12 #292 *! HCl ерітіндісінің концентрациясы 0,1 моль/л, сонда рН-ы тең * [H+] = [OH-] * [H+] < [OH-] *+ pH = 1 * pOH = 1 * [H+] = 10-13 #293 *!Қышқылды ерітінділерде сутектік көрсеткіші тең * рН = 7 * рН > 7 * рН > 9 * рН = 14 * +рН < 7 #294 *!Қай сулы ерітіндіде мынадай талап бар [H+] > [OH-] * NaOH * KOH * NaCl *+ CH3COOH * NH4OH #295 *!Сірке қышқылының ерітіндісінде сутек иондарының концентрациясының есептеуге болады формуламен *[H+] = Cк-ты *[H+] = Кк-ты *+[H+] =  *[H+] = 14 - [OH-] *[H+] = 10-14 #296 *!Аммоний гидроксидінің ерітіндісінде сутек иондарының концентрациясының есептеуге болады формуламен *[H+] = Cосн *[H+] = Cосн *[H+] = 10-14 - [OH-] *[H+] = 14 - [OH-] *+[H+] =  #297 *!Концентрациясы 0,01 моль/л калий гидроксидінің ерітіндісінде қай теңдеу дұрыс *[H+] = [OH-] *[H+] [OH-] *+[H+] [OH-] *[H+] = 10-2 *[OH-] = 10-12 #298 *!Концентрациясы 0,001 моль/л калий гидроксидінің ерітіндісінде қай теңдеу дұрыс *рН = 3 *рОН = 11 *+рОН = 3 *[H+] = 10-3 *[OH-] = 10-11 #299 *!Концентрациясы 0,1 моль/л және иондану дәрежесі =0,001 әлсіз бір қышқылды негіздің иондану константасы тең *10-1 *10-3 *10-4 *10-5 *+10-7 #300 *!Иондану константасы Kb тең 10-7 және концентрациясы 0,1 моль/л әлсіз бір қышқылды негіздің иондану дәрежесі тең *0,1 *0,01 *+0,001 *10-4 *10-5 #301 *! Кв = Сн+ . Сон- қалай аталады *жылдамдық константасы * диссоциациялану дәрежесі *тепе-теңдік константасы * диссоциациялану константасы *+судың иондық көбейтіндісі #302 *! 25 оС таза судың иондық қөбейтіндісі Кв тең *10-14 *10-7 *10+7 *+1014 *14 #303 *!Буферлік ерітіндіге аз мөлшерде күшті қышқыл немесе аз мөлшерде күшті негіз қосқанда қай зат өзінің шамасын өзгертпейді *көлем *+рН-ы *иондық кұш *иондардың активтік коэффициенті *буткіл иондардың концентрациясының қосындысы #304 *!Ағзада реакция орталығының рН –ының тұрақтылығы немен анықталады *+буферлік жүйемен *сымен *күшті қышқылмен * натрий иондарымен * калий иондарымен #305 *!100мл қан плазмасында химиялық байланысқан СО2 көлемімен анықталатын шама аталады *+қанның сілтілік резерві, *қанның сутектік көрсеткіші , *қанның осмотық қысымы, *қанның буферлік сиымдылығы , *қанның концентрациясы #306 *!Ерітіндіде Сн+ = Сон- = 10-7 ,бұл ерітінді қалай аталады *қышқылды *сілтілік *әлсізсілтілік *әлсізқышқылды *+бейтарап *ТЕМІР, КОБАЛЬТ , НИКЕЛЬ ТОПШАСЫ*2*35*2* #307 *!Темір атомының электрондық конфигурациясы *…4s24p6 *…3d54s24p1 *+…3d64s2 *…3d84s0 *…3d74s2 #308 *! Кобальт атомының электрондық конфигурациясы * …3d54s24p2 *…4s24p64d1 *…3d64s2 *…3d84s1 *+…3d74s2 #309 *! Никель атомының электрондық конфигурациясы *+ …3d84s2 * …3d54s2 * …3d64s2 * …3d104s0 *…3d94s1 #310 *!Магнитті теміртас минералының формуласы *+ Fe3O4 * Fe2O3 * Fe2O3 ·n H2O * FeCO3 * FeS2 #311 *! Сидерит минералының формуласы * Fe3O4 * Fe2O3 * Fe2O3 ·nH2O *+ FeCO3 * FeS2 #312 *! Лимонит минералының формуласы * Fe3O4 * Fe2O3 *+ Fe2O3 ·nH2O * FeCO3 * FeS2 #313 *!Темір пассивтенеді * Cl2 * O2 * HCl сүйық * H2SO4 сүйық *+ H2SO4 конц #314 *!Үй температурасында темір әрекеттеседі * H2SO4 конц * H2SiO4 конц * HNO3 конц *+H2SO4 разб * H2O #315 *!Темір суйық H2SO4 ерігенде түзіледі * Fe2(SO4)3 *+FeSO4 * H2S * SO2 * FeSO3 #316 *!Темір концентрлі H2SO4 ерігенде түзіледі * FeSO4 *+Fe2(SO4)3 * FeS * Fe2S3 * H2S #317 *!Қыздырғанда темір концентрлі HNO3 ерігенде түзіледі *+ Fe(NO3)3 * Fe(NO3)2 * H2 * NH4NO2 * NH4NO3 #318 *!Темір суйық HNO3 ерігенде түзіледі *+Fe(NO3)3 *Fe(NO3)2 *H2 *NO2 *NH4NO2 #319 *!Темір (II) иондарын қанда ашуға қолданатын реагент *+ K3[Fe(CN)6] * H2SbO4 * Na3[Co(NO2)6] * NaOH * K4[Fe(CN)6] #320 *!Темір (III ) иондарын қанда ашуға қолданатын реагент * K3[Fe(CN)6] * KH2SbO4 * Na3[Co(NO2)6] *+ K4[Fe(CN)6] * K2CrO4 #321 *! “Берлин көгі”-нің формуласы *Сu2[Fe(CN)6] *Сa2[Fe(CN)6] *+Fe4[Fe(CN)6]3 *K2Na[Co(NO2)6] *NaH2SbO4 #322 *!“Турнбуль көгі ”-нің формуласы *Сu2[Fe(CN)6] *Сa2[Fe(CN)6] *K2Na[Co(NO2)6] *K4[Fe(CN)6] *+Fe3[Fe(CN)6]2 #323 *!Сары қан тұзы Fe(III) иондарымен әрекеттескеде тұңбаның түсі * жасыл *+ көк * ақ * қара *қоңыр #324 *!Темір (II) қосылысының қайсысы ауаға тұрақты *Fe(OH)2 *FeSO4 •7H2O *+(NH4)2SO4 •FeSO4 •6 H2O *K4[Fe(CN)6] *FeCl2 #325 *!Темірдің координациялық саны * 2 * 3 * 8 *5 *+6 #326 *!Пиритті қыздырғанда түзіледі *FeO *+Fe2O3 *H2S *Fe(OH)2 *Fe(OH)3 #327 *!Темір (III) хлориді ерітіндісінен H2S жібергенде түзіледі *+Fe2S3 *FeS *S *FeOHCl2 *FeOHCl #328 *!Темір (III) гидроксиді ериді *KCl *+NaOH конц *NH3 р-р *NH4Cl р-р *K2SO3 #329 *!FeCl3 тұзының гидролизін үлғайту үшін қосады * НCl *+NH4Cl * HBr * NaOH *HCN #330 *!Темір карбонилі *Fe(CO)6 *Fe(CO)4 *Fe2(CO)8 *Fe(CO)3 *+Fe(CO)5 #331 *!Ең күшті гидролизденетін тұз *FeCl2 *FeCl3 *+NaFeO2 *Fe2(SO4)3 *Fe(NO3)3 #332 *!Fe2O3 калий карбонатымен балқытқанда түзіледі *+KFeO2 *FeO *KOH *Fe(OH)3 *Fe(OH)2 #333 *!Fe2O3 бертолет тұзымен сілтілік ортада балқытқанда түзіледі *KFeO2 *FeO *+K2FeO4 *Fe(OH)3 *Fe(OH)2 #334 *!Калий ферраты күкірт қышқылымен әрекеттескенде түзіледі *+H2FeO4 *H2 *FeSO4 *H2S *Fe2(SO4)3 #335 *!Темір роданидінің түсі * ақ * сары *+ кан-қызыл түсті * көк * жасыл #336 *!Дезинфициялау және қан тоқтатқыш темір тұзы *FeSO4 •7H2O *феркован *фербитол *+FeCl3 • 6H2O *FeCO3 #337 *!Витамина В12қай элементтіңкомплексі *Fe *Cu *Mg *+Co *Na #338 *!Кобальт (II)гидроксиді неде ерімейді *HCl *NH3 (eр) *NH4Cl(eр) *H2SO4 *+NaOH(cүйық) #339 *!Ең тұрақты комплексті ион * [Fe(CN)6]4- Kн=1*10-24 *[Co(NH3)6]2+ Kн=7*10-6 *[Co(NH3)6]3+ Kн=3*10-33 *+[Co(CN)6]3- Kн=1*10-64 *[Ni(CN)4]2- Kн=1*10-16 #340 *!Никель (II) гидроксиді ерімейді *HCl *NH3 (р-р) *NH4Cl(р-р) *H2SO4 *+NaOHсүйық #341 *!Ерітіндіде Fe(III) иондарын төменгі реактивпен ашуға болады *H2S *K3[Fe(CN)6] *H2SO4 *+KCNS * NaCI *МЫС ТОПШАСЫ*2*25*1* #342 *! Мыс атомының электрондық конфигурациясы *…3d94s2 * …3d94s24p1 *+…3d104s1 * …3d74s2 * …3d64s2 #343 *!Алтын атомының электрондық конфигурациясы * …4d105s1 *+…5d106s1 *…5d96s2 *…4d75s25p2 *…5d86s26p1 #344 *!Табиғатта мыстың қай қосылысы кездеспейді * Cu2O * Cu2S * Cu2(OH)3 CO3 * CuFeS2 *+ СuCl #345 *!Халькопирит минералының формуласы * Cu2O * Cu2S * CuCO3·Cu(OH)2 *+CuFeS2 * СuSO4 ·5H2O #346 *! Малахит минералының формуласы *+ CuCO3·Cu(OH)2 * Cu2O *Cu2S * CuFeS2 * СuCO3 #347 *! Куприт минералының формуласы * CuCO3·Cu(OH)2 * + Cu2O * Cu2S * CuFeS2 * СuSO4 ·5H2O #348 *!Неде мыс ерімейді * NaCN * HNO3 конц * NaOHконц * + NaOHразб * HNO3 разб #349 *! HNO3 (ω =65%) мыспен әрекеттескенде түзіледі * CuO * Cu(NO3)2 * NO * NH3 *+ NO2 #350 *! Мыс тұздарынан қай металды ығыстырады * Fe * Zn * Sn * Pb *+ Ag #351 *! Күміс ауада қарайғанда қай зат түзіледі * Ag2S *+ Ag2O * AgO * Ag2CO3 * AgNO3 #352 *! CuO алуға болмайды реакциямен * СuSO4 * Cu + O2 * Cu(NO3)2 *+СuSO4+ NaOH (разб) * Cu(OН)2 #353 *! Cu(OН)2 алуға болады реакциямен * Cu + Н2O * CuО + Н2O * СuSO4 + Н2O +NH3(избыток) *+ Na2[Cu(OH)4] + Н2O * CuCl2 + Н2O #354 *! Cu(OН)2 ериді *Н2O *NaOH разб *+NaOH конц *NaCl *K2SO4 #355 *!CuCl ериді *Н2O *+HCl *NaOH *KNO3 *Mg(OН)2 #356 *!Қыздырғанда AgNO3 алуға болады * Ag2O * AgO * NO * NH3 *+ NO2 #357 *!CuS ериді * Н2O * HNO3 конц *+ HClразб * (NH4)2S * K2S #358 *!Аммиактың артық мөлшерін CuSO4 қосқанда түзіледі * (NH4)2SO4 * (NH4)2SO4•CuSO4 * Cu(OH)2 *+ [Cu(NH3)4]SO4 * NH4OH #359 *!Қышқылдық қасиеті бар гидроксид * Cu(OH)2 * [CuOH] * [AgOH] *+ Au(OH)3 * [Ag(NH3)2]OH #360 *!Ферменттердің (оксидазн, цитохромоксидозы, тирозиназы, гемоцианин) құрамына кіретін элемент * Na * K *+ Cu * Fe * Co #361 *!Язва, эрозия, гастрит, конъюктивиті емдеуге қолданатын күміс тұзы * Ag *+AgNO3 * колларгол * протаргол * “серeбряная вода” #362 *!Медицинада қолданатын антисептикалық және қуырғыш қасиеттері бар мыс тұзы * CuO * Cu(OH)2 *+ СuSO4 •5H2O * CuCO3 * CuCl2 #363 *! Ең тұрақты комплексті ион * [Ag(NH3)2]+ * [AgCl2]- *+ [Ag(S2O3)2]3- * [AgBr2]- * [Ag(CN)2]- #364 *! Комплексті ионың [Cu(NH3)4]2+ кеңістіктегі пішіні * төрт бұрышты пирамида * + тетраэдр * октаэдр * квадрат * үшбұрышты призма #365 *!Артық мөлшерде аммиакты CuSO4 ерітіндісіне қосқанда түзіледі * (NH4)2SO4 * (NH4)2SO4·CuSO4 * Cu(OH)2 *+[Cu(NH3)4]SO4 * NH4OH #366 *!Қышқылдық қасиеті бар гидроксид * Cu(OH)2 * [CuOH] * [AgOH] *+Au(OH)3 * [Ag(NH3)2]OH *1А-IIA ТОП ЭЛЕМЕНТЕРІ*2*26*2*#367*!Натрий пероксиді сумен әрекеттескенде түзіледі |
