Лекция 6. Химия р-элементов. Химия рэлементов
 Скачать 223 Kb. Скачать 223 Kb.
|
|
Применение. Бор применяют как добавку к сплавам, повышающую их жаропрочность и износостойкость. Поскольку ядро бора имеет высокое сечение захвата нейтронов, его используют для защиты от нейтронов и в регулирующих устройствах атомных реакторов. Бораты входят в состав многих моющих средств. В2O3 - необходимая часть ряда эмалей, глазурей и специальных сортов стекла. В микроэлектронике бор используется в качестве полупроводника, применяется для легирования полупроводниковых материалов. «Белый графит» служит изолятором и твердой высокотемпературной смазкой. Боразон применяют как сверхтвердый материал в буровых работах, при обработке металлов. Бориды используются для изготовления высокоогнеупорных деталей. Борная кислота применяется в медицине. Тетраборат натрия Na2B4О7 (бура) используется в качестве флюса при пайке, гак как в расплаве этой соли хорошо растворяются оксиды металлов с образованием метаборатов: Na2B4О7 + CuO 2NaBО2 Cu(BО2)2. 2.2. Алюминий Второй типический элемент III группы периодической системы - алюминий. Он является первым и самым легким металлом. У алюминия по сравнению с бором атомный радиус больше, а потенциал ионизации меньше; следовательно, возрастают его металлические свойства. В отличие от неметалла бора алюминий является амфотерным элементом. Алюминий и его гидроксид растворяются в кислотах и щелочах. Для химии алюминия исключительно важное значение имеет его большое сродство к кислороду. В таблице приведены значения энтальпий и энергий Гиббса образования оксидов алюминия и его аналогов. Таблица - Термодинамические параметры оксидов III А группы
И энтальпия, и энергия Гиббса образования алюминия резко отличаются от таковых для галлия и его аналогов, что указывает на его высокую устойчивость. И, наконец, для алюминия наблюдается горизонтальная аналогия с кремнием. Отчетливо проявляется она в алюмосиликатах, наиболее распространенных в земной коре химических соединений. Природные ресурсы. Алюминий - один из самых распространенных на Земле элементов, занимает третье место по распространенности после кислорода и кремния. Алюминий входит в состав 250 минералов, главным образом алюмосиликатов, из которых образована земная кора. Продуктом их разрушения является глина - Аl2O3 2SiO22H2O (каолинит). Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Иногда встречается белая глина, без примесей железа. Техническое название Аl2O3 - глинозем. Для добычи алюминия используют минералы: боксит (Аl2O3 Н2O), а также нефелин (Na2OAl2O32SiO2), криолит (Na3[AlF6]). Встречается чистый Аl2O3 - корунд. В зависимости от содержания примесей корунд имеет различную окраску и названия. Драгоценные камни рубин и сапфир - это кристаллы корунда, окрашенные примесью оксида хрома (рубин) и оксидов титана и железа (сапфир). Алюминий получают электролизом расплава смеси глинозема с криолитом. Расплав Аl2O3 в криолите Na3[AlF6] подвергают электролизу при 950 С и напряжении 6-7 В. Протекаемые процессы: Аl2O3 = 2Аl3+ + 3O2- (диссоциация на ионы); на катоде: Аl3+ + 3е = Аl; на аноде: 2О2- - 4е = O2. Особо чистый алюминий, необходимый, например, в электронной технике, получают специальными методами — вакуумной дистилляцией или зонной плавкой. Физические и химические свойства алюминия. Алюминий - серебристо-белый металл. Очень мягок, легко вытягивается в фольгу. Кристаллизуется в ГЦК структуре. По электрической проводимости занимает четвертое место после серебра, золота и меди. На воздухе покрывается тончайшей пленкой (=10-5мм) Аl2O3, отличающейся большой прочностью. Защитная пленка надежно предохраняет металл от дальнейшего окисления. Почти все реакции с участием алюминия идут с латентным (скрытым) периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее. С пниктогенами и халькогенами алюминий взаимодействует при высокой температуре. С галогенами, за исключением йода, алюминий непосредственно не реагирует. Концентрированные серная и азотная кислоты пассивируют его, поэтому он в них не растворяется. Алюминий растворяется в соляной кислоте и в растворах щелочей: 2Аl + 6НСl = 2АlСl3 + 3Н2; 2Аl + 2NaOH + 6Н2O = 2Na[Al(OH)4] + 3Н2. Алюминий, лишенный защитной пленки, энергично взаимодействует с водой: 2Аl + 6Н2O = 2Аl(ОН)3 + 3Н2. Химическая связь в соединениях алюминия обладает большей долей ионности, чем в соединениях бора. Так, BF3 - газ, AlF3 - твердое соединение с высокой температурой плавления, его вполне можно назвать солью; галогениды АlСl3, АlВг3, АlI3 обнаруживают свойства, промежуточные между свойствами галогенидов неметаллов и солей. Ион Аl3+, имеющий малый радиус и большой заряд, проявляет склонность к комплексообразованию; причем у алюминия она больше, чем у магния, и меньше, чем у бора. Алюминий образует прочные комплексы с Н2O, ОН-, F-; как все s- и p-элементы не дает прочных комплексов с аммиаком и его производными. При комплексообразовании в химическую связь могут вносить вклад свободные d-орбитали атома алюминия. Этим объясняется возможность образования комплексов с КЧ = 6, например [Аl(Н2O)6]3+ (sp3d2-гибридизация). Соединения. Алюминий не вступает в реакцию с водородом. Гидрид алюминия получают косвенным путем, действуя гидридом лития в эфирном растворе на АlСl3: АlСl3 + 3LiH = АlН3 + 3LiСl. Гидрид алюминия АlН3 - белый порошок; это полимерное соединение (АlН3)n. Если предыдущую реакцию провести с избытком LiH, получаем тетрагидроалюминат лития: АlСl3 + 4LiН = Li[AlH4] + 3LiCl. Li[AlH4] - сильный восстановитель, бурно реагирует с водой с выделением водорода: Li[AlH4] + 4Н2O = LiOH + Аl(ОН)3 + 4Н2. При нагревании алюминий энергично взаимодействует с кислородом: 4Аl + 3O2 = 2Аl2O3 (к); G = -3164 кДж. Оксид алюминия Аl2О3 - очень твердое, тугоплавкое, химически стойкое соединение (т.пл. = 2072 °С, т.кип. = 3500 °С), разрушается лишь при длительном нагревании с кислотами или щелочами: Аl2О3 + 6НСl = 2АlСl3 + 3Н2O; В щелочных растворах образуются гидроксоалюминаты: Аl2O3 + 2NaOH + 7Н2O = 2Na[Al(ОН)4(Н2O)2]. Гидроксид алюминия Аl(ОН)3 - амфотерное соединение. Ему соответствуют два типа солей: соли алюминия (III), например Al2(SO4)3, AlCl3, и алюминаты - соли алюминиевых кислот. В водных растворах алюминаты существуют в виде гидроксокомплексов, например K[Al(OH)4], в расплавах - в виде солей несуществующей в свободном состоянии мета-алюминиевой кислоты, например, КАlO2. Схему равновесия в насыщенном водном растворе Аl(ОН)3 можно представить следующим образом: H2O Аl3+ + 3ОН- ⇄ Аl(ОН)3 ⇄ Н[Аl(ОН)4] ⇄ Н+ + [Аl(ОН)4]- Добавление кислоты (Н+) приводит к смещению равновесия в сторону образования катиона Аl3+ (солей алюминия катионного типа): Аl(ОН)3 + 3Н+ = Аl3+ + 3Н2O. Добавление щелочи (ОН-) - в сторону образования анионов (солей алюминия анионного типа): Аl(ОН)3 + ОН- = [Аl(ОН)4]-. Соли алюминия в водных растворах сильно гидролизованы. Реакция среды зависит от типа растворенной соли: Аl3+ + Н2O ⇄ АlOН2+ + Н+ при рН < 7. Соли Аl3+ и слабых кислот гидролизуются полностью с образованием осадков гидроксида алюминия или гидроксосолей алюминия: Аl(СН3СОО)3 + 2Н2O = АlOH(СН3СОО)2 + Аl(ОН)2СН3СОО + + СН3СООН. Вследствие сильного гидролиза многие соли алюминия не удается выделить из водных растворов (например, сульфид, карбонат, цианид и др.): Al2S3 + 6Н2O = 2Аl(ОН)3 + 3H2S Соли алюминия и кислородсодержащих кислот растворимы в воде. Исключение составляет фосфат алюминия АlРO4. Образование малорастворимого фосфата играет важную роль в жизнедеятельности организмов. Усвоение фосфора организмом замедляется в присутствии катионов Аl3+ вследствие образования в кишечнике малорастворимого фосфата алюминия. Это обстоятельство необходимо учитывать при назначении препаратов алюминия, например, средства против повышенной кислотности желудка Аl(ОН)3. В желудке гидроксид алюминия образует гель, который нейтрализует ионы гидроксония желудочного сока: Аl(ОН)3 + 3Н3O+ = Аl3+ + 6Н2O. Перешедшие в раствор ионы алюминия в кишечнике переходят в малорастворимую форму - фосфат алюминия: Аl3+ (р) + РО43- (р) = АlРO4 (т). В живых организмах с биолигандами (оксикислотами, полифенолами, углеводами, липидами) алюминий образует хелатные комплексные соединения. Как правило, связи с органическими лигандами он образует с помощью атомов кислорода. Например, при взаимодействии Аl3+ с полифенолами получаются комплексные соединения следующего состава: 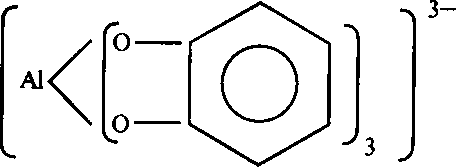 В стоматологической практике находят широкое применение соединения алюминия, например белая глина (каолин) Аl2O3 2SiO2 2Н2O. Последняя входит в состав цементов, которые используют как временный пломбировочный материал, а также для штамповки коронок. С сульфатами металлов в степени окисления +1 Al2(SO4)3 образует двойные соли типа Me2SO4 Al2(SO4)3 12Н2O. Эти соединения получили название алюминиевых квасцов, которые в твердом состоянии устойчивы, а в растворах диссоциированы на составляющие ионы. Квасцы хорошо растворимы в воде и кристаллизуются из растворов, образуя большие октаэдрические кристаллы. Гидроксид алюминия получают в виде аморфных осадков. Кристаллический Al(OH)3 можно получить, пропуская СO2 через щелочные растворы алюмината натрия: 2Na[Al(OH)4(H2O)2] + 2СO2 = 2Аl(ОН)3 + 2NaHCO3 + 4Н2O. |
