_+И_- спектрде ж_тылу жола_ыны_ болуы (1). И спектрде жтылу жолаыны болуы
 Скачать 363.11 Kb. Скачать 363.11 Kb.
|
*+платина электроды*сутегі электроды *хлор-күміс электроды *меркурсульфатты электрод *сурьма электроды #38 *!Салыстыру электроды *платина электроды*+каломель электроды *сынап электроды *сурьма электроды *күміс электроды #39 *!Ерітінді ортасының рН анықтайтын индикаторлы электрод *+сутегі электроды*каломель электроды *меркурсульфатты электрод*сынап электроды*мыс электроды #40 *!Салыстыру электроды *платина электроды*сынап электроды *+хлор-күміс электроды *сурьма электроды *күміс электроды #41 *!Электрон доноры *сутегі*оттегі *орта *+тотықсыздандырғыш *тотықтырғыш #42 *!Электрон акцепторы *сутегі*оттегі *орта *тотықсыздандырғыш *+тотықтырғыш #43*!Электрод потенциалы барлық температурада нөлге тең деп шартты түрде қабылданады*шыны электроды *сурьма электроды *хлор-күміс электроды *+сутегі электроды *хингидронды электрод #44 *!Тотықтырғыш және тотықсыздандырғыш қасиет көрсететін қосылыс: *KMnO4 *K2Cr2O7 *PbO2 *+MnO2 *Na2S #45 *!Тотығу-тотықсыздану электродының потенциалының заттың тотыққан және тотықсызданған түрлерінің активтілігіне тәуелділігін көрсететін формула *Илькович теңдеуі *Вант-Гофф теңдеуі *Бугер-Ламберт-Бер теңдеуі *Ом заңы *+Нернст теңдеуі #46 *!Мына келтірілген тотықтырғыштың қайсысы қышқыл, бейтарап және негіз ортада тотықтырады *K2Cr2O7 *K2CrO4 *KNO3 *H2O2 *+KMnO4 #47 *!Надхром қышқылындағы хромның тотығу дәрежесі *2*3 *4 *5 *+6 #48 *!Орталық атомның максималды координациялық саны немен анықталады *металдың табиғатымен*+лиганданың таби,атымен *органикалық реагенттің құрылысымен *комплексті қосылыстың құрылысымен *тәжірибе шарттарымен #49 *!Аралас-лигандты комплекс *екі орталық атомы бар комплекс*координациялық қанықпаған комплекс *+екі және одан да көп лиганды бар комплекс *координациялық қаныққан комплекс *полидентантты лигандасы бар комплекс #50*!Аналитикалық химияда комплексондарды кеңінен қолдануға себеп болған ерекшелік*комплексондардың полидентанттығы*+металл комплексонаттарының жоғары тұрақтылығы және стехиометрия (М:V=1:1) *металл комплексонаттарының түзілуінің әр түрлі жылдамдығы *комплексонаттардың әр түрлі және тән түсі *реагенттердің оңай табылуы #51 *!«Хелаттар» – ол *металл-лиганд арасындағы донорлы-акцепторлы байланысы бар комплекс*+оратлық атомы циклдің құрылымына кіретін комплекс *түзілген кезде H3O+ бөліне жүретін комплекс *органикалық реагенттері бар қосылыс *түзілген кезде H2O бөліне жүретін комплекс #52 *!Бидентантты лиганд *NH3 *F– *ЭДТА *CNS– *+C2O42- #53 *![Cu(NH3)2(CNS)2] комплекстің атауы *дироданоаминокупрат*роданодиаминокупрат *+дироданодиамминокупрат *роданоаминокупрат *роданоаминомыс #54 *!Комплексті қосылыстардың ішкі және сыртқы сфераларының арасындағы байланыс *+иондық*сутектік *металдық *донорлы-акцепторлы *молекулалық #55 *!(NH4)2 [Pt(OH)2Cl4] комплекстің атауы *аммоний хлориддигидроксоплатинаты (IV) *аммоний тетрахлоридгидроксоплатинаты (IV) *аммоний хлоридгидроксоплатинаты (IV) *+аммоний тетрахлородигидроксоплатинаты (IV) *аммоний тетрахлоридгидроксоплатинаты (IV) #56 *!Монодентантты комплексті қосылыс *+K3[Fe(CN)6] *Na2[Fe(SO4)2] *K3[Fe(C2O4)3] *Na2[Fe(PO4)2] *[Cr(NH3)4CO3]Cl #57 *!Полидентантты комплексті қосылыс *K3[Fe(CN)6] *+Na2[Fe(SO4)2] *K4[Fe(CN)6] *Na3[Co(NO2)6] *[Ag(NH3)2]Cl #58 *!Қос тұз болып табылатын қосылыс: *CuSO4·5H2O *FeSO4·7H2O *H2C2O4·2H2O *+(NH4)2Fe(SO4)2·6H2O *Na2SO4·10H2O #59 *!Қос тұз болып табылатын қосылыс: *MgOHCl *Cu2(OH)2SO4 *K4[Fe(CN)6] *H2C2O4·2H2O *+KAl(SO4)2·12H2O #60 *!Ең тұрақты комплексті ион *KH = ([Ag(CN)2]– = 1,0 ∙ 10-4 *KH = ([Cd(CN)4]2– = 7,66 ∙ 10-18 *KH = ([Cu(CN)2]– = 1,0 ∙ 10-24 *+KH = ([Fe(CN)6]4– = 1,0 ∙ 10-31 *KH = ([Ni(CN)4]2– = 1,0 ∙ 10-22 #61 *!Ішкі сферадағы комплекстүзуші мен лиганда арасындағы байланыс *металдық *иондық *полярсыз ковалентті *сутектік *+донорлы-акцепторлық #62 *!Орталық ион - комплекстүзушінің айналасына жиналған лигандалар саны: *Ішкі сфера заряды. *Комплексті ионның заряды. *+Координациялық сан. *Лиганда заряды. *Комплекстүзуші заряды. #63 *![Сu(NH3)4]SO4 комплексіндегі комплекс түзушінің кординациялық саны *6 *2 *5 *3 *+4 *!Концентрациясы 0,01 моль/л КOH ерітіндісінің рН *10-2 *10-12 *2,0 *+12 *1,0 #2 *!Концентрациясы 0,01 моль/л NaOH ерітіндісінің рН: *2 *5 *7 *9 *+12 #3 *!0,01 н HCl ерітіндісінің рОН: *2 *5 *7 *9 *+12 #4 *!Ерітінді рН=3 болған кездегі H+ иондарының концентрациясы: *10-1 *+10-3 *10-5 *10-7 *10-9 #5 *!Ерітінді рН=6 болған кездегі OH- иондарының концентрациясы: *10-2 *10-4 *10-6 *+10-8 *10-10 #6 *!Қышқыл концентрациясы 0,1 моль/л (Ка = 10-6), тұз концентрациясы 0,01 моль/л тең болатын буфер жүйесінің рН: *1 *3 *+5 *7 *9 #7 *!Негіз концентрациясы 0,05 моль/л (Кв = 10-7), тұз концентрациясы 0,5 моль/л тең болатын буфер жүйесінің рН: *2 *4 *+6 *8 *10 #8 *!0,01 М әлсіз бірқышқылды негіз ерітіндісінің рН = 10. Негіздің диссоциациялану константасы: *1·10-20 *1·10-18 *1·10-10 *1·10-8 *+1·10-6 #9 *!0,1 М әлсіз бірнегізді қышқыл ерітіндісіндегі сутегі ионының концентрациясы 10-5 моль/л. Қышқылдың диссоциациялану константасы: *1·10-1 *1·10-5 *1·10-6 *1·10-10 *+1·10-9 #10 *!K(NH4OH) = 10-5 тең, 0,001н NH4OH ерітіндісінің рОН мәні: *1*2*3*+4*5#11 *!Ацетат буфері ерітіндісінің сутегі ионы концентрациясын есептейтін формула: * 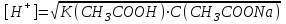 *+ 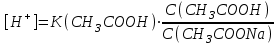 * 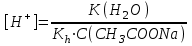 * 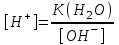 * 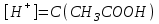 #12 *!Сутегі ионының концентрациясы [H+] = 4,5·10-9 моль/л ерітіндідегі гидроксил ионының концентрациясы [OH-] *2,2·10-4 *2,2·10-5 *+2,2·10-6 *2,2·10-7 *2,2·10-8 #13 *!Гидроксилдік көрсеткішті pOH анықтайтын формула *–ln CH+ *+– lgCOH- *–lg H+ *– lnCOH- *+ lgCOH- #14 *!25 °С температурадағы судың иондық көбейтіндісінің көрсеткіші *1·10-14 *1·10-7 *7 *+14 *1·1014 #15 *!Концентрациясы CЭ = 0,01 моль/л H2SO4 ерітіндісінің рН мәні *1 *+2 *3 *4 *5 #16 *!K(CH3COOH) = 10-5 тең, 0,001 н CH3COOH ерітіндісінің рН: *1*2*3*+4*5 #17 *!Әлсіз электролиттер үшін сутек иондарының концентрациясын есептейтін формула: *+[H+] = α ∙ Cобщ *[H+] = α + Cобщ *[H+] = CH+ *[H+] = CHAn *[H+] = α #18 *!Әлсіз қышқылдар үшін сутек иондарының концентрациясын есептейтін формула: * 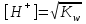 * 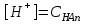 *+ 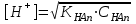 * 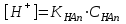 *[H+] = √KW ∙ CH+ #19 *!Әлсіз қышқылдар үшін сутек иондарының концентрациясын есептейтін формула: *[H+] = √KW *[H+] = CHan *+[H+] = √KHAn ∙ CHAn *[H+] = CKtOH *[H+] = √KW ∙ CH+ #20 *!0,001М азот қышқылы ерітіндісі үшін рН-тың теңдеуі: *ln10-3 *-ln10-3 *10-3 *+-lg10-3 *-ln103 #21 *!Эквивалентінің молярлық концентрациясы 0,1 моль/л кальций гидроксиді ерітіндісі үшін рН-тың теңдеуі: *14 - ln10-1 *14 - lg10-1 *14 + ln10-1 *+14 + lg10-1 *10-14 #22 *!K(CH3COOH) = 10-5 тең, 0,1н CH3COOH ерітіндісінің рН мәні *1 *2 *+3 *4 *5 #23 *!Концентрациясы 10-3 моль/л NaOH ерітіндісінің рН мәні *2*5*7*9*+11 #24 *!Сутектік көрсеткіші 5 тең, ерітіндінің сутегі ионының H+ концентрациясы неге тең *10-1 *10-3 *+10-5 *10-7 *10-9 #25 *!Сутектік көрсеткіші 7,53 тең, қанның сутегі ионының концентрациясы CH+: *2,95·10-6 *2,95·10-7 *+2,95·10-8 *2,95·10-9 *2,95·10-10 #26 *!Концентрациясы 10-3 н HCl ерітіндісінің рOН мәні *2*5*7*9*+11 #27 *!K(CH3COOH) = 10-5 тең, 0,001 н CH3COOH ерітіндісіне концентрациясы 0,001 моль/л CH3COONa ерітіндісі қосылғаннан кейінгі буфер ерітіндісінің рН мәні *1 *2 *3 *4 *+5 #28 *!Концентрациясы 10-2 моль/л NaOH ерітіндісінің рН мәні *8*9*10*11*+12 #29 *!Концентрациясы 10-2 н HCl ерітіндісінің рOН мәні *8*9*10*11*+12 #30 *!рН=8, ерітіндінің сутегі ионының H+ концентрациясы *10-3 *10-6 *+10-8 *10-9 *10-10 #31 *!Сутектік көрсеткіші 4 тең, ерітіндінің гидроксил ионының OH- концентрациясы *10-2 *10-4 *10-6 *10-8 *+10-10 #32 *!Әлсіз қышқыл ерітінділерінің рН мәнін есептейтін формула: *pH = –lgCH+ *pH = 14 – pOH *pH = 14 – pKb + lg Cb/Cs *+pH = 0,5 pK – 0,5 lgCa *pH = 14 + lgCOH- #33 *!Сілті ерітінділерінің рН мәнін есептейтін формула: *pH = –lgCH+ *pH = 14 – pKb + lg Cb/Cs *pH = 0,5 pK – 0,5 lgCa *pH = ½ pKW – ½ lgCb - ½ lgCC- *+pH = 14 + lgCOH- #34 *!Әлсіз негіздердің рН мәнін есептейтін формула: *+pH = 14 – 0,5 pKb + 0,5 lgCb *pH = 14 + lgCOH- *pH = –lgCH+ *pH = ½ pKW – ½ lgCb - ½ lgCs *pH = 14 – pKb + lg Cb/Cs #35 *!Негіздік буфер жүйелеріне арналған Гендерсон-Гассельбах теңдеуі *pH = –lgCH+ *+pH = 14 – pKb + lg Cb/Cs *pH = 14 – lgCOH- *pH = 0,5 pK – 0,5 lgCa *pH = ½ pKW – ½ lgCb - ½ lgCs #36 *!Күшті қышқыл мен әлсіз негізден тұратын тұздың рН мәнін есептейтін формула: *pH = –lgCH+ *pH = 14 – pKb + lg Cb/Cs *pH = 0,5 pK – 0,5 lgCa *+pH = ½ pKW – ½ lgCb - ½ lgCs *pH = 14 + lgCOH- #37 *!Концентрациясы 0,001 моль/л КОН ерітіндісінің рН: *10-2 *10-12 *12 *+11 *13 #38 *!0,1М азот қышқылы ерітіндісі үшін рН-тың теңдеуі: *ln10-1 *-ln10-1 *10-1 *+-lg10-1 *-ln101 #39 *!Әлсіз қышқыл ерітінділерінде сутегі ионының концентрациясы *CH+ = Cк-ты *+CH+ = C ∙ α *CH+ = 10-14/COH- *CH+ = COH- = 10-7 *CH+ = –lgCH+ #40 *!Ерітіндінің рН=6, гидроксид ионының OH- концентрациясы: *10-2 *10-4 *10-6 *+10-8 *10-10 #41 *!Егер Cқыш = 0,1 моль/л; Cтұз = 0,1 моль/л; Kқыш = 10-6 болса, буферлі ерітіндінің рН мәні *1 *3 *+5 *7 *9 #42 *!Егер Cнегіз = 0,05 моль/л; Cтұз = 0,05 моль/л; Kнегіз = 10-7 болса, буферлі ерітіндінің рН мәні *2 *4 *+6 *8 *10 #43 *!Реакция ортасының рН = 7,2 болу үшін қолданылатын буфер *ацетат буфері *аммоний буфері *формиат буфері*гидрокарбонат буфері *+фосфат буфері #44 *!Тотығу-тотықсыздану потенциалы мәніне сутегі ионының концентрациясы максималды әсер ететін жартылай реакция: *Mn2+ – 2e + 2H2O ↔ MnO2 + 4H+ *+Mn2+ – 5e + 4H2O ↔ MnO4– + 8H+ *MnO2 – 3e + 2H2O ↔ MnO4– + 4H+ *MnO2 – 2e + 4OH– ↔ MnO4– + 2H2O *MnO42– – e ↔ MnO4– #45 *!Тотығу-тотықсыздану потенциалы мәніне сутегі ионының концентрациясы максималды әсер ететін жартылай реакция: *Cr2+ + 2e ↔ Cr0 *Cr3+ + 3e ↔ Cr0 *Cr3+ + e ↔ Cr2+ *CrO42- + 3e + 4H2O ↔ Cr(OH)3 + 5OH– *+Cr2O72- + 6e + 14H+ ↔ 2Cr3+ + 7H2O #46 *!Тотығу-тотықсыздану реакциясының бағытын анықтайтын формула: *E = E0 + 0.058/n ∙ lg aox/ared *+E = Eox0 – Ered0 *K = 10^(E10 – E20)n/0.058 *Kn = Np/Nm *Cэp` = Cэp`` ∙ Vp`` / Vp` #47 *!Тотығу-тотықсыздану реакциясының тепе-теңдік константасын анықтайтын формула: *E = E0 + 0.058/n ∙ lg aox/ared *E = Eox0 – Ered0 *+K = 10^(E10 – E20)n/0.058 *Kn = Np/Nm *Cэp` = Cэp`` ∙ Vp`` / Vp` #48 *!Sn0 + Hg(NO3)2 = Sn(NO3)2 + Hg0 химиялық реакцияның гальваникалық элементтің сызбасы *+Sn/Sn2+//Hg2+/Hg *Hg/Hg2+//Sn2+/Sn *Hg/ Sn2+//Hg2+/Sn *Sn2+// Sn/Hg//Hg2+ *Hg2+// Hg/Sn/Sn2+ #49 *!HCl ерітіндісінің концентрациясы 0,1 моль/л, сутегі электродының потенциалының мәні |
