Методичка Растворы . решение задачdoc. I. Теоретические вопросы Растворы. Растворами
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Реши самостоятельно: 1.Смешали 20 г сахара и 250 мл воды. Какова массовая доля сахара в полученном растворе? 2. Смешали 5 г сахара и 150 мл воды. Какова массовая доля сахара в полученном растворе? 3. Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе? 4.Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе? 5. Смешали нитрат натрия NaNO3в количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в полученном растворе? 4. Задачи на определение процентного содержания веществ в растворе (4-ый тип): Примеры: 1.К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе? 2. К 120 г 1 %-ного раствора сахара прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном растворе? Примеры: Решение 1-ой задачи:
Решение 2-ой задачи:
Реши самостоятельно: 1. К 200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе? 2. К 90 г 6 %-ного раствора поваренной соли прилили 200 мл воды. Каково процентное содержание поваренной соли во вновь полученном растворе? 3. К 140 г 15 %-ного раствора сахара долили 160 мл воды. Каково процентное содержание сахара во вновь полученном растворе? 4. К 200 г 40 %-ного раствора уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной кислоты во вновь полученном растворе? 5. К 80 г 30 %-ного раствора щелочи долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном растворе? 2.2. Молярная концентрация раствора (См) – количество вещества, растворенного в 1000 мл раствора (1 л), (выражается числом молей в одном литре раствора). 1м одномолярный раствор = 1 моль/л 2 м двумолярный раствор =2 моль/л 0,1 м децимолярный раствор 0,2 м двудецимолярный раствор 0,01 м сантимолярный раствор 0,001 м милимолярный раствор где М – молярная масса растворенного вещества, V – объем полученного раствора или Нахождение массы растворенного вещества: Примеры: Приготовить децимолярный раствор сульфата натрия. См=0,1 м М (Na2SО4)=142 г/моль m(Na2SО4)=142 Отвешиваем 14,2 г сульфата натрия, высыпаем в мерную колбу и доливаем воды до 1 литра. Приготовить 600 мл 2 м раствора карбоната натрия.
Реши самостоятельно: Сколько грамм тиосульфата натрия Na2S2O3 66,8 г серной кислоты растворили в 133 г воды. Определите молярную концентрацию если раствор с плотностью 1,25 гр/см3. Вычислите молярность раствора, приготовленного в мерной колбе на 500 мл из 4,98 г КI. Рассчитайте массу вещества Na2СО3, содержащегося в 200 мл 0,24 М раствора. Определите молярную концентрацию вещества в растворе CuSO4, приготовленном в мерной колбе на 500 мл из 11,25 г кристаллогидрата CuSO4 2.3. Нормальная концентрация или эквивалентная (Сн, Сэ, СN) –выражается числом эквивалентов растворенного вещества в 1 л раствора. где Э – эквивалент растворенного вещества, V – объем или Нахождение массы растворенного вещества: Эквивалент – реальная или условная частица вещества, которая химически равноценна одному иону водорода (для обменных реакций) или одному электрону (для окислительно – восстановительных реакций). Фактически это частица, обладающая одной единицей валентности или оперирующая одним электроном. Эквиваленты сложных веществ находятся: Примеры: Приготовить 400 мл сантинормального раствора сульфата натрия. Сн=0,01 н V=400 мл М(Na2SO4)=142 г/моль преобразуем формулу Э(Na2SO4)=71 m(Na2SO4)=0,01 2. Определить нормальную концентрацию раствора содержащего 30 г хлорида алюминия в 500 мл раствора.
Реши самостоятельно: Сколько грамм азотной кислоты содержится в 2 л ее 0,1 н раствора? Сколько гр. ортофосфорной кислоты нужно для приготовления 10 мл 0,02 н раствора? Какой объём 0,5 н раствора можно приготовить из 24,44 г кристаллогидрата хлорида бария ВаСl2 Для нейтрализации 25 мл раствора серной кислоты потребовалось 40 мл 0,1 н раствора гидроксида натрия. Определите Сн раствора кислоты. Какую реакцию имеет раствор, полученный при смешивании 100 мл 0,1 н раствора серной кислоты с 50 мл 0,5 н раствора гидроксида калия? Сколько грамм образуется сульфата калия? 2.4.Моляльная концентрация (Сm) – выражается числом молей растворенного вещества в 1000 г растворителя 2.5. Переходы концентраций. 1. Переход от процентной концентрации к молярной концентрации: 2. Переход от процентной концентрации к нормальной концентрации: 3. Переход от молярной концентрации к процентной концентрации: 4. Переход от нормальной концентрации к процентной концентрации: Примеры: 1. Определить нормальную концентрацию 20 % - ного раствора серной кислоты , если ρ=1,14 г/см3.
Реши самостоятельно: 1. Найти молярную концентрацию 60 % - ного раствора азотной кислоты, если плотность раствора равна 1,373 г/см3. 2. Определить С% двунормального раствора серной кислоты с плотностью 1,063 г/см3. 66,8 г серной кислоты плотностью = 1,25 г/см3 растворили в 133,2 г воды. Определите С%, См, Сн . 3. Какой объём 68% - ного раствора азотной кислоты плотностью 1,4 г/см3 требуется для приготовления 50 мл 2 н раствора? 4. Найдите молярную концентрацию вещества Na2SO4 в 12% - ном растворе с плотностью 1,11 г/мл. 5. 2 л хлора при (н.у.) растворены в 5 л воды. Определите процентную и молярную концентрации полученного раствора, если объем раствора принять равным объему воды. 2.6. Способы вычисления при приготовлении разбавленных растворов из концентрированных. 1) 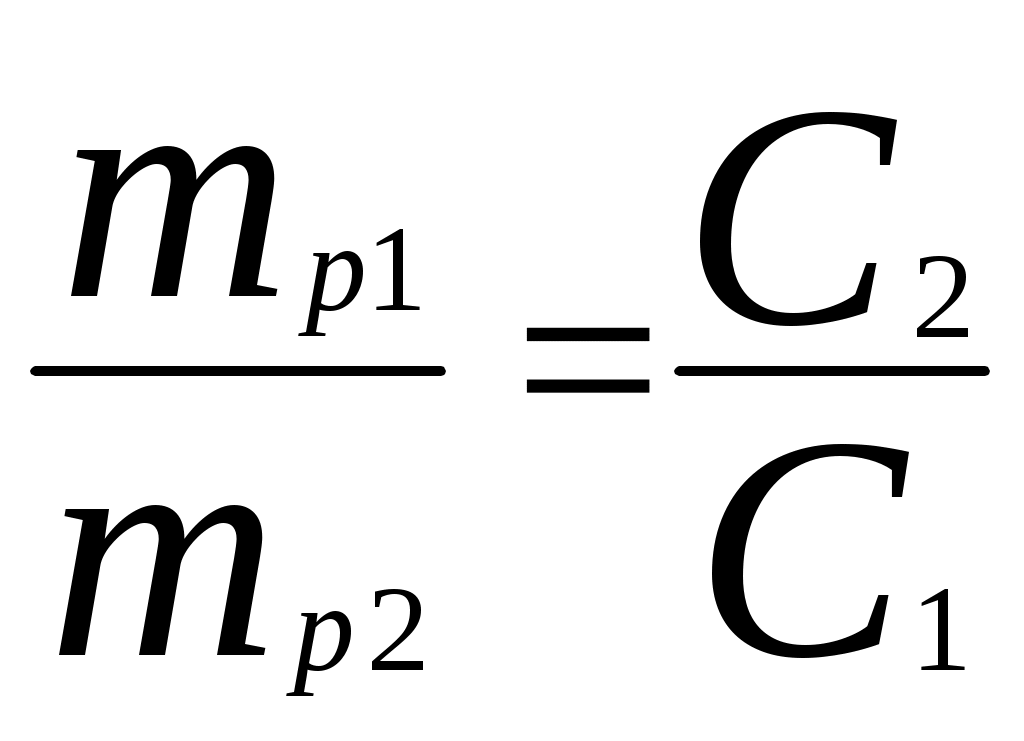 ; ;2) 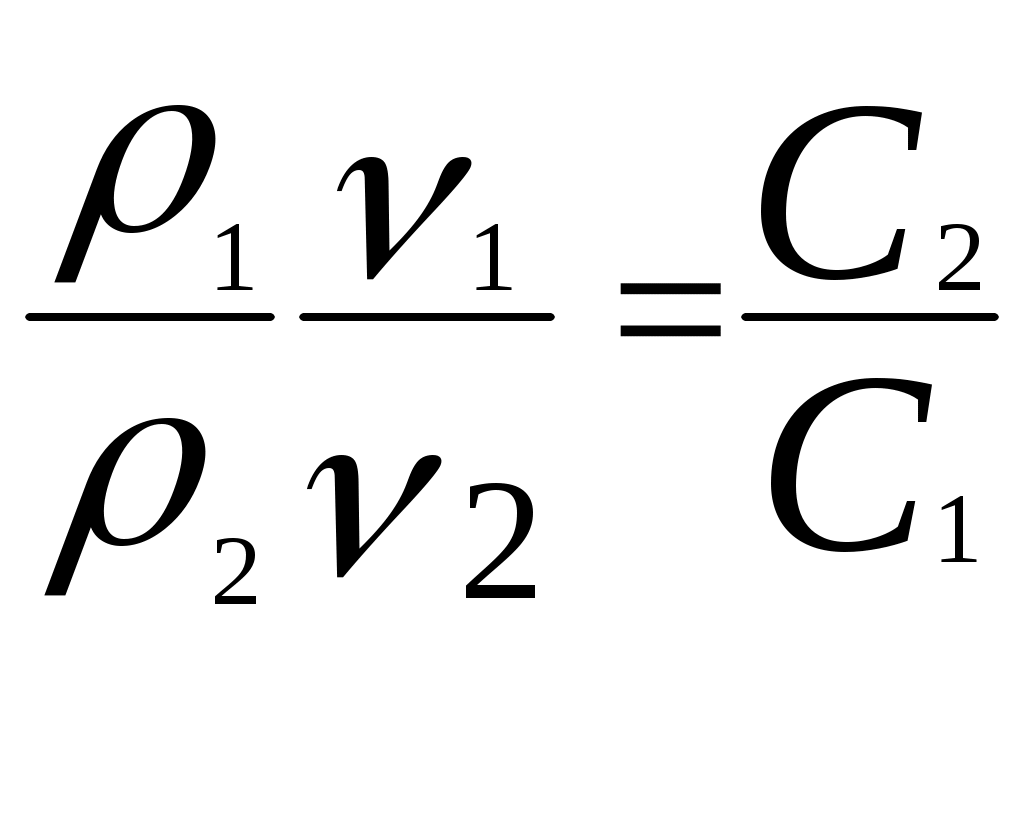 Пример: Для получения суперфосфата применяют 65%-ный раствор серной кислоты. Сколько 92%-ного раствора серной кислоты и воды потребуется для приготовления 1 т этого раствора?
Реши самостоятельно: 1. Какие объемы 37 % раствора НСl (ρ=1,19 г/см3) и воды нужны для приготовления 1 л 10 % раствора (ρ=1,049 г/см3). 2.Какие объёмы 95% раствора серной кислоты (ρ=1835 г/л) и воды нужно для приготовления 1 л 25% раствора (ρ=1180 г/л). 3.Сколько 65% -ного раствора азотной кислоты и воды нужно взять для приготовления 500г 15%-ного раствора этой кислоты? 4.Какие объемы 30% ортофосфорной кислоты (ρ=1,18 г/см3) и воды нужны для приготовления 100 л 8% раствора (ρ=1,04 г/см3). 5.Сколько 22 н. раствора плавиковой кислоты (ρ=1123 г/л) и 10 н. раствора плавиковой кислоты (ρ=1036 г/л) потребуется для приготовления 20 н. раствора? 2.7. Способы вычисления при смешивании растворов. Метод «креста», диагональная схема, правило смешивания, «Андреевский крест». Используется для решения задач для двух компонентов смеси при условии, что свойство компонентов поддаются аддитивному сложению. А- m, масса, объем или количество первого компонента; В - m, масса, объем или количество второго компонента; А+В , m, масса, объем или количество смеси; Х1- свойство первого компонента; Х2- свойство второго компонента; Х – свойство смеси. Свойства: плотность твердого вещества, относительная плотность, относительно атомная масса, относительно молекулярная масса, молярная масса, концентрации (С%, Сн, См, Сm), стехиометрический множитель. 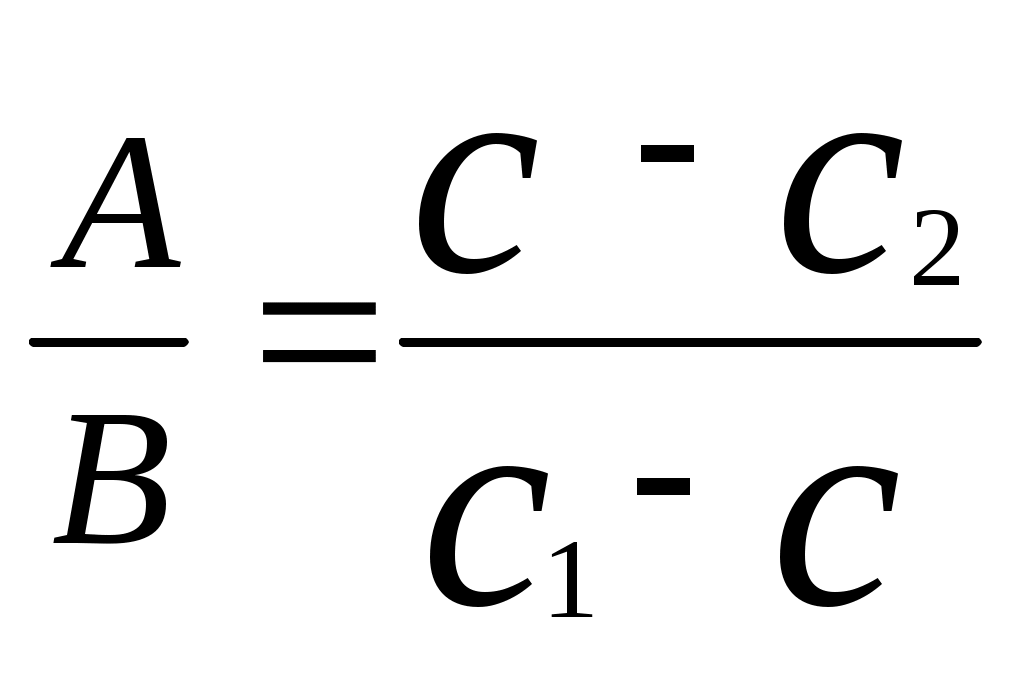 , , отношение компонентов обратно пропорционально разности величин свойств (концентраций) компонентов и смеси диагональная схема   х1 х-х2 х1 х-х2Х   х2 х1-х х2 х1-хПравило смешения не применимо к расчету объемов растворов, концентрация которых выражается через отношение к объему (кроме, слабо разбавленных). Пример: В каком отношении должны быть взяты объемы 0,5 н. раствора и 0,1 раствора, чтобы получить 0,2 н. раствор?
|

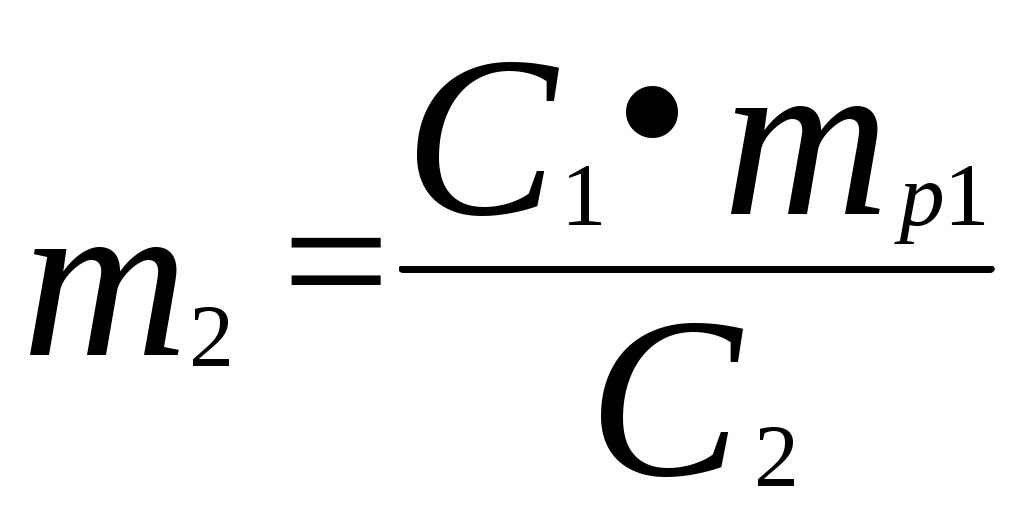
 ,5 0,2-0,1
,5 0,2-0,1