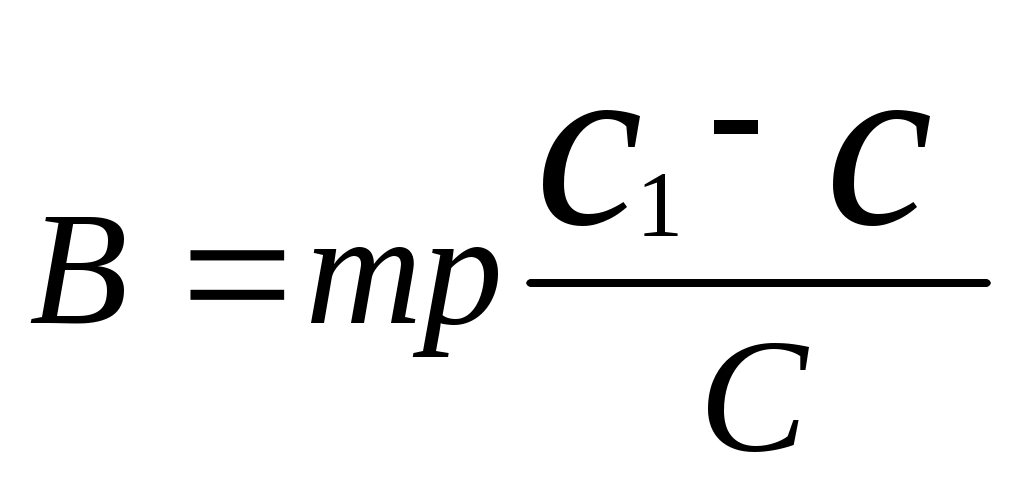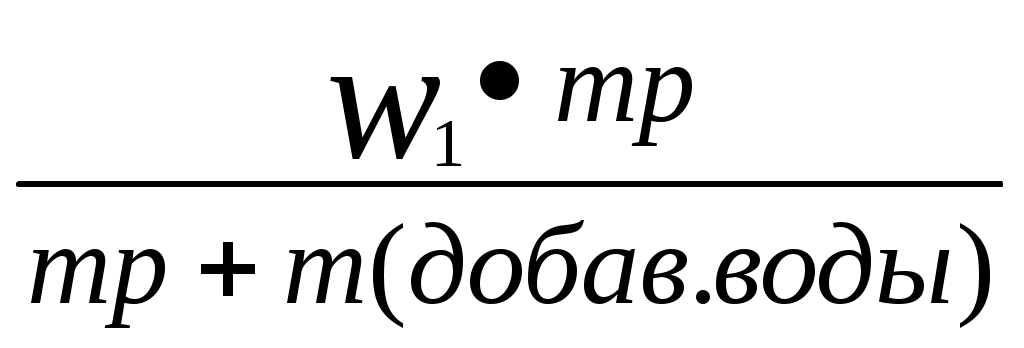Методичка Растворы . решение задачdoc. I. Теоретические вопросы Растворы. Растворами
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Реши самостоятельно: Вычислите массовую долю раствора полученного смешиванием 1000 т 60% раствора с 250 т 96% раствора. Сколько грамм воды и 87% раствора серной кислоты необходимо взять для приготовления 600 г 55% раствора? Сколько граммов 8% и 75% растворов необходимо взять для приготовления 400 г 42 % раствора? Уксусная эссенция – 80% раствор уксусной кислоты (СН3СООН). Сколько граммов этой эссенции и воды необходимо взять для приготовления 200 мл 3 % раствора уксуса применяемого как приправа к пище? Плотность эссенции можно принять равной 1 г/см3. Сколько грамм нужно взять 20% и 32,1 % растворов соляной кислоты, чтобы приготовить 242 г 26,7% раствора соляной кислоты? 2.8. Расчет массы воды, которая прибавляется к раствору для разбавления его. 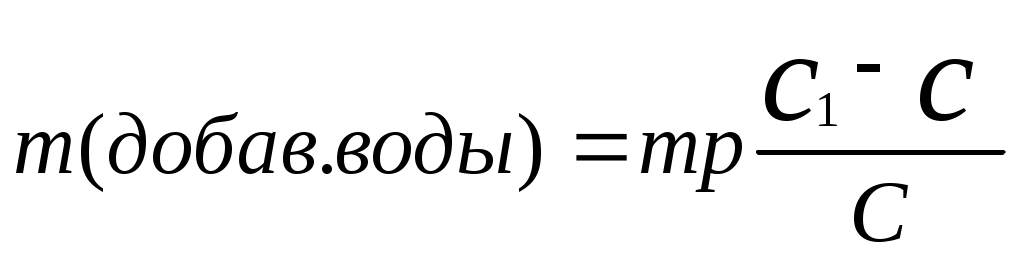 , или , или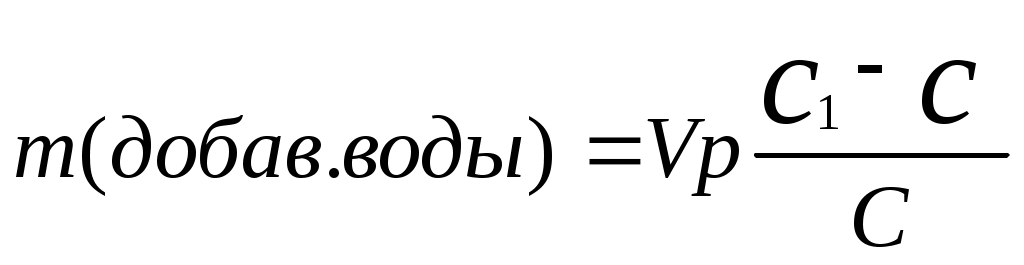 , где , где С1 – исходная концентрация, С – получившаяся концентрация, m – масса раствора, V – объем раствора. Преобразованная формула нахождения концентрации C= 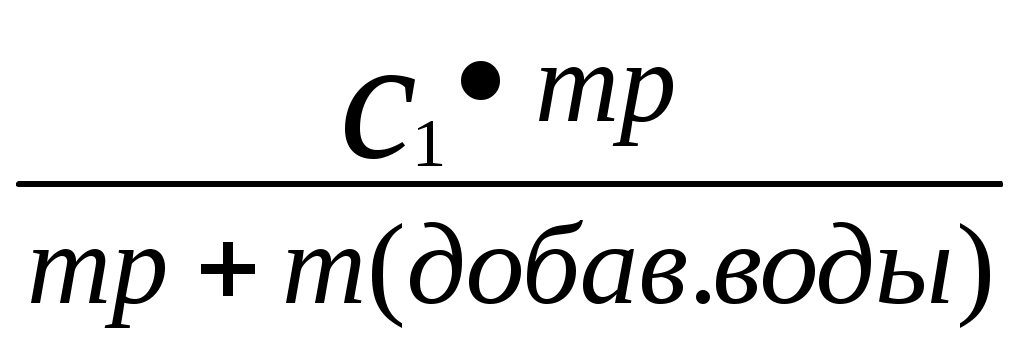 Расчет концентрации раствора при добавлении к раствору вещества. 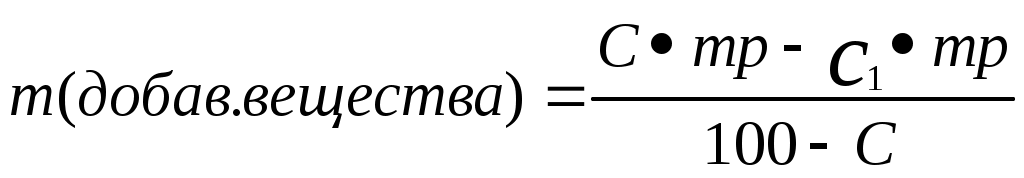 Пример: К 327,5 г 50% – ного раствора вещества добавили 140 г воды. Массовая доля вещества в конечном растворе равна?
Реши самостоятельно: К 400 г раствора, массовая доля гидроксида калия в котором 0,45, добавлено 100 г воды. Какова массовая доля щелочи в получившемся растворе? В 200 г 2%-ного раствора поваренной соли растворили 20 г хлорида натрия. Какова массовая доля хлорида натрия в полученном растворе? К 450 г 15 %-ного раствора гидроксида кальция добавили 60 г того же вещества. Массовая доля в конечном растворе равна? Какую массу воды надо добавить к 200 г 70%-ного раствора уксусной кислоты, чтобы получить 9%-ный раствор? К 300 г 10%-ного раствора сахарозы добавили 150 мл воды. Какова массовая доля сахарозы в полученном растворе? 2.9. Упаривание раствора. Задача № 1. Вычислите массу воды, которую надо выпарить из 1 кг 3%- ного раствора сульфата меди для получения 5% - ного раствора. Решение: для решения данной задачи так же возможно применение рассмотренного выше способа. Проанализировав условие, составим схему: 0,03 0 0,05 1 кг х кг 1 кг - х кг - = исходный вода полученный раствор раствор Составим и решим уравнение: 1· 0,03 – х · 0 = (1 – х) · 0,05 0,03 = 0,05 – 0,5х 0,05х = 0,02 х = 0,4 Ответ: масса воды составит 0,4 кг или 400 г. Задача № 2. Вычислите массовую долю хлорида натрия в растворе, если из 30г 10 % раствора соли при нагревании испаряется 10 мл воды. Решение: определим массу испарившейся воды, зная, что плотность воды равна 1г/мл. m (H2 O) = 10 мл · 1г/мл = 10г Составим схему к задаче: 0,1 0 х 30 г 30г – 10 г 10 г - = исходный вода полученный раствор раствор На основании схемы составим уравнение: 30 · 0,1 – 10 · 0 = ( 30 -10) · х 3 = 20 х х = 0,15 = 15% Ответ: массовая доля соли в полученном растворе 15% Задача № 3. Раствор соли объемом 80 мл, имевший плотность 1,1 г/мл выпарили, получив 12 г сухого остатка. Определите массовую долю соли в исходном растворе. Решение: определим массу исходного раствора по формуле m = V·ρ m (раствора) = 80 мл · 1,1г/мл = 88 г Составим схему к задаче: х 0 1% 88 г 12 г - = исходный вода сухой раствор остаток Составим уравнение: 88 · х = 12 · 1 88х = 12 х = 12 : 88 х = 0,136 = 13,6% Ответ: массовая доля соли в исходном растворе составляла 13,6 % Реши самостоятельно: 1. Из 170 г 9% раствора выпарили 50 г растворителя. Определите массовую долю соли в полученном растворе. 2. Определите массу воды, которую нужно выпарить из 340 г раствора хлорида цинка с массовой долей соли 4% чтобы массовая доля соли в полученном растворе увеличилась на 1,5%. 3. Раствор соли объемом 60 мл, имевший плотность 1,3 г/мл, с массовой долей соли 3% нагрели. В результате испарилось 10 мл воды. Определите массовую долю соли в полученном растворе. 4. Вычислите массовую долю хлорида натрия в растворе, если из 50г 10 % раствора соли при нагревании испаряется 20 мл воды. 5. Вычислите массу воды, которую надо выпарить из 2 кг 5%- ного раствора сульфата натрия для получения 7% - ного раствора. 2.10. Смешивание растворов разных концентраций. Задача № 1. Вычислить массовую долю гидроксида натрия в растворе, полученном при сливании 10 мл 40% раствора (плотность 1, 52 г/ мл) и 10 мл 10% раствора (плотность 1,1 г/мл). Решение: определим массы исходных растворов. m1 = 10· 1,52 г/мл =15,2 г m2 = 10 · 1,1 г/ мл = 11 г Согласно условию задачи составим схему: 15,2 г 0,4 0,1 х 11 г 15,2г + 11 г + = раствор 1 раствор 2 полученный раствор Составим уравнение: 15,2 · 0,4 + 11 · 0,1 = (15,2 + 11) · х 6,08 + 1,10 = 26,2 х 7,18 = 26,2х х = 7,18 : 26,2 х = 0,274 = 27,4% Ответ: массовая доля гидроксида натрия в полученном растворе составляет 27,4%. Задача № 2. Смешали два раствора: один массой 90 г и с массовой долей соли 5%, другой массой 125 г и с массовой долей этой же соли 4%. Вычислите массу соли в образовавшемся растворе. Решение: определим массовую долю соли в получившемся растворе. Для этого составим схему: 90 г 0,05 0,04 х 125 г 90 г + 125 г + = раствор 1 раствор 2 полученный раствор Используя данную схему, составим уравнение: 90 · 0,05 + 125 · 0,04 = (90 + 125) · х 4,5 + 5 = 215х 9,5 = 215х х = 9,5 : 215 х =0,044 = 4,4% Далее, применив формулу для вычисления массовой доли вещества в растворе, рассчитаем массу соли. m (соли) = 4,4% · 215г : 100% = 9,46 г Ответ: масса соли составляет 9,46 г Задача № 3. Сколько граммов 75% раствора кислоты надо добавить к 30 г 15% раствора кислоты, чтобы получить 50% раствор? Решение: составим схему 0,75 0,15 0,5 х г х г + 30г 30 г + = На основании данной схемы составим и решим уравнение: 0,75 · х + 30 · 0,15 = (х + 30) ·0,5 0,75х + 4,5 = 0,5 х + 15 0,25х = 10,50 х = 10,50 : 0,25 х = 42 г Ответ: необходимо добавить 42 г 75% раствора кислоты. Задача № 4. Какой объем раствора с массовой долей серной кислоты 60% (плотность 1,5 г/мл) и раствора с массовой долей серной кислоты 30% (плотность 1,2 г/мл) надо взять для приготовления раствора массой 240 г с массовой долей кислоты 50%? Решение: Обозначим массу 1-го раствора – х г, тогда масса 2-го раствора – (240 – х) г. На основании этих данных составим схему: 0,6 0,3 0,5 х г 240г - х г 240г + = Составим уравнение: 0,6 · х + (240 – х) · 0,3 = 240 · 0,5 0,6х + 72 – 0,3х = 120 0,3х = 120 – 72 0,3х = 48 х = 160г – масса 1-го раствора масса 2-го раствора = 240 – 160 = 80 г Найдем объем растворов: V1 = m / ρ = 160 : 1,5 = 106,7 мл V2 = m / ρ = 80 : 1,2 = 66,7 мл Ответ Объемы растворов равны 106,7 мл и 66,7 мл Задача № 5. В лаборатории имеется 2 кг раствора кислоты одной концентрации и 6кг раствора кислоты другой концентрации. Если растворы смешать, то получится раствор, концентрация которого составляет 36%. Если же смешать равные массы этих растворов, то получится раствор, содержащий 32% кислоты. Какова концентрация каждого из двух имеющихся растворов? Составим схемы. Схема №1: х у 0,36 2кг 2 кг + 6 кг 6кг + = Схема № 2 m кг х у 0,32 m кг (m +m) кг + = Составим и решим систему уравнений: 2 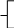 х + 6у = 8 · 0,36 х + 6у = 8 · 0,36mх + mу = 0,64m 2 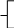 х + 6у = 2,88 х + 6у = 2,88х + у = 0,64 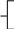 2х + 6у = 2,88 х = 0,64 – у 2 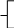 · (0,64 – у) + 6у = 2,88 · (0,64 – у) + 6у = 2,88х = 0,64 – у 1 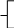 ,28 – 2у + 6у = 2,88 ,28 – 2у + 6у = 2,88х = 0,64 – у 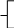 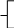 4у= 1,6 у= 0,4 = 40% х = 0, 64 - у ; х = 0,24 = 24% Ответ: концентрации растворов 24% и 40% Задачи для закрепления: 1. В лаборатории имеются растворы с массовой долей хлорида натрия 10 и 20%. Какую массу каждого раствора надо взять для получения раствора с массовой долей соли 12% массой 300 г? 2. Смешали 250 г 10% и 750 г 15% растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе. 3. Какова будет массовая доля азотной кислоты в растворе, если к 40 мл 96% раствора HNO3 (плотность 1,5 г/мл) прилить 30 мл 48% раствора HNO3 (плотность 1,3 г/мл)? 4. Смешали 30% раствор соляной кислоты с 10% и получили 600 г 15% раствора. Сколько граммов каждого раствора было взято? 5. Кусок сплава меди и цинка массой 36 кг содержит 45% меди. Какую массу меди нужно добавить к этому куску, чтобы полученный новый сплав содержал 60% меди? 2.11. Приготовление растворов из навески кристаллогидрата. Задача № 1. Сколько граммов кристаллогидрата Na2SO4 · 10 H2O необходимо добавить к 50 мл 8% раствора сульфата натрия (плотность 1,07 г/ мл), чтобы увеличить массовую долю вещества в растворе в 3 раза? Решение: решая данную задачу, учтем, что кристаллогидрат это вещество, в кристаллической решетке которого содержатся молекулы воды. Поэтому вычислим массовую долю безводной соли в составе данного кристаллогидрата. Мr (Na2SO4 · 10 H2O) = Аr (Na) · 2 + Аr (S) · 1 + Аr (О) · 4 + Мr (H2O) · 10 = 23 · 2 + 32 · 1 + 16 · 4 + 10 · 1 · 2 + 10 · 16 = 322 Мr (Na2SO4) = 142 w (Na2SO4) = 142 : 322 = 0,44 2. Вычислим массу раствора сульфата натрия: m = V· ρ = 50 · 1, 07 = 53,5 г 3. Составим схему к задаче: 0,08 0, 44 0,08 · 3 53,5г х г 53,5 г + х г + = раствор Na2SO4 · 10 H2O полученный раствор Na2SO4 Используя данную схему, составим и решим уравнение: 53,5 · 0,08 + х · 0,44 = (53,5 + х) · 0,24 4,28 + 0,44 х = 12,84 + 0,24 х 0,2 х = 8,56 х = 42,8 г Ответ: масса Na2SO4 · 10 H2O составит 42,8 г Реши самостоятельно: 1. Сколько граммов кристаллогидрата Na2SO4 · 10 H2O необходимо добавить к 100 мл 8% раствора сульфата натрия (плотность 1,07 г/ мл), чтобы удвоить массовую долю вещества в растворе? 2. Кристаллогидрат сульфата меди (кристаллизуется с 5 молекулами воды) массой 5г растворили в воде количеством 5 моль. Рассчитайте массовую долю соли в полученном растворе. 3. Какую массу медного купороса CuSO4 · 5H2O необходимо взять для приготовления 40 кг 2 % раствора сульфата меди? 4. Из 500 г 40% раствора сульфата железа (II) при охлаждении выпало 100 г его кристаллогидрата (кристаллизуется с 7 молекулами воды). Какова массовая доля вещества в оставшемся растворе? 5. Вычислите массу MgSO4 · 7H2O и воды необходимых для приготовления 120 мл раствора сульфата магния (плотность 1,0623 г /мл) с массовой долей соли 6,2%. 2.12. Концентрирование растворов. Задача № 1. Какую массу сухой соли нужно добавить к 15г 5% раствора хлорида натрия, чтобы получить 8% раствор соли. Решение: При решении подобных задач необходимо учесть, что к раствору добавляется чистое вещество, а значит, его массовая доля составляет 100% или 1. Используя данные условия, составим схему: 0,05 1 0,08 15г х г 15г + х г + = исходный NaCl полученный раствор раствор По схеме составим уравнение: 15 · 0,05 + х · 1 = (15 + х) · 0,08 0,75 + х = 1,2 + 0,08 х 0,08 х = 1,2 – 0,75 0,08 х = 0,45 х = 0,45 : 0,08 х = 5,62 г Ответ: масса сухой соли составляет 5,62 г Реши самостоятельно: 1. К раствору хлорида бария массой 120 г с массовой долей соли 2% добавили 1,6 г этой же соли. Вычислите массовую долю соли в полученном растворе. 2. Через 1 л раствора аммиака с массовой долей, равной 10% (плотность 0,96 г/мл), пропустили 10 л аммиака (н.у.). Вычислите массовую долю аммиака в образовавшемся растворе. 3. К 15 мл 48 % раствора азотной кислоты (плотность 1,3 г/мл), добавили 5 мл концентрированной кислоты (плотность 1,5 г/мл). Определите массовую долю кислоты в полученном растворе. 4. Вычислите массу хлорида натрия, которую необходимо добавить к 15 г 3% раствора для увеличения массовой доли соли в 2 раза. |