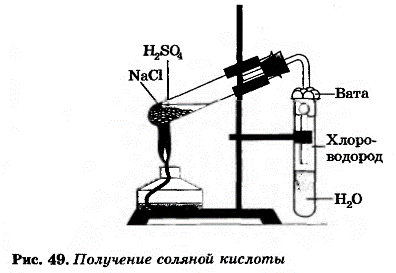
прак раб 3 пол сол кисл и ее св-ва. Практическая работа 3 Получение соляной кислоты и изучение её свойств
 Скачать 118.55 Kb. Скачать 118.55 Kb.
|
|
Тема: Практическая работа №3 «Получение соляной кислоты и изучение её свойств». Цель: закрепить знания о свойствах соляной кислоты; формировать навыки практической работы с реактивами, совершенствовать умения обращаться с кислотами; научить способам распознания соляной кислоты и ее солей; составлять уравнения реакций; наблюдать и делать выводы; Планируемые результаты: Предметные: уметь применять теоретические знания на практике, объяснять результаты проводимых опытов. Метапредметные: Регулятивные: осуществляют пошаговый контроль по результату; Познавательные: строят речевое высказывание в устной и письменной форме; Коммуникативные: учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве. Личностные: развивать умения оценивать ситуацию и оперативно принимать решение, находить адекватные способы взаимодействия с одноклассниками во время проведения практической работы. Оборудование и реактивы: штатив с пробирками, раствор соляной кислоты, лакмус, гранула цинка, медная проволока, сульфат меди (II), гидроксид натрия, карбонат натрия, нитрат серебра. Периодическая система химических элементов Д.И. Менделеева, таблица растворимости, инструкционная карта практической работы (приложение 1), раздаточный материал инструкция по ТБ «Техника безопасности при работе с кислотами». Ход урока 1. Организационный этап. Приветствие. Определение готовности обучающихся к уроку. Позитивный настрой на урок. На каждом столе набор химических реактивов и оборудования: штатив с пробирками, раствор соляной кислоты, лакмус, гранула цинка, медная проволока, оксид меди (II), сульфат меди (II), гидроксид натрия, карбонат натрия, нитрат серебра. Обучающиеся оформляют практическую работу в тетрадях для практических работ. 2. Мотивация учебной деятельности. Зайдя в класс, вы увидели, что сегодня он превратился в большую химическую лабораторию. Представьте, что вам, как ее научным сотрудникам, поручили провести ответственную исследовательскую работу. Надеюсь, что вы покажите себя серьезными и ответственными работниками. Девиз урока: “Химик требуется не такой, который лишь из одного чтения книг понял сию науку, но который собственным искусством в ней прилежно упражнялся…” М.В. Ломоносов. 3. Постановка цели и задач урока. Совместное планирование учебной деятельности. Напомните, пожалуйста, какое химическое соединение мы изучали на прошлом уроке? Правильно, соляную кислоту, ее свойства, способы получения. Поэтому тема сегодняшнего урока: «Практическая работа по теме «Изучение свойств соляной кислоты». Определяем цели урока, записываем их в тетрадь. Зная цели, составляем вместе план урока. 4. Актуализация опорных знаний. Перед тем, как начать практическую работу проведем небольшую химическую разминку. Вспомним, какие физические и химические свойства соляной кислоты. Проверим домашнее задание. На производстве перед проведением испытаний, исследований обязательно проводят с сотрудниками инструктаж по охране труда. Сегодня мы тоже, как научные сотрудники химической исследовательской лаборатории проведем инструктаж по ТБ перед проведением практической работы, используя инструкцию. Обучающиеся повторяют правила безопасной работы с кислотами и щелочами, нагревательными приборами. В тетрадях учащиеся делают запись «С правилами ТБ при работе с кислотами и щелочами, нагревательными приборами ознакомлен(а)». Самостоятельное выполнение практической части работы и текущее инструктирование учителя. Составление отчета. Дорогие друзья! На каждом столе есть инструкционная карта с четкой инструкцией по выполнению практической работы. Напоминаю требования к оформлению результатов проведенных исследований в тетрадях: следует кратко записать, что делали, что наблюдали, записать соответствующие уравнения реакций в молекулярном и ионных видах, сделать вывод. В ходе практической работы буду осуществлять контроль за вашей деятельностью, за соблюдением техники безопасности. По завершению практической работы представьте результаты своих научных исследований на проверку. Ход работы: Задание 1. Получение соляной кислоты В пробирку насыпать немного поваренной соли и прилить концентрированную серную кислоту так, чтобы кислота смочила соль. Закрыть пробирку газоотводной трубкой. Укрепить пробирку в лапке штатива (смотри рисунок). Конец газоотводной трубки опустить в пробирку с водой так чтобы он был на расстоянии 0,5 – 1 см от поверхности воды. Затем смесь соли и кислоты осторожно нагреть. Внимание! Следите за тем, чтобы газоотводная трубка не касалась воды! Иначе воду перебросит в горячую пробирку-реактор и стекло лопнет Наблюдайте за происходящим в пробирке с водой. 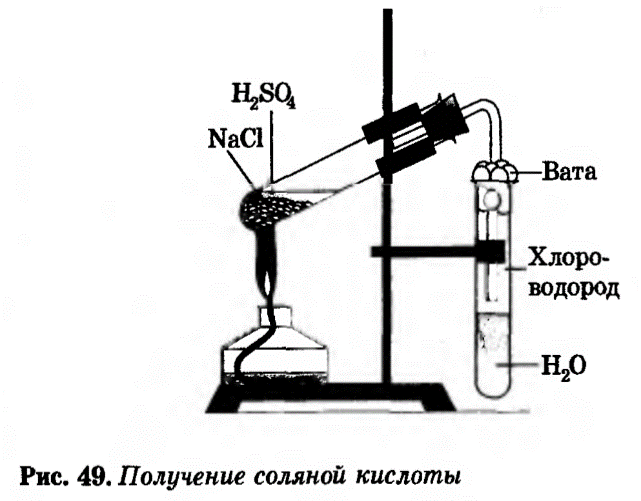 Выделение газа ( бесцветная, «дымящая» на воздухе) NaCl(тв) +H2SO4(конц) →HCl↑ +NaHSO4(при комнатной температуре). 2NaCl(тв) +2H2SO4(конц) →2HCl↑ +Na2S2O7 +Н2О (при нагревании). Будучи нелетучий сильной кислотой H2SO4(конц) способная вытеснять другие кислоты из них солей. Вопросы. 1). Чем вызвано появление во второй пробирке тонких опускающихся вниз струек? Ответ: появление струек вызвано растворением хлороводорода в воде, при этом образуется соляная кислота, плотность которой больше плотности воды. 2. Почему конец газоотводной трубки должен находиться на расстоянии 0,5—1,0 см от поверхности воды? Ответ: хлороводород очень хорошо растворим в воде. Если конец газоотводной трубки отпустить низко к поверхности воды, то может произойти всасывание раствора в трубку Задание 2. В пробирку налейте 1 мл соляной кислоты и добавьте 1-2 капли лакмуса. Какие изменения с раствором происходят? Запишите свои наблюдения. Появление розово-красной окраски раствора. Задание 3. В две пробирке налейте по 1 мл соляной кислоты. В первую пробирку добавьте гранулу цинка, а во вторую – медную проволоку. Что наблюдаете? Со всеми ли металлами реагирует соляная кислота? Составьте уравнения реакций в молекулярном и ионном видах, протекающих между соляной кислотой и указанными металлами. Соляная кислота реагирует с цинком, в результате этого взаимодействия выделяется газ – водород. С медью соляная кислота не реагирует, т.к. медь является неактивным металлом. Zn +2HCl = ZnCl2 + H2↑ Zn + 2H+ + 2Cl - = Zn2+ + 2Cl - + H2↑ Zn + 2H+ = Zn2+ + H2↑ Задание 4. К свежеприготовленному гидроксиду меди (II) добавьте раствор соляной кислоты. Что наблюдаете? Как объяснить образование в пробирке раствора синего цвета? Составьте уравнения реакций в молекулярном и ионном видах. Приготовление гидроксида меди (II): к раствору гидроксида натрия добавляют немного раствора сульфата меди (II). CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu2+ + SO42- + 2Na+ + 2OH - = 2Na+ + SO42- + Cu(OH)2↓ Cu2++ 2OH- = Cu(OH)2↓ Образуется синий желеобразный осадок. При взаимодействии соляной кислоты со свежеприготовленным раствором гидроксида меди (II) происходит растворение осадка и образование раствора хлорида меди (II) синего цвета. Cu(OH)2↓ + 2HCl = 2H2O + CuCl2 Cu(OH)2↓ + 2H+ + 2Cl - = 2H2O + Cu2+ + 2Cl – Cu(OH)2↓ + 2H+= 2H2O + Cu2+ Задание 5. В пробирку налейте 1 мл раствора соляной кислоты и добавьте раствор карбоната натрия. Что наблюдаете? Как объяснить выделение газа при данном взаимодействии? Составьте уравнения реакций в молекулярном и ионном видах. При взаимодействии соляной кислоты с раствором карбоната натрия происходит выделение углекислого газа. Na2CO3 + 2HCl = H2O + CO2↑ + 2NaCl 2Na+ + CO32- + 2H+ + 2Cl - = H2O + CO2↑ + 2Na+ + 2Cl – 2H+ + CO32- = H2O + CO2↑ Задание 6. В пробирку налейте 1 мл раствора соляной кислоты и добавьте несколько капель раствора нитрата серебра. Что наблюдаете? Аналогично в пробирку с раствором хлорида натрия добавить несколько капель раствора нитрата серебра. Напишите уравнения в молекулярном и ионном видах. Ответьте на вопрос, что является реактивом на соляную кислоту. Реактивом на соляную кислоту и ее соли является раствор нитрата серебра, в результате реакции образуется белый творожистый осадок хлорида серебра. HCl + AgNO3 = AgCl↓ + HNO3 H+ + Cl - + Ag+ + NO3- = AgCl↓ + H+ + NO3- Ag+ + Cl - = AgCl↓ Во время проведения практической работы учитель наблюдает за действиями учащихся, помогает в случае необходимости. Результаты опытов обговариваются. Учащиеся в тетрадях записывают вывод. После окончания практической работы учащиеся должны привести рабочее место в порядок. Домашнее задание и инструктаж по его выполнению. Повторить §35. Подготовить сообщение (на выбор): 1) о применении соляной кислоты; 2) из истории открытия соляной кислоты. Подведение итогов урока. Проведение рефлексии. Уважаемые сотрудники исследовательской лаборатории! Вы сегодня на славу потрудились. Работали дружно, слаженно. Результаты проведенных вами исследований вы сдали на проверку. Ответьте, пожалуйста на вопросы: Что открыли, узнали на уроке? Почему было трудно? Оправдались ли ваши ожидания от урока? Над чем заставил задуматься урок? Приложение 1 Практическая работа № 3.«Получение соляной кислоты и изучение её свойств»Цель: Исследовать химические свойства соляной кислоты. Оборудование и реактивы: пробирки, соляная кислота, лакмус, Mg, Сu, Cu(OH)2, NaOH, CuSO4, H2SO4(конц), Nа2CO3, NаCl, AgNO3. С правилами ТБ ознакомлен (а) (подпись). Ход работы. Опыт №1. Получение соляной кислоты В пробирку насыпать немного поваренной соли и прилить концентрированную серную кислоту так, чтобы кислота смочила соль. Закрыть пробирку газоотводной трубкой. Укрепить пробирку в лапке штатива (смотри рисунок). Конец газоотводной трубки опустить в пробирку с водой так чтобы он был на расстоянии 0,5 – 1 см от поверхности воды. Затем смесь соли и кислоты осторожно нагреть. Внимание! Следите за тем, чтобы газоотводная трубка не касалась воды!  Иначе воду перебросит в горячую пробирку-реактор и стекло лопнет Иначе воду перебросит в горячую пробирку-реактор и стекло лопнетНаблюдайте за происходящим в пробирке с водой. Опыт № 2. Действие индикатора на соляную кислоту HCl. В пробирку с соляной кислотой добавьте 1-2 капли лакмуса. Что наблюдаете? Сделайте вывод. Опыт № 3. Взаимодействие соляной кислоты HCl с металлами. В пробирку с соляной кислотой положите гранулу цинка, а в другую — кусочек медной проволоки. Что наблюдаете? Со всеми ли металлами реагирует соляная кислота? Сделайте вывод. Составьте уравнение реакции. Опыт № 4. Взаимодействие соляной кислоты HCl с основаниями. К свежеприготовленному раствору гидроксида меди прилейте соляную кислоту. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции в молекулярном, полном и сокращенном ионном виде. Справка. Для получения гидроксида меди Cu(OH)2 к раствору CuSO4 прилить щелочь NaOH, при этом образуется осадок голубого цвета Cu(OH)2: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 Опыт № 5. Взаимодействие соляной кислоты HCl с солями. В пробирку с карбонатом натрия прилейте соляную кислоту. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции в молекулярном, полном и сокращенном ионном виде. Опыт № 6. Распознавание соляной кислотыHCl и ее солей. (Качественная реакция на хлорид-ионы) В одну пробирку с соляной кислотой, в другую пробирку с раствором хлорида натрия добавьте по нескольку капель раствора нитрата серебра. Что наблюдаете? Сделайте вывод. Напишите уравнения проведенных реакций в молекулярном виде. Укажите, как можно отличить: а) соляную кислоту от других кислот, б) хлориды от других солей Почему вместо раствора нитрата серебра(I) можно также использовать раствор нитрата свинца(II)? Сделайте общий вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3 ПОЛУЧЕНИЕ СОЛЯНОЙ КИСЛОТЫ И ИЗУЧЕНИЕ ЕЕ СВОЙСТВ Цель работы: Получить соляную кислоту. Изучить ее свойства, научиться отличать соляную кислоту и ее соли от других кислот и солей. Оборудование: лабораторный штатив с лапкой, спиртовка, спички, пробирки, газоотводная трубка, вата. Реактивы: NaCl (крист.), H2SO4 (конц.), AgNO3 (р-р), Mg, NaCl (р-р), CaCl2 (р-р), CuO (тв.), CuSO4(р-р), NaOH (р-р), СaCO3(тв.), вода, лакмус. Ход работы: I. Инструктаж по технике безопасности перед началом работы II. Выполнение работы 1. Получение соляной кислоты В пробирку насыпать немного поваренной соли и прилить концентрированную серную кислоту так, чтобы кислота смочила соль. Закрыть пробирку газоотводной трубкой. Укрепить пробирку в лапке штатива (смотри рисунок). Конец газоотводной трубки опустить в пробирку с водой так чтобы он был на расстоянии 0,5 – 1 см от поверхности воды. Затем смесь соли и кислоты осторожно нагреть.  Внимание! Следите за тем, чтобы газоотводная трубка не касалась воды! Иначе воду перебросит в горячую пробирку-реактор и стекло лопнет Наблюдайте за происходящим в пробирке с водой 2. Исследование свойств соляной кислоты 1). Отношение кислоты к индикатору В пробирку с раствором соляной кислоты HCl добавить лакмус 2). Взаимодействие с металлами В пробирку с раствором соляной кислоты HCl добавить Mg Уравнение реакции: Mg + HCl = 3). Взаимодействие с оксидами металлов В пробирку с раствором соляной кислоты добавить горошину оксида меди CuO Пробирку немного нагреть (не кипятить!). Уравнение реакции: CuO + HCl = 4). Взаимодействие с основаниями В пробирку со свежеосаденным гидроксидом меди (II) Cu(OH)2 1 – 2 мл раствора соляной кислоты (до растворения осадка) Уравнение реакции: Cu(OH)2 + HCl = 5). Взаимодействие с солями В пробирку с CaCO3 добавить раствор соляной кислоты HCl Уравнение реакции: CaCO3 + HCl = 3. Распознавание соляной кислоты и ее солей (качественная реакция на хлориды) В пробирки с р-ром соляной кислоты и хлорида натрия добавить несколько капель раствора нитрата серебра AgNO3 (качественная реакция на ион хлора Cl-) Уравнения реакций: HCl + AgNO3 = NaCl + AgNO3 = Выполните отчет по работе (Результаты исследования занести в таблицу)
III. Вывод | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||