АМИНОКИСЛОТЫ. Индивидуальный проект аминокислоты. Получение, применение и биологические функции
 Скачать 137.93 Kb. Скачать 137.93 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖНОЙ ПОЛИТИКИ РЕСПУБЛИКИ КОМИ ГОСУДАРСТВЕННОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «Сыктывкарский медицинский колледж им. И.П. Морозова» ИНДИВИДУАЛЬНЫЙ ПРОЕКТ АМИНОКИСЛОТЫ. ПОЛУЧЕНИЕ, ПРИМЕНЕНИЕ И БИОЛОГИЧЕСКИЕ ФУНКЦИИ. Исполнитель: Мясникова Софья Анатольевна Группа: 510д Специальность: 33.02.01 «Фармация» Форма обучения: очная Руководитель: Мастыкина Евгения Викторовна, преподаватель ГПОУ «СМК» Сыктывкар, 2021 СОДЕРЖАНИЕ ОглавлениеВВЕДЕНИЕ 2 ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 3 1.1ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ 3 1.2СВОЙСТВА АМИНОКИСЛОТ 4 1.3КЛАССИФИКАЦИЯ АМИНОКИСЛОТ 4 1.4ПРИМЕНЕИЕ АМИНОКИСЛОТ 5 1.5БИОЛОГИЧЕСКИЕ ФУНКЦИИ АМИНОКИСЛОТ 5 1.6НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА АМИНОКИСЛОТ 6 ГЛАВА 2. ПРАКТИЧЕСКАЯ ЧАСТЬ 6 2.1 ПОЛУЧЕНИЕ АМИНОКИСЛОТ ПУТЕМ ГИДРОЛИЗА ЯИЧНОГО БЕЛКА 7 2.2 БИУРЕТОВАЯ РЕАКЦИЯ 7 ЗАКЛЮЧЕНИЕ 8 СПИСОК ЛИТЕРАТУРЫ 9 ВВЕДЕНИЕАминокислоты — это производные углеводородов, в молекулах которых содержатся карбоксильные и амино группы. [2] В нашем мире известно около 200 природных аминокислот, но только 20 из них играют важнейшую роль в жизни человека. Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты, а животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей. К заменимым относятся аминокислоты, присутствие которых в пище не обязательно для нормального развития организма. В случае их недостаточности они могут синтезироваться из других аминокислот или из небелковых компонентов. Актуальность: аминокислоты – это очень важные составляющие в жизни человека, ведь при их недостатке развиваются различные болезни и нарушаются функции органов. Проблема: на сегодняшний день никто не знает и не изучает аминокислоты? Объект исследования: органические вещества Предмет исследования: аминокислоты Цель исследования: изучить способы получения и применения аминокислот и их биологические функции Задачи: изучить материал по данной теме ПРИ ВАПНР Сделать выводы о проделанной работе ГЛАВА 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТАминокислоты получают в результате гидролиза белков. В лаборатории получение возможно в результате замещения атома галогена на аминогруппу в галоген замещённых карбоновых кислотах. [4] Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах. Один из наиболее распространенных методов синтеза аминокислот заключается в аммонолизе галогензамещенной кислоты, которую обычно получают по реакции Зелинского. [2] Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот). [2] Гидролизом белков можно получить около 25 аминокислот, но полученную смесь трудно разделить. Обычно одна или две кислоты получаются в значительно больших количествах, чем остальные, и эти кислоты удается выделить довольно легко – с помощью ионообменных смол. СВОЙСТВА АМИНОКИСЛОТ 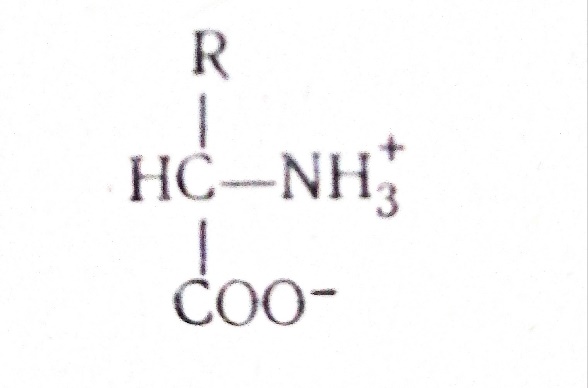 Все аминокислоты являются амфотерными электролитами и растворе находятся в ионизированном состоянии за счет диссоциации карбоксильных и аминных групп. Все аминокислоты являются амфотерными электролитами и растворе находятся в ионизированном состоянии за счет диссоциации карбоксильных и аминных групп.Аминокислоты являются электрически нейтральными. Однако в кислой среде они становятся катионами, а в щелочной среде – анионами.[1] КЛАССИФИКАЦИЯ АМИНОКИСЛОТ Моноаминомонокарбоновые аминокислоты, имеющие в своем составе одну аминную и одну карбоксильную группу; в водном растворе они нейтральны. Моноаминодикарбоновые аминокислоты, имеющие в своем составе одну аминную группу и две карбоксильные; их водный раствор имеет кислую реакцию. Диаминомонокарбоновые аминокислоты, в которых на одну карбоксильную группу приходятся две аминные; их реакция в растворе щелочная. [1] ПРИМЕНЕИЕ АМИНОКИСЛОТ Аминокислоты применяют в качестве парентерального питания (в обход ЖКТ). Например, гидролизин и аминопептид (из крови крупного рогатого скота), липофундин (жировая эмульсия соевого масла), полиамин (раствор 13 аминокислот). Эти препараты компенсируют белковое голодание организма и обеспечивают азотистое равновесие у больных после операции на ЖКТ и других тяжелых травмах.[3] Некоторые аминокислоты применяют в качестве лекарственных препаратов: метионин – применяют при жировой дегенерации печени. Гамма – аминомасляная кислота – в психиатрии для снятия эмоционального возбуждения. [3] Глицин - нормализует и активирует процессы защитного торможения в центральной нервной системе, уменьшает психоэмоциональное напряжение, повышает умственную работоспособность. Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки. В организме гистидин превращается в медиатор. Аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост. [2] c196 Синтез волокон. Например, для синтеза капрона и энанта. БИОЛОГИЧЕСКИЕ ФУНКЦИИ АМИНОКИСЛОТ Структурные элементы белков; В состав белков входят 20 протеиногенных аминокислот, последовательность которых кодируется генетическим кодом и которые постоянно обнаруживаются в белках. Структурные элементы других природных соединений; Аминокислоты и их производные входят в состав различных азотистых соединений, коферментов, антибиотиков, пептидов и т.д. Медиаторы; Термином медиатор обозначают вещества, передающие нервное возбуждение через синаптическую щель от одной клетки периферической нервной системы к соседней.[5] НАСЛЕДСТВЕННЫЕ ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ ОБМЕНА АМИНОКИСЛОТ Фенилкетонурия – молекулярная болезнь, связанная с дефектом фермента фенилаланингидроксилазы, превращающей фенилаланин в тирозин. Следствие – накопление в крови и моче фенилаланина и продуктов его превращений, которые токсичны для мозга. В результате у детей развивается тяжелое отставание умственного развития.[3] Цистинурия – заболевание, связанное с нарушением процесса обратного всасывания в канальцах почек лизина, аргинина, орнитина и цистина. Симптомы: образование цистиновых камней в почечных канальцах, так как цистин слаборастворим.[3] Цистиноз – наследственная болезнь, связанная с полным блокированием реабсорбции в канальцах почек почти всех аминокислот. Следствие: нарушение функции почек.[3] ГЛАВА 2. ПРАКТИЧЕСКАЯ ЧАСТЬ ПОЛУЧЕНИЕ АМИНОКИСЛОТ ПУТЕМ ГИДРОЛИЗА ЯИЧНОГО БЕЛКА Гидролиз белка - распад белка на отдельные аминокислоты в водном растворе. Белок – это полимер, который под действием воды распадается на мономеры – аминокислоты.  БИУРЕТОВАЯ РЕАКЦИЯ Биуретовая реакция – это качественная реакция на обнаружение белков с фиолетовым окрашиванием при действии солей меди (II) (медного купороса) в щелочном растворе. Чтобы провести качественную реакцию, раствор белка куриных яиц и раствор гидроксида натрия (в равных количествах) нагревают с несколькими каплями раствора медного купороса (сульфата меди (II)). Фиолетовый цвет дают образовавшиеся комплексные соединения меди с белками. Такая реакция характерна для всех соединений с пептидной связью (CO-NH). ЗАКЛЮЧЕНИЕ. Аминокислоты являются амфотерными органическими соединениями, имеющими важное биологическое значение. Именно аминокислотные остатки в процессе синтеза образуют последовательность, которая является первичной структурой белковых молекул. В зависимости от того, как именно выстроятся аминокислотные фрагменты, синтезируется белок, специфичный для каждого живого организма. СПИСОК ЛИТЕРАТУРЫЕрмолаев, М.В. Биологическая химия / М.В. Ермолаев. – М: Медицина, 1974. – С. 26 Органесян, Э.Т. Органическая химия: учеб. Пособие для медико-фармацевтических колледжей / Э.Т. Органесян. – Ростов н/Д: Феникс, 2016. – С. 281 Пустовалова, Л.М. Основы биохимии для медицинских колледжей / Л.М. Пустовалова. – Изд. 4-е. – Ростов н/Д : Феникс, 2010. – С. 261-263 Сечко, О.И. Химия в формате ЕГЭ. Органическая химия / О.И. Сечко. – Ростов н/Д: Феникс, 2016. – С. 50 Смирнов, В.А. Аминокислоты и полипептиды: учеб. пособ. Ч. 1. / В.А. Смирнов, Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2007. – С. 12-16 Цветков, Л.А. Органическая химия: Учеб. Для учащихся 10 -11 кл. общеобразоват. учеб. заведений. – М.: Гуманит. изд. центр ВЛАДОС, 2002. – С. 192-196 |
