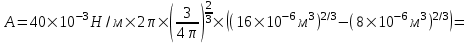|
|
Институт нефтепереработки и нефтехимии фгбоу во угнту в г. Салавате
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Уфимский государственный нефтяной технический университет» (ФГБОУ ВО УГНТУ)
Институт нефтепереработки и нефтехимии ФГБОУ ВО УГНТУ в г. Салавате
Кафедра «Информационных технологий»
Физика
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
Термодинамика
ИнТех- 21.05.06 – 1.02.10 РГР
Исполнитель:
студент гр. ГГз-22-21 В.А. Гомзов
Руководитель:
ассистент Г.Ф. Шаяхметов
Салават
2023
208. В баллоне объемом V = 3 л содержится кислород массой m = 10 г. Определить концентрацию nмолекул газа.
O2
V = 3л
m = 10г
M = 0,032кг/ моль
|
Число атомов в ν количестве молей равно N=NA×ν, где NA = 6.023×1023моль-1 – число Авогадро.
По определению 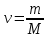 , где m – масса газа, M – молярная масса. , где m – масса газа, M – молярная масса.
Тогда концентрация равна
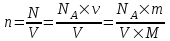 . .
Подставляем числа (переводя одновременно все величины в систему СИ). 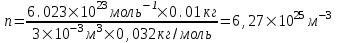 . .
|
n = ?
|
212. В баллоне находится газ при температуре Т1 = 400 К.До какой температуры T2надо нагреть газ, чтобы его давление увеличилось в 1,5 раза.
Т1 = 400 К
P2/P1 = 1.5
|
Так как баллон несжимаемый, то V1=V2 и процесс изохорный.
Воспользуемся уравнением Клапейрона – Менделеева 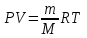 где P давление, m – масса газа, M – молярная масса газа, V – объем газа (баллона), T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная. где P давление, m – масса газа, M – молярная масса газа, V – объем газа (баллона), T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная.
Поэтому 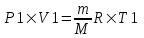 и и 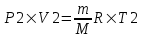 . Поделим первое на второе и получим . Поделим первое на второе и получим 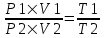 , так как V1=V2, то , так как V1=V2, то 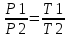 , откуда искомая температура равна , откуда искомая температура равна 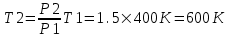 . .
|
T2 = ?
|
229. В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса каждой пылинки равна 6×10-10г. Газ находится при температуре T=400 К. Определить средние квадратичные скорости кв>, а также средние кинетические энергии <εкин> поступательного движения молекулы азота и пылинки.
m= 6×10-10г
M=0.028кг/моль
T=400 К
|
По определению среднеквадратичная скорость 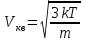 , ,
k=1.38×10-23Дж/К –постоянная Больцмана, m – масса молекулы (пылинки).
Поэтому скорость пылинки
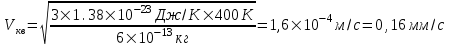 . .
С другой стороны среднеквадратичная скорость 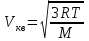 , R=8.31Дж/(моль×К) – молярная газовая постоянная, M – молярная масса газа. , R=8.31Дж/(моль×К) – молярная газовая постоянная, M – молярная масса газа.
Поэтому скорость молекул азота
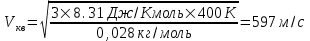 . .
Средняя кинетическая энергия поступательного движения одной молекулы равна 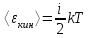 , где k=1.38×10-23Дж/К – постоянная Больцмана, i – поступательные степени свободы молекулы (i=3 в нашем случае т.к. три поступательных движения возможны). Поэтому , где k=1.38×10-23Дж/К – постоянная Больцмана, i – поступательные степени свободы молекулы (i=3 в нашем случае т.к. три поступательных движения возможны). Поэтому 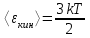 . .
Средняя энергия поступательного движения пылинки равна 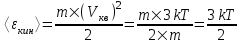 . Видно, что средние кинетические энергии пылинки и молекул азота равны друг другу. . Видно, что средние кинетические энергии пылинки и молекул азота равны друг другу.
Подставляем числа.
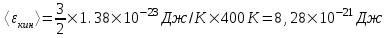 . .
|
Vкв = ?
<εкин> =?
|
232. Найти удельные ср и сv, а также молярные Ср и Сv теплоемкости углекислого газа.
CO2
μ = 44г/моль
|
Удельная теплоемкость при постоянном объеме 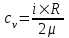 , где i – число степеней свободы, R=8.31Дж/мольК – молярная газовая постоянная. , где i – число степеней свободы, R=8.31Дж/мольК – молярная газовая постоянная.
Удельная теплоемкость при постоянном давлении 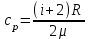 . .
В нашем случае число степеней свободы равно 6 (3-поступательные и 3 - вращательные, так как газ трехатомный). Поэтому
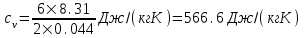 . . 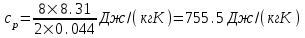 . .
Молярная теплоемкость при постоянном объеме
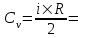 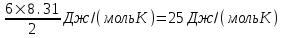 . .
Молярная теплоемкость при постоянном давлении
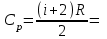 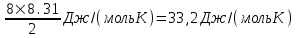 . .
|
Сp = ?
cр =?
Сv = ?
cv =?
|
250. В сферической колбе вместимостью V= 3л, содержащей азот, создан вакуум с давлением P = 80 мкПа. Температура газа T=250 К. Можно ли считать вакуум в колбе высоким?
T = 250 К
P = 80 мкПа
N2
d=3×10-10м
M=0,028кг/моль
|
Средняя длина свободного пробега молекул вычисляется по формуле 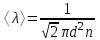 , где d – эффективный диаметр молекулы, n – число молекул в единице объема, которое можно найти из уравнения , где d – эффективный диаметр молекулы, n – число молекул в единице объема, которое можно найти из уравнения 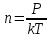 , где k – постоянная Больцмана. Поэтому , где k – постоянная Больцмана. Поэтому 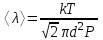 . Подставляем числа . Подставляем числа 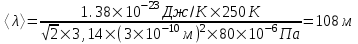 . .
Известно, что объем сферической колбы радиусом R равен 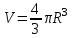 . Откуда . Откуда 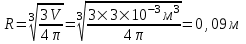 . Очевидно, что линейные размеры сосуда много меньше длины свободного пробега <λ>=108м. Поэтому вакуум будет высоким. . Очевидно, что линейные размеры сосуда много меньше длины свободного пробега <λ>=108м. Поэтому вакуум будет высоким.
|
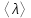 = ? = ?
|
252. При изотермическом расширении азота при температуре Т = 280 Кобъем его увеличился в два раза. Определить 1) совершенную при расширении газа работу А; 2) изменение ΔU внутренней энергии;3) количество теплоты Q, полученное газом. Масса азота m = 0,20 кг.
N2
m = 0,20 кг
n=V2/V1=2
T= const =280K
|
Применим первый закон термодинамики. Согласно которому, количество теплоты Q, переданное системе, расходуется на увеличение внутренней энергии ΔU и на внешнюю механическую работу A: Q=ΔU+A.
Величина ΔU = m×cv×ΔT = 0 при изотермическом процессе так как T=const и ΔT=0. Поэтому изменение внутренней энергии газа равно нулю.
Тогда Q=ΔU+A=A, откуда работа совершаемая газом A=Q.
С другой стороны работа равна 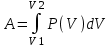 . Воспользуемся уравнением Клапейрона – Менделеева . Воспользуемся уравнением Клапейрона – Менделеева 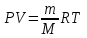 где P давление, m – масса азота, M – молярная масса кислорода (M = 0.028кг/моль), V – объем сосуда, T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная. Поэтому где P давление, m – масса азота, M – молярная масса кислорода (M = 0.028кг/моль), V – объем сосуда, T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная. Поэтому 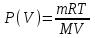 . Подставляем в интеграл и получаем . Подставляем в интеграл и получаем 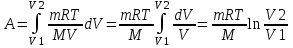 . Подставляем числа (переводя одновременно все величины в систему СИ). . Подставляем числа (переводя одновременно все величины в систему СИ).
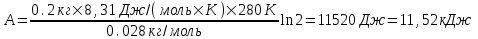 . .
|
A = ?
ΔU = ?
Q = ?
|
262. Идеальный газ совершает цикл Карно. Температура Т1 теплоотдатчика в четыре раза (n=4) больше температуры теплоприемника. Какую долю ω количества теплоты, полученного за один цикл от теплоотдатчика, газ отдаст теплоприемнику?
T1= n×T2
n=4
|
КПД тепловой машины равен отношению производимой работы A к количеству тепла Q1, полученному рабочим телом от нагревателя: 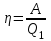 . .
Совершенная работа равна A=Q1–Q2. Откуда Q1=A+ Q2, где Q2 - количество теплоты, переданное холодильнику. Поэтому 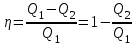 . .
Откуда искомое 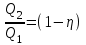 . .
С другой стороны КПД тепловой машины равен 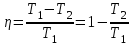 , где T1 – температура нагревателя, T2 – температура холодильника. Поэтому , где T1 – температура нагревателя, T2 – температура холодильника. Поэтому 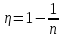 . Подставляем в . Подставляем в 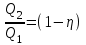 и получаем и получаем 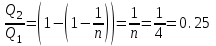 =25%. =25%.
|
|
272. Какую работу А надо совершить при выдувании мыльного пузыря, чтобы увеличить его объём от V1 = 8 см3 до V2 =16 см3? Считать процесс изотермическим.
V1=8см3
V2 =16 см3
α = 40×10-3 Н/м
|
Так как поверхность жидкости в пузыре принимает выгнутую сферическую форму, то внутреннее давление p в пузыре будет больше, чем внешнее, на величину избыточного давления под сферической поверхностью: 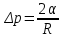 , где R – радиус кривизны пузыря, α – коэффициент поверхностного натяжения жидкости (α=0,04Н/м в нашем случае). Коэффициент поверхностного натяжения жидкости равен , где R – радиус кривизны пузыря, α – коэффициент поверхностного натяжения жидкости (α=0,04Н/м в нашем случае). Коэффициент поверхностного натяжения жидкости равен 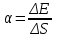 , где ΔE – изменение энергии при увеличении площади на ΔS. Работа как раз и равна A=ΔE. Поэтому , где ΔE – изменение энергии при увеличении площади на ΔS. Работа как раз и равна A=ΔE. Поэтому 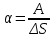 . Откуда работа равна A=α×ΔS=α×2×Δs, где Δs –изменение внешней площади пузыря. Множитель 2 обусловлен тем, что у пузыря две поверхности (внутренняя и внешняя). . Откуда работа равна A=α×ΔS=α×2×Δs, где Δs –изменение внешней площади пузыря. Множитель 2 обусловлен тем, что у пузыря две поверхности (внутренняя и внешняя).
Объем пузыря равен 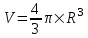 , а площадь S=π×R2. Поэтому , а площадь S=π×R2. Поэтому 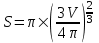 . .
Тогда 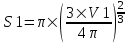 , а , а 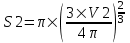 , и поэтому разность , и поэтому разность 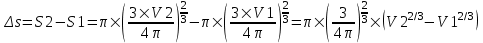 . .
Тогда работа равна 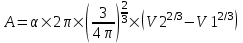 . .
Подставляем числа.
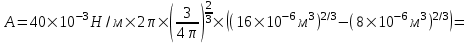
=2,27×10-5Дж=22,7мкДж.
|
A = ?
| |
|
|
 Скачать 82.51 Kb.
Скачать 82.51 Kb.
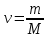 , где m – масса газа, M – молярная масса.
, где m – масса газа, M – молярная масса.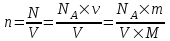 .
.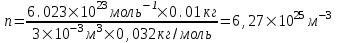 .
.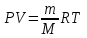 где P давление, m – масса газа, M – молярная масса газа, V – объем газа (баллона), T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная.
где P давление, m – масса газа, M – молярная масса газа, V – объем газа (баллона), T – температура газа, R = 8.31Дж/(моль×К) – молярная газовая постоянная. 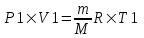 и
и 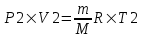 . Поделим первое на второе и получим
. Поделим первое на второе и получим 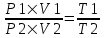 , так как V1=V2, то
, так как V1=V2, то 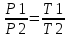 , откуда искомая температура равна
, откуда искомая температура равна 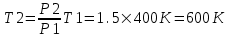 .
.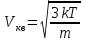 ,
, 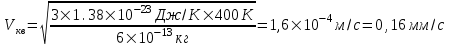 .
.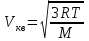 , R=8.31Дж/(моль×К) –
, R=8.31Дж/(моль×К) – 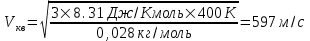 .
.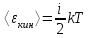 , где k=1.38×10-23Дж/К – постоянная Больцмана, i – поступательные степени свободы молекулы (i=3 в нашем случае т.к. три поступательных движения возможны). Поэтому
, где k=1.38×10-23Дж/К – постоянная Больцмана, i – поступательные степени свободы молекулы (i=3 в нашем случае т.к. три поступательных движения возможны). Поэтому 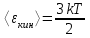 .
.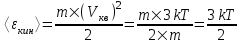 . Видно, что средние кинетические энергии пылинки и молекул азота равны друг другу.
. Видно, что средние кинетические энергии пылинки и молекул азота равны друг другу.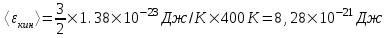 .
.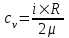 , где i –
, где i – 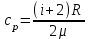 .
.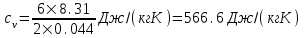 .
. 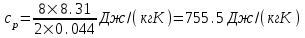 .
.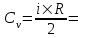
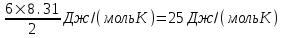 .
.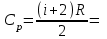
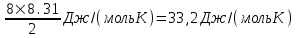 .
.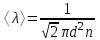 , где d – эффективный диаметр молекулы, n –
, где d – эффективный диаметр молекулы, n – 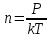 , где k – постоянная Больцмана. Поэтому
, где k – постоянная Больцмана. Поэтому 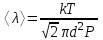 . Подставляем числа
. Подставляем числа 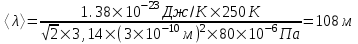 .
.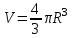 . Откуда
. Откуда 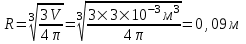 . Очевидно, что линейные размеры сосуда много меньше длины свободного пробега <λ>=108м. Поэтому вакуум будет высоким.
. Очевидно, что линейные размеры сосуда много меньше длины свободного пробега <λ>=108м. Поэтому вакуум будет высоким.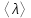 = ?
= ?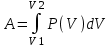 . Воспользуемся уравнением Клапейрона – Менделеева
. Воспользуемся уравнением Клапейрона – Менделеева 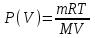 . Подставляем в интеграл и получаем
. Подставляем в интеграл и получаем 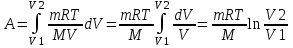 . Подставляем числа (переводя одновременно все величины в систему СИ).
. Подставляем числа (переводя одновременно все величины в систему СИ).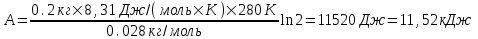 .
.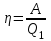 .
.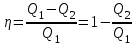 .
.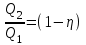 .
. 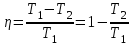 , где T1 – температура нагревателя, T2 – температура холодильника. Поэтому
, где T1 – температура нагревателя, T2 – температура холодильника. Поэтому 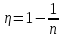 . Подставляем в
. Подставляем в 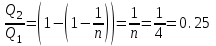 =25%.
=25%.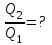
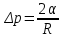 , где R –
, где R – 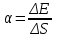 , где ΔE – изменение энергии при увеличении площади на ΔS. Работа как раз и равна A=ΔE. Поэтому
, где ΔE – изменение энергии при увеличении площади на ΔS. Работа как раз и равна A=ΔE. Поэтому 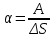 . Откуда работа равна A=α×ΔS=α×2×Δs, где Δs –изменение внешней площади пузыря. Множитель 2 обусловлен тем, что у пузыря две поверхности (внутренняя и внешняя).
. Откуда работа равна A=α×ΔS=α×2×Δs, где Δs –изменение внешней площади пузыря. Множитель 2 обусловлен тем, что у пузыря две поверхности (внутренняя и внешняя). 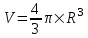 , а площадь S=π×R2. Поэтому
, а площадь S=π×R2. Поэтому 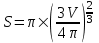 .
.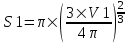 , а
, а 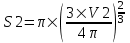 , и поэтому разность
, и поэтому разность 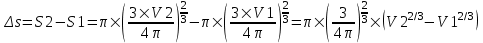 .
.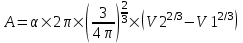 .
.