конспект. Аммиак и его свойства. Инструкция к уроку
 Скачать 85.67 Kb. Скачать 85.67 Kb.
|
|
Инструкция к уроку. Прочитайте параграф 17. Познакомьтесь с опорным конспектом. Посмотрите видеофайлы , ссылки в конспекте. Домашнее задание: Параграф 17, задачи 8 и9 на стр. 93. Аммиак и его свойства. Опорный конспект. В атмосфере содержится 78% азота, но усваиваться живыми организмами может только химически связанный азот. Техническое решение проблемы «связывания» азота с водородом во многом решило проблему урожайности полей. Понять эту взаимосвязь химии азота и проблем урожая можно, изучив одно из ценных соединений азота – аммиака (нитрид Н). а) Состав и строение молекулы аммиака 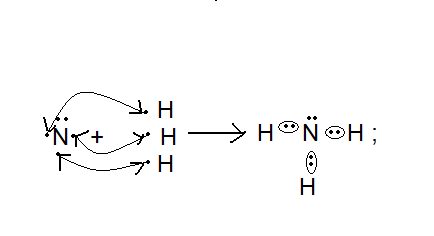 Молекула аммиака имеет пространственное строение, она представляет собой треугольную пирамиду (тетраэдр), валентный угол 1070, в результате чего молекула аммиака полярна.  1070 . . 1070 . .   N -δ N -δH+δ H+δ    б) Физические свойства аммиака. - это газ, бесцветный, имеет резкий специфический запах - (Mr (возд) = 29; Mr(NH3) = 17 )→ (Dвозд (NH3) = Mr(NH3):Mr(возд) = 17/29 < 1) → (NH3 легче воздуха) → (NH3 собирают методом вытеснения воздуха из пробирки, которая расположена вниз дном). - аммиак летуч →характерен молекулярный тип кристаллической решетки - хорошо растворяется в воде (вещество, имеющее полярные молекулы, хорошо растворяются в полярном растворителе) в 1V(H2O) - до 700V(NH3) при комнатной температуре t0 https://www.youtube.com/watch?time_continue=3&v=q6PGIhLs4jE&feature=emb_title Аммиак легко снижается, а при испарении жидкого аммиака происходит сильное охлаждение → его применяют в некоторых холодильных установках. Получают аммиак: https://www.youtube.com/watch?v=jl-3rJQ6LDU&t=11s в) Химические свойства: Для аммиака характерны две группы химических свойств. Первая группа характеризует восстановительные свойства NH3 – это реакции окисления. Вторая группа обусловлена способностью аммиака образовывать ион аммония NH4+. Окисление аммиака. Данная реакция в зависимости от условий идет в разных направлениях. В отсутствии катализатора образуется молекулярный азот и водяной пар. 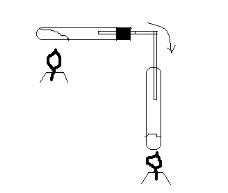 KMnO4 KMnO4  O2 O2 NH4OH Нагреть KMnO4 , после начала выделения О2 нагреть NH4OH, поджечь у отверстия пробирки → горение голубым пламенем. При участии: катализатора в зависимости от его состава и других условий (t0; состава исходной смеси, давления) часть аммиака окисляется до оксида N(II); В оптимальных условиях удается получить выход NO до 98%. Т.е. применяя тот или иной катализатор можно изменять направление реакции. Поэтому говорят, что катализаторы обладают избирательным действием. Катализаторы – вещества, увеличивающие скорость реакции или меняющие ее направление. Демонстрационный опыт.   Сr2O3 В качестве катализатора свежеприготовленный Cr2O3 (разложение бихромата аммония (NH4)2 Сr2O7). Нагреть Сr2O3 в ложечке для сжигания веществ, постукивая пальцем по ложечке, всыпать его в колбу – «огненный дождь». https://vk.com/video123467317_164199367 Химические реакции, связанные с образованием иона аммония. В аммиаке у атома азота имеется неподелённая электронная пара, которая может участвовать в образовании еще одной ковалентной полярной связи между атомами N и катионом водорода (Н+) по донорно-акцепторному механизму:     H+1 + . . ↓     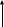 H+1 N-3 H+1 + H+1 → О-2 ← H+1 → H+1 → N-3 ← H+1 + ОН- H+1 N-3 H+1 + H+1 → О-2 ← H+1 → H+1 → N-3 ← H+1 + ОН-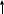 ↑  H+1  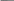 H+1 ион аммония щелочная среда раствора Происходит химическое взаимодействие при растворении NH3 в Н2О – протон от воды перемещается к аммиаку вследствие «перетягивания» его азотом, у которого большая, чем у кислорода, отрицательная с.о. Азот – донор ē пары (от латинского donare – дарить); H+ - акцептор ē пары (acceptor – приемщик).  .. ..  NH3 + Н2+ О NH3·H2O гидроксид аммония, нашатырный спирт. NH3 + Н2+ О NH3·H2O гидроксид аммония, нашатырный спирт.Все четыре ковалентные полярные связи в ионе аммония, независимо от способов их образования, равноценны. Поэтому пространственное строение иона аммония – тетраэдр с атомом азота в центре. Ион аммония – сложный катион, который участвует в реакциях обмена, переходит в новые вещества без изменения. Демонстрационный опыт: Раствор аммиака исследовать с помощью индикаторов: лакмус – синий; фенолфталеин – малиновый; метилоранж – желтый. Вывод: раствор аммиака в воде имеет щелочную среду. NH3·Н2О– слабое основание (α = 1,4), пахнет аммиаком. Поэтому можно предположить, что реакция обратимая, что можно доказать на опыте. Демонстрационный опыт: В пробирке нагреть аммиачную воду, к которой предварительно добавить фенолфталеин. Наблюдается исчезновение малиновой окраски, т.к. аммиак улетучивается, а в пробирке остается вода. При нагревании равновесие смещается влево, т.к. с повышением t0 растворимость газов понижается.   NH3 + Н2О NH3·H2O NH3 + Н2О NH3·H2O  t0 t0Этот процесс идет без нагревания медленно, поэтому аммиачная вода пахнет аммиаком. |
