Типовая задача№1. К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе?
Дано: Решение:
m 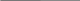 (p. HCl) = 150 г 1) m (HCl) = 150 г ∙ 0,2 = 30 г (p. HCl) = 150 г 1) m (HCl) = 150 г ∙ 0,2 = 30 г
(HCl) = 0,2 (20 %)2) m (p-ра) = 150 г + 200 г = 350 г
V(Н2О) = 200 мл m (H2O) = 200 мл ∙ 1 г/мл = 200 г
(HCl) = ? (HCl) =30 г/350 г= 0,086 (8,6 %)
Ответ:(HCl) = 0,086 (8,6 %).
Типовая задача№2. К 120 г 1 %-ного раствора сахара прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном растворе?
Д ано: Решение: ано: Решение:
m (p. сахара) = 120 г 1)m(сахара) = 120 г ∙ 0,01 = 1,2 г
= 0,01 (1 %) 2) m(всего сахара) = 1,2 + 4 г = 5,2 г
m(сахара) = 4 г 3) m (р-ра) = 120 г + 4 г = 124 г
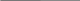 (сахара) =? (cахара)= 5,2 г/124 г = 0,042 (4,2 %) (сахара) =? (cахара)= 5,2 г/124 г = 0,042 (4,2 %)
Ответ: 0,042 (4,2 %).

Задачи для самостоятельной работы
К 200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе? 200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе?
К 90 г 6 %-ного раствора поваренной соли прилили 200 мл воды. Каково процентное содержание поваренной соли во вновь полученном растворе?
К 140 г 15 %-ного раствора сахара долили 160 мл воды. Каково процентное содержание сахара во вновь полученном растворе?
К 200 г 40 %-ного раствора уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной кислоты во вновь полученном растворе?
К 80 г 30 %-ного раствора щелочи долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном растворе?
К раствору хлорида кальция массой 90 г с массовой долей 5% добавили 10 г этой же соли. Каково процентное содержание соли во вновь полученном растворе?
К раствору нитрата кальция массой 80 г с массовой долей 4% добавили 1,8 г этой же соли. Каково процентное содержание соли в полученном растворе равна (с точностью до десятых)___
К 300 г раствора нитрата калия с массовой долей 20% добавили 100 г той же соли. Какова массовая доля нитрата калия в полученном растворе?
Массовая доля азотной кислоты в растворе, полученном после добавления 20 г воды к 160 г её 5%-ного раствора, равна___
К раствору хлорида кальция массой 140 г с массовой долей 5% добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна (с точностью до десятых___
К 150 г раствора с массовой долей K2SO4 10% добавили 100г воды. Вычислите массовую долю сульфата калия в полученном растворе.

V ТИП. ЗАДАЧИ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ – РАСТВОРИМОСТЬ
Типовая задача№1. Какую массу сульфата натрия можно получить при выпаривании 50г насыщенного раствора при t 35 0С, если его растворимость 50 (на 100 г воды)?
Д ано: Решение: ано: Решение:
m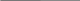 (p. Na2SO4) = 50 г В 150 г р-ра – 50 г Na2SO4 (p. Na2SO4) = 50 г В 150 г р-ра – 50 г Na2SO4
Р(Na2SO4) = 50 г в 50 г - х
m (Na2SO4) = ? х =50 г∙50 г/150 г = 16,7 г
Ответ: 16,7 г Na2SO4
Типовая задача№1. Сколько грамм воды необходимо для растворения 30 г нитрата свинца, чтобы получился насыщенный раствор при t 60 0С (растворимость его 105)?
 Дано: Решение: Дано: Решение:
m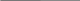 [Pb(NO3)2] = 30 г 105 г Pb(NO3)2- 100 г H2O [Pb(NO3)2] = 30 г 105 г Pb(NO3)2- 100 г H2O
Р(60ОС) = 105 г30 г - х
х =30 г ∙ 100 г / 105 г = 28,57 г
m (H2O) = ?
Ответ: 28,57 г H2O
Типовая задача№3. В 300 г насыщенного при t 55 0С сульфата магния содержится 100 г сульфата магния. Определить его растворимость (коэффициент растворимости).
 Дано: Решение: Дано: Решение:
 m (p. MgSO4) = 300 г 1) m (H2O) = 300 г – 100 г = 200 г m (p. MgSO4) = 300 г 1) m (H2O) = 300 г – 100 г = 200 г
m (MgSO4) = 100 г 2) в 200 г H2O – 100 г MgSO4
Р(MgSO4)= ? в 100 г - х
х=50 г
Ответ: Р(MgSO4) = 50 г
Типовая задача№4. В 200 г раствора KСlO3при t 300С содержится 20 г KСlO3. Будет ли его раствор насыщенным, если его растворимость при t 30ОС – равна 10?
 Дано: Решение: Дано: Решение:
m (p. KClO3) = 200 г 1) m (H2O) = 200 г – 20 г = 180 г (p. KClO3) = 200 г 1) m (H2O) = 200 г – 20 г = 180 г
m (KClO3) = 20 г 2) В 100 г H2O – 10 г KClO3
m (KClO3) = 20 г в 180 г H2O – х
Будет ли раствор 3) х =180 х 10 г/100 г = 18 г
насыщенным? А в растворе 20 г KClO3, следовательно, раствор
насыщенный.
Типовая задача№5. В 100 г воды при t 600С растворяется 110 г нитрата калия, образуя насыщенный раствор. Какова массовая доля нитрата калия в таком растворе?
Д ано: Решение: ано: Решение:
m (H2O) = 100 г 1) m (р-ра) = 100 г + 110 г = 210 г (H2O) = 100 г 1) m (р-ра) = 100 г + 110 г = 210 г
m (KNO3) = 110 г2) = 110/210 г = 0,524 (52,4 %)
(KNO3) = ? Ответ: 0,524 (52,4 %)
Типовая задача №6. Какая масса хлорида бария выкристаллизуется при выпаривании из 300 г насыщенного при t 90 0С раствора, если его растворимость 55?
Д ано: Решение: ано: Решение:
m (p. BaCl2) = 300 г 1) В 155 г р-ра – 55 г BaCl2 (p. BaCl2) = 300 г 1) В 155 г р-ра – 55 г BaCl2
Р(BaCl2) = 55 г в 300 г – х
2) х =300 г ∙ 55 г/155 г= 106,45 г
m (BaCl2выкр.) ? Ответ: 106,45 г.

Задачи для самостоятельной работы

Имеется 300 г насыщенного при t 15ОС раствора нитрата калия. Сколько грамм нитрата калия здесь содержится, если его растворимость 25?
Растворимость некоторой соли при температуре 25 0С составляет 185г/л. Какую массу соли можно получить, если упарить 200 мл ее раствора, насыщенного при температуре 250?
В 100 г воды при 20 0С растворяется 74,5 г хлорида кальция, а при 800С – 147,0г. Каким будет при этих температурах 42,3%-ный раствор хлорида кальция (насыщенным, ненасыщенным, перенасыщенным)?
Воду объемом 100 мл насыщают нитратом калия KNO3 при 700С. Раствор охлаждают до 20 0С. Какая масса соли выпадет в осадок?
Растворимость бромида натрия при 20 0С равна 90,5 г. Какую массу этой соли следует растворить в воде массой 900 г при 200С для получения насыщенного раствора?
При выпаривании насыщенного при 200С водного раствора хлорида натрия массой 200 г получена соль, масса которой 52,64г. Какова растворимость в воде хлорида натрия при 200С?
В какой массе воды надо растворить KNO3 массой 120 г, чтобы получить раствор, насыщенный при 300С?
Растворимость хлорида натрия при 20 0С равна 36,0 г в 100г воды, а растворимость фторида натрия при этой же температуре – 4,3 в 100г воды. Определите массовые доли солей в насыщенном водном растворе при этой температуре (в %). Можно ли считать обе соли хорошо растворимыми? Концентрированными или разбавленными являются их насыщенные растворы?
  VI ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПРИ ДОБАВЛЕНИИ ЕГО В РАСТВОР ДЛЯ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ. VI ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МАССЫ ИЛИ ОБЪЕМА ВЕЩЕСТВА ПРИ ДОБАВЛЕНИИ ЕГО В РАСТВОР ДЛЯ ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ.
|
 Скачать 0.58 Mb.
Скачать 0.58 Mb.