задачи по химии. задачи на раствлры. Исхакова р. У. В помощь учителю при подготовке егэ
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
Типовая задача №1. Сколько миллилитров воды надо прилить к 80 г 5 %-ного раствора соли, чтобы получить 2 %-ный раствор?Д  ано: Решение: ано: Решение:m 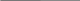 (p. соли) = 80 г 1) m (соли) = 80 г ∙0,005 = 4 г (p. соли) = 80 г 1) m (соли) = 80 г ∙0,005 = 4 г(с) = 0,05 (5 %)2) m(Н2О) = 80 г – 4 г = 76 г пол.(с) = 0,02 (2 %) 3) На 98 г Н2О – 2 г соли V(Н2О) = ? х г Н2О – 4 г соли х = 196 г Н2О 4)Долить надо 196 г – 76 г = 120 г V(Н2О) = 120 г /1 г/мл = 120 мл Ответ: 120 мл. Типовая задача №2. Сколько грамм соли надо добавить к 150 г 0,5 %-ного раствора этой соли, чтобы получить 6 %-ный раствор? Ответ: 8,78 г.; Д  ано: Решение: ано: Решение:m 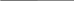 (p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г (p-ра соли) = 150 г 1) m (соли) = 150 г ∙0,005 = 0,75 г(с) = 0,005 (5 %) 2) m(Н2О) = 150 г – 0,75 г = 149,25 г (с) = 0,06 (6 %) 3) на 94 г Н2О – 6 г соли m(соли) = ? на 149,25 г – х г соли х = 9,53 г 4)m(соли добав.) = 9,53 г – 0,75 г = 8,78 г Ответ: 8,78 г. Типовая задача №2Сколько надо добавить воды к 450 г 23%-го раствора сахара, чтобы получить 18%-й раствор? Наглядно-логический метод: В этой задачи следует рассуждать так: поскольку масса взятого вещества (сахара в растворе) не изменится после приливания воды, мы можем найти массу полученного раствора: mp2 = mв1/ ɷ = 450 · 0,23/0,18= 103,5/0,18 = 575 г
mН2О = 575 – 450 = 125 г. Ответ: надо добавить 125 г воды. |
| Р1 | + | Р2 | = | Р3 |
| mp1 = 30 г | mp2 = 75 г | mp3 = 30+75=105 г | ||
| ɷ =0.24(24%) | ɷ = 0,12 (12%) | ɷ = 16, 2/105 = 0, 154 | ||
| mв1 = 30· 0, 24= 7,2г | mв2 = 75· 0, 12=9 г | mв3 = 7,2+9 = 16,2 г |
Ответ: массовая доля вещества в растворе составляет 15, 4%.


Задачи для самостоятельной работы
Смешали 50 г 5 %-ного раствора серной кислоты с 80 г 20 %-ного раствора серной кислоты. Каково процентное содержание серной кислоты во вновь полученном растворе?
Смешали 70 г 10 %-ного раствора азотной кислоты с 80 г 25 %-ного раствора азотной кислоты. Каково процентное содержание азотной кислоты во вновь полученном растворе?
Смешали 60 г 2 %-ного раствора поваренной соли с 80 г 4 %-ного раствора поваренной соли. Каково процентное содержание поваренной соли во вновь полученном растворе?
Смешали 20 г 0,5 %-ного раствора сахара с 20 г 1 %-ного раствора сахара. Какова массовая доля сахара во вновь полученном растворе?
Какова массовая доля нитрата калия в растворе, полученном после смешивания 90 г 2 %-ного раствора и 110 г 5 %-ного раствора нитрата калия.
Вычислите массовую долю хлорида алюминия в растворе, полученном при смешивании 25г 10%-ного и 750г 25%-ного растворов

Типовая задача №1. Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
Д
 ано: Решение:
ано: Решение:V
 (p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 моль
(p. H2SO4) = 25 млn (H2SO4) - ? В 1000 мл – 10 мольC(H2SO4) = 10 моль/л в 25 мл – х моль
V(H2O) = 225мл х = 0,25 моль
C(H2SO4) = ? 2) V(р-ра) = 225 мл + 25 мл = 250 мл
3) C(H2SO4) - ? В 250 мл – 0,25 моль
в 1000 мл – х моль
х = 1 моль/л
Ответ: С = 1 моль/л.
Типовая задача №2. Определить молярную концентрацию 73,8 %-ного раствора серной кислоты, плотность которого 1,655 г/мл.
 Дано: Решение:
Дано: Решение:
 (H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл
(H2SO4) = 0,738 (73,8%) 1)V(р) = 100 г /1,655 г/мл = 60,42 мл(p) = 1,655 г/мл 2)В 60,42 мл р. – 73,8 г H2SO4
С=? в 1000 мл – х
х = 1221,45 г
3)n = 1221,45 г /98 г/мл = 12,46 моль
С = 12,45 моль/л
Ответ: С = 12,45 моль/л
Типовая задача №3. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора?
Д
 ано: Решение:
ано: Решение:
 (HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)
(HCl) = 0,365 ( 36,5 %) 1)В 1000 мл р-ра – 0,1 моль HCl (3,65 г)(p-ра) = 1,18 г/мл2) В 100 г р-ра – 36,5 г HCl
V(р) = 1000 млх – 3,65 г
С(HCl) = 0,1 моль/лх = 10 г (р-ра)
V(36,5 % р-ра) = ? 3)V(р-ра) = 10 г /1,18 г/мл = 8,4745 мл
Ответ: V = 8,4745 мл
Типовая задача №4. Определить массовую долю азотной кислоты в 4,97 молярном ее растворе, плотность которого 1,16 г/мл. Ответ: 27 %.;
 Дано: Решение:
Дано: Решение:С
 (HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г
(HNO3) = 4,97 моль/л 1) m (р) = 1000 мл х 1,16 г/мл = 1160 г(p) = 1,16 г/мл 2) m (HNO3) = 4,97 моль х 63 г/моль = 313,11 г
(HNO3) = ?= 313,11 г/1160 г = 0,27 (27 %)
Ответ: = 0,27 (27 %).
З

Определить молярную концентрацию 56,68 %-ного раствора азотной кислоты, плотность которого равна 1,356 г/мл.
Определить молярную концентрацию 18 %-ного раствора соляной кислоты, плотность которого равна 1,089 г/мл.
Вычислите молярную концентрацию 10 %-ного раствора серной кислоты (пл. 1,07 г/мл).
Вычислите молярную концентрацию 16 %-ного раствора сульфата меди II, плотностью 1,18 г/мл.

IX ТИП. УСЛОЖНЕННЫЕ ЗАДАЧИ.
Типовая задача №1. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%.
Решение:
ω=m (вещества)/m (раствора)
Найдем массу хлорида алюминия из первого раствора
m (вещества)= m (раствора)∙ω
m (вещества)= 110г ∙0,1 = 11 г
m (воды) = m (раствора)- m (вещества)= 110-11 = 99 г
По условию выпарили 10 г воды.
Далее в раствор добавляют 5 г соли
Таким образом, в итоговом растворе будет содержаться:
воды 99-10 = 89 г
хлорида алюминия = 11 + 5 = 16 г
суммарная масса = 89 + 16 = 105 г
Подставим значения в формулу ω= 16∙100%/105 =15,2 %
Типовая задача №2. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.


 адачи для самостоятельной работы
адачи для самостоятельной работы II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ИЛИ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ, ПОЛУЧЕННОМ ПРИ СМЕШИВАНИИ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ
II ТИП. ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ИЛИ МАССОВОЙ ДОЛИ ВЕЩЕСТВ В РАСТВОРЕ, ПОЛУЧЕННОМ ПРИ СМЕШИВАНИИ РАСТВОРОВ РАЗНОЙ КОНЦЕНТРАЦИИ 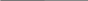 (p) = 140 г
(p) = 140 г