Использование ик спектров различных растворителей в анализе строения сольватированных дитиокарбаматных комплексов металлов по дисциплине
 Скачать 0.75 Mb. Скачать 0.75 Mb.
|
|
МИНИСТЕРСТВО ПРОСВЕЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Благовещенский государственный педагогический университет» Естественно-географический факультет Кафедра химии КУРСОВАЯ РАБОТА на тему: Использование ИК спектров различных растворителей в анализе строения сольватированных дитиокарбаматных комплексов металлов по дисциплине:
Благовещенск 2021 СОДЕРЖАНИЕ
Выводы Список литературы ВВЕДЕНИЕ Аналитическая химия – это наука о методах определения химического состава вещества и его структуры. Предметом аналитической химии является разработка методов и практическое выполнение анализов, исследование теоретических основ аналитических методов, к которым относятся: изучение форм существования элементов и их соединений в различных средах и агрегатных состояниях, определение состава и устойчивости координационных соединений, оптических, электрохимических и других характеристик вещества, исследование скоростей химических реакций, определение метрологических характеристик методов. Спектроскопические методы – один из важнейших разделов современной аналитической химии. Высокая специфичность оптической спектроскопии объясняется тем, что каждое вещество обладает своими спектральными свойствами, отличными от спектральных характеристик других веществ. С помощью данного метода можно устанавливать качественный и количественный состав различных проб. Методы анализа, основанные на поглощении электромагнитного излучения анализируемыми веществами, составляют обширную группу абсорбционных оптических методов. При поглощении света атомы и молекулы анализируемых веществ переходят в новое возбужденное состояние. В зависимости от вида поглощающих частиц и способа трансформирования поглощенной энергии различают: атомно-абсорбционный, молекулярный абсорбционный, люминесцентный (флуорометрический) анализы, а также анализ поглощения и рассеяния световой энергии взвешенными частицами анализируемого вещества. Средний ИК диапазон (2-10 мкм) часто называется диапазоном «отпечатков» пальцев молекул» из-за наличия в нем большого количества колебательно – вращательных переходов различных молекул, встречающихся в атмосфере, тканях человеческого тела и т.д. По этой причине спектральный анализ излучения в среднем ИК диапазоне является широко востребованными в различных научных, производственных, медицинских и военных приложениях[8-9]. Актуальность: Обеспечение граждан страны качественными, безопасными и эффективными лекарственными средствами является важнейшей задачей государства. Организация работы, направленной на предотвращение поступления фальсифицированных и некачественных лекарственных средств, и контроль за своевременным изъятием из обращения и уничтожением в случае их поступления, является одним из основных направлений совершенствования системы лекарственного обеспечения. Сама ИК спектроскопия также помогает обнаружить различные органические растворители с помощью определенных полос, которым соответствуют определенные растворители. Такой метод анализа широко используется в фармацевтической химии и в обнаружении и изучении разных веществ, так как они имеют неповторимый ИК спектр. Цель курсовой работы: знакомство с тематикой и организацией научных исследований в лабораториях высшего учебного заведения; получение первичных профессиональных умений и навыков по ИК-спектроскопии и интерпретации ИК спектров органических молекул. Задачи курсовой работы: 1. Изучить основы ИК спектроскопического метода анализа. 2. Отработать методику регистрации ИК спектров жидких органических растворителей. 3. Интерпретировать полученные экспериментальные ИК спектры. 4. Обосновать возможность применения полученных спектроскопических данных для анализа дитиокарбаматных комплексов металлов, сольватированных соответствующими молекулами растворителя. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДА ИК СПЕКТРОСКОПИИ Метод ИК спектроскопии представляет собой запись инфракрасных спектров поглощения вещества. Это поглощение веществом в области инфракрасного излучения происходит в результате колебаний атомов в молекулах. Колебания атомов подразделяются на: Валентные колебания. При таких колебаниях изменяются расстояния между атомами. Колебательные колебания. В ходе колебаний изменяются углы между связями. Переходы различных колебательных состояний в молекулах квантованы, вследствие чего поглощение в ИК области имеет форму спектра, где каждому колебанию соответствует своя длина волны. Для каждого колебания длина волны зависит от того какие атомы в нем участвуют и мало зависит от их окружения. Таким образом, для каждой функциональной группы характерен ряд колебаний определенной длины волны. На этих свойствах ИК спектров и основывается идентификация соединений по спектральным данным[13-14]. Основным методы ИК спектроскопии является абсорбционный, блок-схема которого представлена на рисунке 1. Абсорбционный метод основан на явлении поглощения излучения, и позволяет изучить вещество в различных агрегатных состояниях, при различных температурах и давлениях, а также исследовать спектры окрашенных веществ. ИК спектры также позволяют узнать состояние молекул, сорбированных на поверхности вещества или находящихся внутри благодаря наличию пор, каналов, интервалов между слоями и межзеренных пространств[1]. 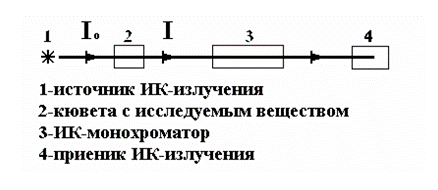 Рисунок 1. Блок-схема абсорбционного метода [1]. В основе каждого метода спектроскопии и, в том числе, метода инфракрасной спектроскопии выделяют четыре основных процесса: – абсорбция – взаимодействие исследуемого вещества и диагностирующего электромагнитного излучения, приводящее к частичному поглощению самого вещества; – люминесценция – процесс возбуждения частиц исследуемого вещества внешним излучением и впоследствии испускание квантов излучения, имеющих другую длину волны; – эмиссия (испускание) излучения исследуемым веществом в состоянии плазмы самопроизвольным образом; – рассеяние исследуемым веществом электромагнитного излучения, падающего на образец[2-3]. Однако нельзя сказать об однозначной идентификации вещества методом ИК спектроскопии, так как этот метод в большей степени позволяет выявить определенные функциональные группы, а не их количество и способ связи друг с другом в соединение. Принципы устройства и работы ИК спектрометров В настоящее время в сфере спектрального приборостроения разработаны приборы различных конструкций, охватывающие весь диапазон инфракрасного излучения. По принципу получения спектра приборы для ИК-области делятся на две основные группы: диспергирующие и недиспергирующие. Диспергирующие и недиспергирующие спектрометры Как диспергирующие устройства используются дифракционные решетки и призмы из материала с соответствующей ИК диапазону дисперсией. Для средней ИК области (400-5000 см-1) чаще применяют призмы из монокристаллов бромида калия, хлорида натрия и фторида лития. В наши дни призмы все реже находят применение и практически вытеснены дифракционными решетками, так как дифракционные решетки способны давать большее преимущество в энергии излучения и высокое разрешение. Сканирующие диспергирующие ИК спектрометры (рис. 1.1) по схеме освещения могут быть однолучевыми (А) и двухлучевыми (B. При однолучевой схеме спектр поглощения исследуемого вещества регистрируется на совпадающей с длиной волны кривой интенсивности и вместе с фоновым поглощением. Двухлучевая схема позволяет выравнивать фон, т.е. линию полного пропускания, и компенсировать поглощение атмосферных паров воды и углекислого газа, а также ослабление пучков окнами кюветы и, если необходимо, поглощение растворителей.  Рисунок 1.1. Блок-схемы однолучевого (А) и двухлучевого (B) методов измерения спектров поглощения[1]. Важной составляющей сканирующих спектрометров является монохроматор, и в качестве диспергирующего устройства в нем могут использоваться призмы из прозрачных в ИК области материалов с подходящей дисперсией или эшелетты (дифракционные решетки). Так как дисперсия материалов является наибольшей у длинноволнового предела их прозрачности и быстро падает с уменьшением длины волны, то в средней ИК области принято использовать сменные призмы, которые изготавливаются из монокристаллов бромида калия, хлорида натрия, фторида лития, а для области 200-400 см-1 – из иодида цезия [4-5]. Но, несмотря на высокое качество этих приборов, они все больше заменяются на фурье-спектрометры, относящиеся к группе недиспергирующих приборов. Действие Фурье-спектрометров основано на явлении интерференции электромагнитного излучения, для их изготовления используются интерферометры нескольких типов, в основном интерферометр Майкельсона, принципиальная оптическая схема которого представлена на рис. 1.1.1. В приборе поток инфракрасного излучения от источника преобразуется в параллельный пучок, затем разделяется на два луча с помощью светоделителя. Один луч попадает на подвижное зеркало, второй – на неподвижное. Отраженные от зеркал лучи возвращаются тем же оптическим путем на светоделитель. Эти лучи интерферируют благодаря приобретенной разности хода и разности фаз, создаваемой подвижным зеркалом. В результате интерференции получается сложная интерференционная картина, являющаяся наложением интерферограмм, которые отвечают определенной разности хода и длине волны излучения. Объединенный световой поток проходит через образец и попадает на приемник излучения. Усиленный сигнал поступает на вход компьютера, который осуществляет Фурье-преобразование интерферограммы и получение спектра поглощения исследуемого образца. Фурье-спектроскопия имеет ряд преимуществ. Во-первых, преимущество в энергии, так как при сканировании в каждый момент времени на приемник попадает излучение всего исследуемого спектрального диапазона длин волн, а не узкий его участок, определяемый в монохроматоре обычного прибора диспергирующей системой и щелями. Во-вторых, возможность повышения разрешающей силы интерферометра без уменьшения потока лучистой энергии. Разрешающая способность Фурье-спектрометра пропорциональна максимальной разности хода пучков, например, чтобы повысить, вдвое разрешение спектра, нужно просто удвоить длину перемещения зеркала, а соответственно, и время регистрации. Благодаря этим преимуществам Фурье-спектроскопия имеет высокую чувствительность и точность измерений интенсивности, особенно при многократном сканировании и накоплении сигнала; очень высокое разрешение (до 10-2 см-1) и высокая точность определения волновых чисел; быстродействие, т. е. возможность быстрого исследования широкой спектральной области (время сканирования для интервала в несколько сотен см-1 составляет < 1 с)[5-7].  Рисунок 1.1.1. Принципиальная оптическая схема интерферометра Майкельсона (без коллимации пучков). 1 – источник излучения, 2 – прерыватель, 3, 5 – зеркала, 4 – светоделитель, 6 – линзы, 7 – кюветное отделение, 8 – приемник[10]. Источники ИК излучения Обычно в качестве источников непрерывного ИК излучения используют силитовый стержень – «глобар» (штифт из карбида кремния) или штифт Нернста (из оксидов редкоземельных элементов). Кривая интенсивности излучения этих источников, нагреваемых током до высоких температур, имеет вид кривой излучения абсолютно черного тела. Основная доля теплового излучения нагретых твердых тел или излучения газового разряда приходится на видимую и ближнюю ИК область спектра, а в длинноволновой части мощность излучения этих источников составляет ничтожную долю общей мощности. До низкочастотного предела 200 см-1 используются обычно указанные выше тепловые источники ИК излучения, но они являются очень слабыми даже в интервале 400 – 200 см-1, где кривая интенсивности имеет далекий от максимума склон. Ниже 200 см-1 в качестве источника используют ртутную лампу высокого давления. В ее верхней части рабочего диапазона обычно используется тепловое излучение нагретых стенок, а ниже – поток излучения ртутной дуги и плазменная эмиссия[4]. Приемники ИК излучения Приемниками инфракрасного излучения в спектрометрах для средней ИК области являются чувствительные термопары или болометры, построенные по принципу термометров сопротивления. К тепловым приемникам также относится пневматический или оптико-акустический приемник (ячейка Голея), в нем под действием излучения происходит тепловое расширение газа. Газ помещается в зачерненной камере с гибкой стенкой, имеющей зеркальное внешнее покрытие. Движение отраженного зеркалом светового луча регистрируется фотоэлементом. Этот приемник изготовляется обычно для длинноволновой ИК области, где используется также другая группа приемников: квантовые или фотонные[4]. ИК СПЕКТРОСКОПИЯ ЖИДКИХ РАСТВОРИТЕЛЕЙ Большинство исследуемых органических или неорганических веществ в любом агрегатном состоянии обладают высокой поглощающей способностью в инфракрасной области спектра, поэтому для приготовления исследуемого вещества к анализу требуется использование или растворителя, или разбавителя. В области ИК спектроскопии для этого используются методы исследования растворов вещества в органических растворителях, исследование суспензий в вазелиновом масле, исследование спрессованных с оптически чистым бромистым калием таблеток, исследование напыленных на прозрачную в ИК области подложку пленок, исследование зажатых между окошками кюветы тонких слоев жидкого вещества[15]. Рассмотрим приготовление растворов. Простым приемом приготовления образца является метод жидкой пленки. Он используется для получения качественных образцов спектров нелетучих, нереакционноспособных, нерастворимых жидкостей. Для этого капля вещества сжимается между двумя слоевыми пластинками или помещается на плоскую стеклянную поверхность и «вытирается» солевой пластинкой. Толщина образца в пределах сечения светового луча рекомендуема должна быть более однородной, без воздушных пузырьков. Спектры, полученные данным методом, не очень воспроизводимы и не пригодны для количественной обработки (толщина поглощающего слоя не известна). Для того, чтобы получить спектры растворимых в летучих растворителях смол или лаков, тонкий слой соответствующего раствора, нанесенного на солевое окно, аккуратно высушивают под тепловой лампой, феном или в вакуумном эксикаторе, до полного удаления растворителя[11-12]. В некоторых случаях предпочтительнее используют приготовление проб в виде растворов. Этот метод более трудоемок, но его преимущество заключается в высокой воспроизводимости и в возможности выполнять количественные измерения. При выборе растворителя подбираются те, в которых вещество достаточно хорошо растворимо и которые имеют окна прозрачности в аналитических областях спектра. Выбранных растворитель должен быть химических инертным, поддаваться очистке и осушке. В областях спектра, где пропускание растворителя опускается ниже 30%, будет понижена и чувствительность измерений, а шумы и погрешности измерений будут возрастать. В качестве растворителей могут применяться предельные углеводороды, вода, спирты, галоидпроизводные, простые эфиры, кислоты и др. На рисунке 2 приведены области поглощения наиболее часто употребляемых растворителей.  Рисунок 2.Поглощение некоторых растворителей при толщине слоя 0,1 мм[12]. Большинство органических веществ дает приемлемые спектры в области 625 – 400 см-1 в кювете толщиной 0.1 мм при концентрации 1 г/10 мл. При работе ниже 600 см-1 могут понадобиться более высокие концентрации. При сильнопоглощающих фтор- или кремнийорганических соединений концентрация может быть снижена до 0.2 г/10 мл. для соединений, содержащих полярные группы, нужно иметь в виду возможность проявления в спектрах межмолекулярных взаимодействий (например, водородных связей). При выборе толщины кюветы важно учитывать количество имеющегося в распоряжении образца или его растворимость. Слишком тонкие кюветы (меньше 0,05 мм) трудно изготавливать, заполнять и опорожнять. А в кюветах толщиной более 0,2 мм поглощение растворителя может оказаться слишком сильным. Удобными для работы считаются кюветы толщиной 0,1 мм. В специальных случаях для анализа следовых количеств в узких областях высокой прозрачности растворителя могут использоваться кюветы с толщиной поглощающего слоя до 1 см, перед приготовлением образца с такой толщиной поглощающего слоя необходимо проверить пропускание растворителя и его чистоту. Определить толщину кювет позволяет то, что о в спектре пустой чистой кюветы с плоско-параллельными окнами наблюдаются регулярные максимумы и минимумы, обусловленные интерференцией. Расстояние t (см) вычисляют по формуле (1): 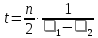 , (1) , (1)где 1 и2 – волновые числа в см-1 , а n – число максимумов между ними (нумерация начинается с 0). При длительном использовании окна жидкостной кюветы могут помутнеть или загрязниться. Внешний вид не всегда позволяет определить состояние окон, поэтому необходимо контролировать их чистоту, записывая их спектры. Применение водных растворов из-за очень сильного поглощения жидкой воды в инфракрасной области ограничено такими специальными областями, как биологические исследования. Использование жидкостных кювет толщиной менее 10 мкм из водостойких материалов – германия, кремния, селенида цинка позволяет проводить исследования в значительной части области «отпечатков пальцев». Поскольку при дейтерировании частоты колебаний смещаются в область низких волновых чисел, то иногда в качестве растворителя используют тяжелую воду[5]. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Экспериментальная часть включает в себя получение ИК спектров различных растворителей, выявление характеристических полос, соответствующих определенным растворителям и анализ ИК спектров сольватированных дитиокарбаматных комплексов различных металлов. 3.1. Приборы и реактивы ИК-спектры образцов, запрессованных в таблетках с KBr, регистрировали на интерференционном ИК-спектрометре с Фурье-преобразованием ФСМ–1201 в диапазоне 400–4000 см–1. Управление прибором и обработку спектров осуществляли по программе FSpec (версия 4.0.0.2 для Windows, ООО «Мониторинг», Россия). Реактивы: бромид калия, толуол, ацетон, этанол, тетрахлорметан, дихлорметан. 3.2. Методика выполнения работы Для проведения работы использовали метод жидкой пленки. Для этого заранее спрессовываются таблетки бромистого калия. Затем капля исследуемого вещества сжимается между двумя таблетками. После чего исследуемый образец помещается в кюветное отделение Фурье ИК спектрометра и происходит снятие спектра поглощения исследуемого образца. 3.2.1 Расшифровка ИК спектров Ацетон – органическое вещество, имеющее формулу C₃H₆O, CH₃–C(O)–CH₃, простейший представитель насыщенных кетонов. 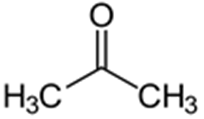 Рисунок 3.1.1. Структурная формула ацетона. 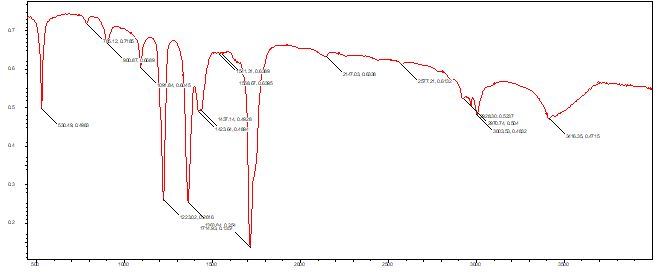 Рисунок 3.1.2. ИК спектры ацетона. Наличие частот 1363см-1 в области 1395-1365см-1, 1437см-1 и 1421см-1 в области 1470-1430 см–1 указывают на наличие CH3[6]. Наличие поглощения равного 1714см-1 в области 1775-1650 см-1 указывает на присутствие C=O[6]. Толуол – метилбензол C₆H₅–CH₃, сокращённое химическое обозначение - PhMe. Бесцветная жидкость с характерным запахом, относится к аренам. 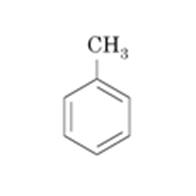 Рисунок 3.2.1. Структурная формула толуола. Наличие частот 1460см-1 в области 1470-1430 см–1, 1379см-1 в 1395-1365 см–1 говорят о наличии CH3. Поглощение 3020см-1 в области 3040-3010см-1 говорит о наличии =CH. Поглощения 2920см-1 и 2872см-1 в области 3000-2840см-1 показывает присутствие C–H. Частоты 1685см-1 в области 1690-1635см-1 и 1685 в 1780-1610см-1 говорят о наличии С=С. Частоты колебаний 1379см-1 в области 1420-1290см-1 говорят о возможном присутствии =CH (плоск.), а частоты 729см-1, 785см-1, 843см-1, 894см-1 в области 1005-675см-1 о =CH(внеплоск.). О наличии ароматического кольца говорят спектры 1685см-1, 1736см-1, 1801см-1, 1857см-1, 1942 см-1 в области 2000-1650см-1. О наличии C–C — спектр 1629см-1 в области 1525-1475см-1 и 1575см-1 в 1625—1575см-1. C–H можно обнаружить в области 3080—3030см-1 в спектрах 3063см-1, 3026 см-1, 3086см-1[6]. 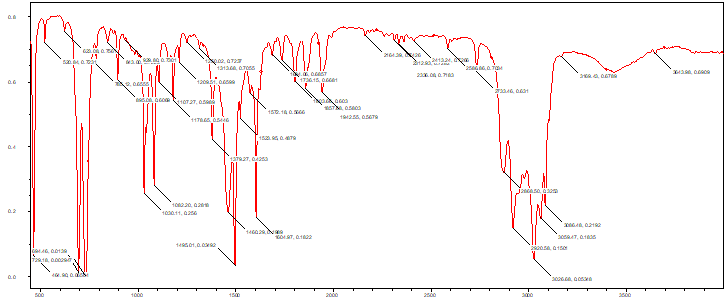 Рисунок 3.2.2. ИК спектры толуола. Этанол – одноатомный спирт с молекулярной формулой C2H5OH. 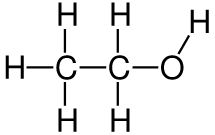 Рисунок 3.3.1. Структурная формула этанола. 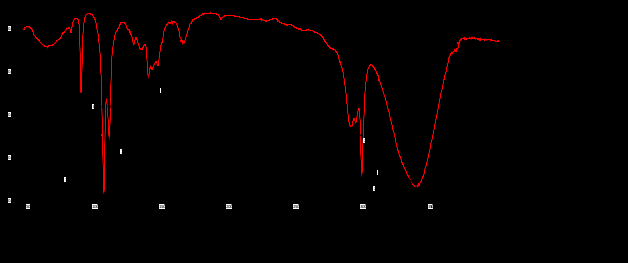 Рисунок 3.3.2. ИК спектры этанола. Наличие частот 3381 см-1 и 2891 см-1 в области 3500-2400см-1 указывает на присутствие группы OH [6]. Наличие поглощений равных 2974 см-1 в области 2975-2950 см-1 указывает на присутствие связи –CH3[12]. Частота равная 1381 см-1 в области 1400-1200 см-1 относится к колебаниям связи C–O–H, также частота равная 879 см-1 предположительно указывает на наличие C–O–H связи. Частоты колебаний равные 1087 см-1 и 1049 см-1 в области 1200-1000 см-1 указывают на наличие связи C–O[6]. Тетрахлорметан – галагеноалкан с молекулярной формулой CCl4. 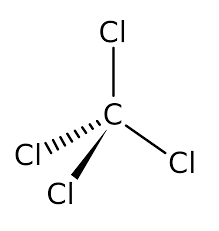 Рисунок 3.4.1. Структурная формула тетрахлорметана. 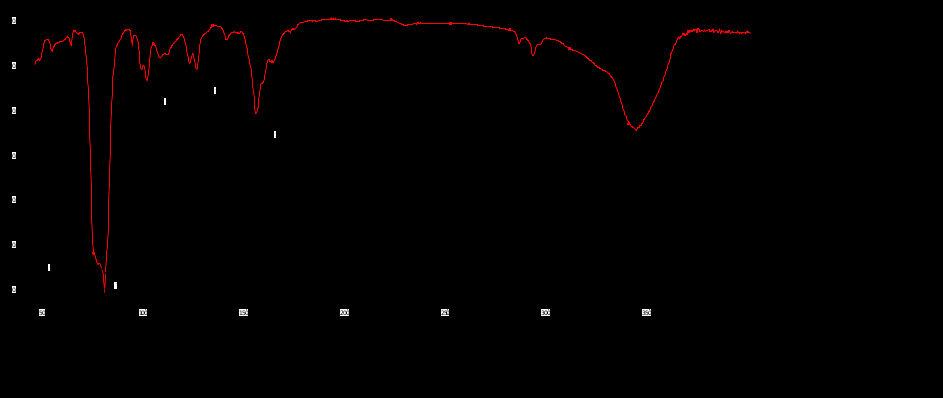 Рисунок 3.4.2. ИК спектры тетрахлорметана. Частоты колебаний 796 см-1 и 760 см-1 в области 800-700 см-1 указывают на связь C–Cl[12]. Также в рассматриваемом присутствуют частоты 1549 см-1, 1251 см-1, 1005 см-1. Дихлорметан – органическое галогенпроизводное соединение. Имеет молекулярную формулу CH2Cl2. 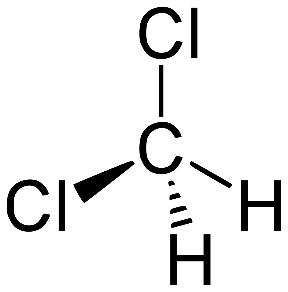 Рисунок 3.3.1. Структурная формула дихлорметана. 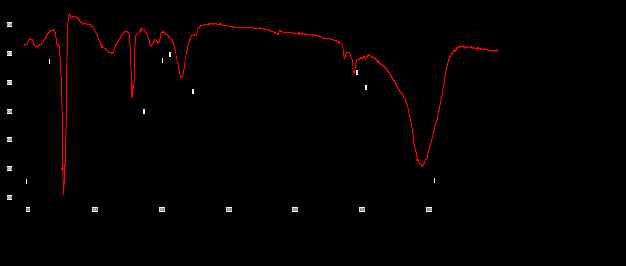 Рисунок 3.3.2. ИК спектры дихлорметана. Наличие полос 750 см-1 в области 780-750 см-1 соответствует связи C–Cl[6]. В области 2900-2880 см-1 колебания 2922 см-1 предположительно соответствуют C–H связи[6]. Также отмечаются колебания 2854 см-1, 1456 см-1, 1400 см-1, 1263 см-1, 553 см-1. 3.2.2. Выявление характеристических полос определенных растворителей в спектрах сальватированных дитиокарбаматных комплексах металлов. Выявление характеристических полос дихлорметана в комплексе гексаметилендитиокарбамата серебра (I) [Ag6{S2CN(CH2)6}6]·2CH2Cl2. 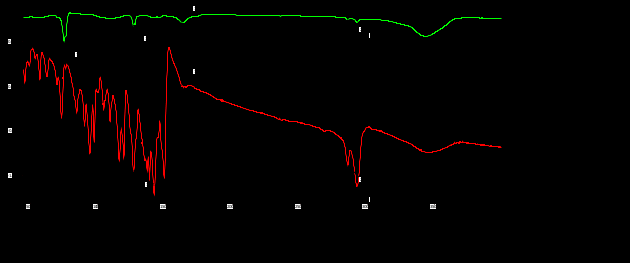 Рисунок 3.4.1. ИК спектры гексаметилендитиокарбамата серебра (I) и дихлорметана. Поглощения в областях 2926 см-1, 2853 см-1, 1624 см-1, 1259 см-1, 750 см-1 дихлорметана соответствуют частично областям поглощения комплексе гексаметилендитиокарбамата серебра(I) и указывают на присутствие молекул растворителя дихлорметана в комплексе гексаметилендитиокарбамата серебра(I)[6]. Выявление характеристических полос ацетона в гетерополиядерном комплексе золото(III) – висмут(III) [Au{S2CN(изо-C4H9)2}2]3[Bi2Cl9]·2(CH3)2CO. 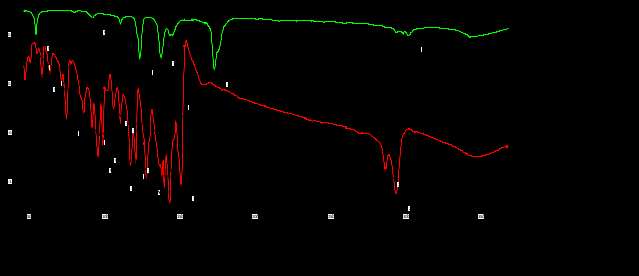 Рисунок 3.4.2. ИК спектры гетерополиядерном комплексе золота(III) – висмута(III) [Au{S2CN(изо-C4H9)2}2]3[Bi2Cl9]·2(CH3)2CO и ацетона. Наличие частот 1465см-1, 1440см-1 в области 1470-1430см-1 и 1390см-1 в области 1395-1365см-1 говорят о присутствии CH3. Поглощения 1708см-1 и 1747см-1 говорят о возможном присутствии C=O[6]. валентные колебания связей в … отражают полосы поглощения валентным колебаниям связей … в … соответствует сильная (слабая…, средней интенсивности) полоса с частотой… Наиболее интенсивная полоса поглощения в ИК спектре, вызванная валентными колебаниями связей .. в группах .., регистрируется при … см–1. В ИК-спектрах комплексов (образцов…) полосы поглощения в области … см–1 обусловлены валентными колебаниями связей …: 51654… см–1. Интенсивные (1149/1148 см–1) и среднеинтенсивные (970/962 см–1) полосы поглощения отнесены к колебаниям as(СS2) и s(СS2) соответственно. Идентификация молекул хлороформа в составе I может быть проведена по поглощению в двух областях ИК-спектра: в области частот 3000 см–1 помимо полос поглощения колебаний групп –СН2– находится полоса валентных колебаний связей С–Н в молекуле CHCl3 c частотой (СН) 2885 см–1 (при этом обычно относительно слабая полоса поглощения метиновой группы в спектре I имеет высокую интенсивность, обусловленную наличием дипольного момента и полярностью связи С–Н в молекулах хлороформа); в области 800-600 см–1 регистрируется дублет полос поглощения одинаково высокой интенсивности νas (C–Cl) 750 и 743 см–1 и среднеинтенсивная полоса νs (C–Cl) 657 см–1. По отношению к соответствующим сигналам ИК спектра индивидуального хлороформа полосы валентных колебаний сольватных молекул характеризуются меньшими значениями частот в результате проявления межмолекулярных взаимодействий молекул растворителя с кристаллической структурой комплекса. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Воробьева, Р.П. Техника и интерпретация инфракрасных спектров поглощения органических молекул: Учебно-методическое пособие / Р. П. Воробьева, О. В. Овчинников, М. А. Ефимова. – Воронеж: Изд-во ВГУ, 2005. – 39 с. Ищенко, А. А. Спектральные методы анализа / А. А. Ищенко. – М.: Московский государственный университет тонких химических технологий имени М.В. Ломоносова, 2013. – 167 с Коровкин, Н. В. Инфракрасная спектроскопия карбонатных пород минералов / Н. В. Коровкин, Л. Г. Ананьев. – Издательство Томского политехнического университета, 2016. – 75 с. Колесник, И. В. Инфракрасная спектроскопия / И. В. Колесник, Н. А. Саполетова. – М.: Московский государственный университет тонких химических технологий имени М.В. Ломоносова, 2011. – 88 с. Тарасевич, Б. Н. Основы ИК спектроскопии с преобразованием Фурье. Подготовка проб в ИК спектроскопии / Б. Н. Тарасевич. – М.: Московский Государственный Университет имени М.В.Ломоносова, 2012. – 22 с. Гремлих, Г.-У. Язык спектров. Введение в интерпретацию спектров органических соединений / Г.-У. Гремлих. – ООО "Брукер Оптико", 2002. – 94 с. Егоров, А. С. Инфракрасная Фурье-спектроскопия / А. С. Егоров. – Н.: Нижегородский государственный университет им. Н.И. Лобачевского, 2012. – 40 с. Емельянова, Ю. В. Спектроскопические методы анализа в аналитической химии / Ю. В. Емельянова, М. В. Морозова, Е. С. Буянова. – Е.: Издательство Уральского университета, 2017. – 90 с. Васильев, А. В. Инфракрасная спектроскопия органических и природных соединений / А. В. Васильев, Е. В. Гриненко, А. О. Щукин, Т. Г. Федулина. – СПб.: СПбГЛТА, 2007. – 54 с. Пентин, Ю. А. Физические методы исследования в химии / Ю. А. Пентин, Л. В. Вилков. – М.: Мир, 2003. – 683 с. Коваленко, В. И. Идентификация веществ в смеси методом инфракрасной спектроскопии: Методические указания / В. И. Коваленко, Т. Л. Диденко, А. В. Нестеров. – К.: Казан. гос. технол. ун-т; 2006. – 20 с. Казицына, Л. Α. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии / Л. А. Казицына, Н. Б. Куплетская. М.: Изд-во Моск. ун-та, 1979. – 240 с. Беллами, Л. Инфракрасные спектры молекул / Л. Беллами. – М.: Издательство иностранной литреатуры, 1963. – 592 с. Паникоровский, Т. Л., Бритвин С. Н. Об использовании инфракрасной спектроскопия для исследования структурных особенностей органических и неорганических соединений [Электронный ресурс] – Режим доступа : http://xrd.spbu.ru/netcat_files/userfiles/ – 2013 Белоусова Е. Н. Инструментальные методы исследований почв и растений: Электронный учебно-методический комплекс [Электронный ресурс] – Режим доступа : http://www.kgau.ru/distance/2013/a2/011/02_04.html. – 2013.  |
