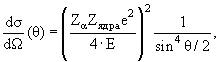|
|
Шпаргалки Квантовая физика. Испускание электронов веществом под действием света называется
18. Спин электрона. Спин-орбитальное взаимодействие. Опыт Штерна-Герлаха.
Опыт Штерна — Герлаха — опыт немецких физиков Штерна и Герлаха,. Опыт подтвердил наличие у атомов спина (изначально в эксперименте участвовали атомы серебра, а потом и других металлов) и факт пространственного квантования направления их магнитных моментов.
Опыт состоял в следующем: пучок атомов серебра пропускали через сильно неоднородное магнитное поле, создаваемое мощным постоянным магнитом. При прохождении атомов через это поле, в силу обладания ими магнитных моментов, на них действовала зависящая от проекции спина на направление магнитного поля сила, отклонявшая летящие между магнитами атомы от их первоначального направления движения. Причём, если предположить, что магнитные моменты атомов ориентированы хаотично (непрерывно), то тогда на расположенной далее по направлению движения атомов пластинке должна была проявиться размытая полоса. Однако вместо этого на пластинке образовались две достаточно чёткие узкие полосы, что свидетельствовало в пользу того, что магнитные моменты атомов вдоль выделенного направления принимали лишь два определённых значения, что подтверждало предположение квантово-механической теории о квантовании магнитного момента атомов.
Позднее с аналогичными результатами были проделаны опыты для пучков атомов других металлов, а также пучков протонови электронов. Эти опыты доказали существование магнитного момента у рассмотренных частиц и показали их квантовую природу, явив собой доказательство постулатов квантовой теории.
Спин — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спин измеряется в единицах (приведённойпостоянной Планка, илипостоянной Дирака) и равен гдеJ— характерное для каждого сорта частиц целое (в том числе нулевое) или полуцелое положительное число — так называемоеспиновое квантовое число, которое обычно называют просто спином (одно изквантовых чисел).
Спин-орбитальное взаимодействие — в квантовой физике взаимодействие между движущейся частицей и её собственным магнитным моментом, известным как спин. Наиболее часто встречающимся примером такого взаимодействия является взаимодействие электрона, находящегося на одной из орбит в атоме, с собственным спином. Такое взаимодействие, в частности, приводит к возникновению так называемой тонкой структуры энергетического спектра электрона и расщеплению спектроскопических линий атома.
19.Квантовые числа электрона в атоме. Таблица Менделеева
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона 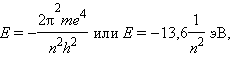
где n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями nобразуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
S=0, p=1,d=2,f=3,g=4…
Электроны с одинаковым значением l образуют подуровень.
Квантовое число l определяет квантование орбитального момента количества движения электронав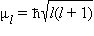 сферически симметричном кулоновском поле ядра. сферически симметричном кулоновском поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно ось z):
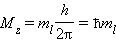
Спиновое квантовое число ms имеет только два значения ms = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз .
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом.
В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения 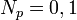
Периодическая система элементов Менделеева.Менделеев открыл, что физические и химические свойства элементов повторяются периодически-периодический закон. Долго не могли понять почему так, объясняет квантовая механика. Рассмотрим электронное состояние в атоме, учитывая что е занимают нижние энергетические слои, которые квантованы. В сложных атомах энергия е зависит от n и l (n-формирует электронные уровни; l-форму электронного облака). Выделим электронную конфигурацию т.е. состояния е с одинаковыми n и l эти е образуют подоболочку; обозначается цифрой (значение n) и буквой (значение l). l: 0=s; 1=p; 2=d; 3=f; 4=g. Энергетические уровни с большим числом n могут быть ниже уровней с меньшим n(ведь энергия зависит от l т.е. период заполнен не полностью). Разных значений m может принимать 2l+1, а разных электронных состояний с одинаковыми l и n будет 2*(2l+1), т.к.ms=±1/2.
|
20. Молекулы
Молекула – эл-ки нейтральная ч-ца, обр-ная из двух или более связанных ковалентными связями атомов. В физике к молекулам причисляют также одноатомные молекулы, то есть свободные атомы (напр., инертных газов, ртути,…).
Строением и св-вами молекулы опр-ся физ. Явл-я, к-рые изучаются молекулярной физикой. В физике понятие молекулы исп-ся для объяснения св-в газов, жидкостей и твёрдых тел. Подвижностью молекул опр-ся способность в-ва к диффузии, её вязкость, теплопроводность,...
Диффузия - процесс взаимного проникновения молекул или атомов одного в-ва между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их конц-й по всему занимаемому объёму. В нек-рых ситуациях одно из в-в уже имеет выравненную конц-ю и говорят о диффузии одного в-ва в другом. При этом перенос в-ва происходит из области с высокой конц-ей в область с низкой конц-ей).
Вязкость (внутреннее трение) - одно из явл-й переноса, св-во текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. В рез-те работа, затрачиваемая на это перемещение, рассеивается в виде тепла.
Теплопроводность - способность материальных тел к переносу Е (теплообмену) от более нагретых частей тела к менее нагретым телам, осуществляемому хаотически движущимися ч-цами тела (атомами, молекулами, ē, …). Такой теплообмен может происходить в любых телах с неоднородным распределением темп-р, но механизм переноса теплоты будет зависеть от агрегатного сост-я в-ва. Теплопроводностью наз-ся также кол-ная хар-ка способности тела проводить тепло. В сравн-и тепловых цепей с эл-кими это аналог проводимости.
|
21. Зонная теория кристаллических тел. Металлы, диэлектрики, полупроводники. P-n переход
В основе квантовой теории электропроводности твердых тел лежит зонная теория, которая основывается на изучении энергетического спектра электронов. Этот спектр делится на зоны, которые разделены запрещенными промежутками. С точки зрения зонной теории различие электронных свойств металлов, диэлектриков и полупроводников объясняется двумя причинами: 1) характером расположения энергетических зон, точнее шириной запрещенной зоны 2) различным заполнением электронами разрешенных энергетических зон.
Зона, образованная уровнями энергии, на которых находятся валентные электроны в основном состоянии атома, называется валентной зоной.
При абсолютном нуле валентные электроны заполняют попарно нижние уровни валентной зоны.
Зона проводимости - образована энергетическими уровнями, находясь на которых электрон является обобществленным, т.е. не связанным с отдельным атомом (зона свободных электронов). Если в зоне проводимости есть электроны, то при приложении электрического поля по веществу будет протекать ток.
Отличия с точки зрения зонной теории:
Между металлами и диэлектриками
а) при 0 К у металлов в зоне проводимости имеются электроны, у диэлектриков их нет.
б) у металлов нет или очень узкая запрещенная зона, у диэлектриков - большая запрещенная зона.
Между диэлектриками и полупроводниками:
а) ширина запрещенной зоны полупроводника 1 эВ; диэлектрик > 3эВ.
б) при 0 К полупроводники ведут себя как диэлектрики, при возрастании температуры проводимость полупроводника растет.
Вольтамперная характеристика, (ВАХ) - частный случай передаточных характеристик, определяющих зависимость (функцию) выходной величины от входной для данного конкретного устройства или схемы. Вольтамперная характеристика - это график зависимости тока через двухполюсник от напряжения на этом двухполюснике. Вольтамперная характеристика описывает поведение двухполюсника на постоянном токе. Чаще всего рассматривают ВАХ нелинейных элементов (степень нелинейности определяется коэффициентом нелинейности K = UdI / IdU), поскольку для линейных элементов ВАХ представляет собой прямую линию и не представляет особого интереса.
Свободными носителями заряда в полупроводниках, как правило, являются электроны, возникающие в результате ионизации атомов самого полупроводника (собственная проводимость) или атома примеси (примесная проводимость). В некоторых полупроводниках носителями заряда могут быть ионы.
Электронно-дырочным, или p-n переходом, называют контакт двух полупроводников одного вида с различными типами проводимости (электронным и дырочным).
Связь электрического поля и потенциала в p-n переходе описывается уравнением Пуассона. В одномерном приближении это уравнение имеет вид:
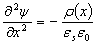
где ψ(x) - зависимость потенциала от координаты, ρ(x) - плотность объемного заряда, εs - диэлектрическая проницаемость полупроводника, ε0 - диэлектрическая постоянная.
|
22. Атомное ядро. Масса и энергия связи ядра.
Атомное ядро – центральная и очень компактная часть атома, в которой сосредоточена практически вся его масса и весь положительный электрический заряд.
Ядро, удерживая вблизи себя кулоновскими силами электроны в количестве, компенсирующем его положительный заряд, образует нейтральный атом. Большинство ядер имеют форму, близкую к сферической. Ядро имеет размер ≈ 10-12 см, что на четыре порядка меньше размера атома (10-8 см).
Атомное ядро было открыто в 1911 г. в результате серии экспериментов по рассеянию α-частиц тонкими золотыми и платиновыми фольгами, выполненных в Кембридже (Англия) под руководствомЭ. Резерфорда. Оказалось, что угловое распределение α-частиц, рассеянных на атоме, имеет вид
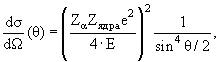
где Zα - электрический заряд α-частицы, Zядра – электрический заряд ядра, E – кинетическая энергия α-частицы, θ – угол рассеяния α-частицы.
Это означало, что в атоме имеется точечное положительно заряженное ядро, содержащее в себе практически всю массу ядра. В 1914 году Э.Резерфорд показал, что в состав атомного ядра входят протоны – ядра атома водорода.
В 1932 г. после открытия Дж.Чедвиком нейтрона стало ясно, что ядро состоит из протонов и нейтронов (В. Гейзенберг, Д.Д. Иваненко, Э. Майорана).
Атомные ядра представляют собой квантовые системы нуклонов, связанных между собой ядерным взаимодействием. Свойства атомных ядер определяются совместным действием сильных, электромагнитных и слабых взаимодействий.
Зарядом ядра называется величина Ze, где е - величина заряда протона, Z - порядковый номер химического элемента в периодической системе Менделеева, равный числу протонов в ядре. В настоящее время известны ядра с Z от Z=1 до Z=107. Для всех ядер, кроме и некоторых других нейтронодефицитных ядер N>Z, где N - число нейтронов в ядре. Для легких ядер N/Z»1; для ядер химических элементов, расположенных в конце периодической системы, N/Z»1,6.
Число нуклонов в ядре A=N+Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону - нулевое значение А.
Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Ядро химического элемента X обозначается , где Х - символ химического элемента.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов.
Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра. Эмпирическая формула для радиуса ядра м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
Плотность ядерного вещества составляет по порядку величины 1017 кг/м3 и постоянна для всех ядер. Она значительно превосходит плотности самых плотных обычных веществ.
Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра Рmяд в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон mяд
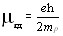
Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения от сферически симметричного является квадрупольный электрический момент ядра Q. Если плотность заряда считается везде одинаковой, то Q определяется только формой ядра.
|
Масса ядра измеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С:
1а.е.м = 1.6606 10-27 кг.
Масса ядра всегда меньше суммы масс составляющих его нуклонов.
Избыток масс Δ связан с массой атома Mат(A,Z) и массовым числом A соотношением:
Δ = Мат(A,Z) - А.
Энергия связи ядра Eсв(A,Z) это минимальная энергия, необходимая, чтобы развалить ядро на отдельные, составляющие его нуклоны.
Есв(A, Z) = [Z mp + (A - Z)mn - M(A, Z)]c2,
где Z - число протонов, ( A - Z) - число нейтронов, mp - масса протона, mn - масса нейтрона, М(A,Z) - масса ядра с массовым числом А и зарядом Z.
Энергия связи ядра, выраженная через массу атома Mат, имеет вид:
Есв(A, Z) = [ZmH + (A - Z)mn - Mат(A, Z)]c2 ,
где mH - масса атома водорода.
|
23. Радиоактивность. Закон радиоактивного распада
Радиоактивностью называется способность атомного ядра самопроизвольно распадаться с испусканием частиц.
Радиоактивный распад ядра возможен тогда, когда он энергетически выгоден, т.е. сопровождается выделением энергии. Условием этого является превышение массы M исходного ядра суммы масс miпродуктов распада, которому соответствует неравенство M > ∑mi. Это условие является необходимым, но не всегда достаточным. Распад может быть запрещен другими законами сохранения – сохранения момента количества движения, электрического заряда, барионного заряда и т.д.
Радиоактивный распад характеризуется временем жизни радиоактивного изотопа, типом испускаемых частиц, их энергиями.
Основными видами радиоактивного распада являются:
α-распад – испускание атомным ядром α-частицы;
β-распад – испускание атомным ядром электрона и антинейтрино, позитрона и нейтрино, поглощение ядром атомного электрона с испусканием нейтрино;
γ-распад – испускание атомным ядром γ-квантов;
спонтанное деление – распад атомного ядра на два осколка сравнимой массы.
Закон радиоактивного распада
Интенсивность радиоактивного распада, а также его зависимость от количества атомов и времени, выражена в Законе радиоактивного распада, открытом Эрнестом Резерфордом и Фредериком Содди в 1903 году. Для того чтобы прийти к определенным выводам, нашедшим впоследствии свое отражение в новом законе, ученые провели следующий эксперимент: они отделяли один из радиоактивных продуктов и изучали его самостоятельную активность отдельно от радиоактивности вещества, из которого он был выделен. В итоге, было обнаружено, что активность любых радиоактивных продуктов вне зависимости от химического элемента со временем уменьшается в геометрической прогрессии. Исходя из этого, ученые сделали вывод, что скорость радиоактивного превращения всегда пропорциональна числу систем, которые еще не подверглись превращению.
Закон радиоактивного распада имеет вид:
N(t) = N0e-λt,
где N0 – количество радиоактивных ядер в исходный момент времени t = 0. N(t) − число радиоактивных ядер, оставшихся в образце к моменту времени tПериод полураспада T1/2 - время, за к-рое первоначальное кол-во радиоактивных ядер уменьшится в 2 раза: T1/2=ln2/λ=0.693/λ=τln2.
| |
|
|
|
 Скачать 0.49 Mb.
Скачать 0.49 Mb.