Лабораторная 1. Лабораторка 1. Скачанное с инета. Исследование электролитической диссоциации и реакций в растворах электролитов
 Скачать 192.74 Kb. Скачать 192.74 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ МИНЕРАЛЬНО-СЫРЬЕВОЙ УНИВЕРСИТЕТ «ГОРНЫЙ» Кафедра физической химии Лабораторная работа №5 По дисциплине: ХИМИЯ Тема: Исследование электролитической диссоциации и реакций в растворах электролитов Автор: студент группы ЭРС-18-1 ___________/ Амакасова А.И./ (подпись) (Ф.И.О.) ОЦЕНКА: ____________ Дата: ________________ Проверил: доцент ___________/ Карапетян К.Г./ (подпись) (Ф.И.О.) САНКТ-ПЕТЕРБУРГ 2018 Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения. Общие сведения. Электролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Количественно способность электролита распадаться на ионы характеризуется степенью диссоциации 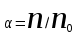 , ,где n – число продиссоциированных молей, n 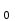 - исходное число молей электролита. - исходное число молей электролита.Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению АВ  А А + В + В При постоянной температуре произведение концентраций конечных и исходных веществ постоянно и называется константой диссоциации К 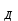 = = 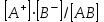 , ,где множители – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг. По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируют практически полностью, слабые – частично. Закон действующих масс справедлив лишь для слабых электролитов. К сильным относятся: Кислоты: азотную HNO 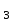 , серную H , серную H SO SO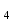 ,соляную HCL, бромисто - и йодистоводородную HBr и HJ,хлорную HCLO ,соляную HCL, бромисто - и йодистоводородную HBr и HJ,хлорную HCLO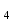 . .Гидроксиды щелочных металлов, стронция и бария. Растворимые соли. Остальные электролиты являются слабыми. Малодиссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках. Правила написания молекулярно-ионных уравнений реакций в растворах электролитов: 1. Сильные и хорошо растворимые электролиты записывают в диссоциированной форме, виде отдельных составляющих ионов. Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме. Одинаковые ионы в левой и правой частях уравнения сокращают, подобно алгебраическим уравнениям. Отсюда вытекают условия протекания реакций в растворах электролитов: Образование или растворение малорастворимого соединения, выпадающего в осадок. Растворимость соединений определяют по таблицам. Образование или разрушение малодисоциированного соединения, иона или комплекса. Выделение или растворения газа. Пример написания уравнения реакции: CaCl 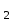 + 2AgNO + 2AgNO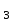 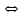 2AgCl + Ca(NO 2AgCl + Ca(NO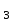 ) )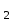 Порядок выполнения работы: Опыт 1. Образование малорастворимых оснований. 1)FeCl 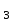 + 2KOH = Fe(OH)3 + 2KOH = Fe(OH)3 + KCl + KClFe3+ + 3OH- = Fe(OH)3  бурый осадок 2)CuSO4 + 2KOH = Cu(OH)2  + K2SO4 + K2SO4Cu2+ + 2OH- = Cu(OH)2  сине-голубой осадок 3)NiSO4 + 2KOH = Ni(OH)2  + K2SO4 + K2SO4Ni2+ + 2OH- = Ni(OH)2  светло-зелёый осадок Вывод: реакция получилась, т.к. образовались малорастворимые основания и слабые электролиты. Опыт 2. Растворение малорастворимых оснований. 1)Fe(OH)3  + 3HCl = FeCl + 3HCl = FeCl + 3H2O + 3H2OFe(OH)3  + 3H+ = Fe3+ + 3H2O + 3H+ = Fe3+ + 3H2Oжелтоватый раствор 2)Cu(OH)2  + 2HCl = CuCl2 + 2 H2O + 2HCl = CuCl2 + 2 H2OCu(OH)2  + 2H+ = Сu2+ + 2 H2O + 2H+ = Сu2+ + 2 H2Oсветло-голубой раствор 3)Ni(OH)2  + 2HCl = NiCl2 + 2H2O + 2HCl = NiCl2 + 2H2ONi(OH)2  + 2H+ = Ni2+ + 2H2O + 2H+ = Ni2+ + 2H2Oпрозрачный раствор Вывод:растворились в кислоте потому, что образовался ещё более слабый электролит. Опыт 3. Образование малорастворимых солей. А) 1) Pb (NO3)2 + 2KJ  PbJ2 PbJ2  + 2KNO3 + 2KNO3Pb2+ + 2J-  PbJ2 PbJ2  выпал жёлтый осадок 2)Pb(NO3)2 +BaCl2  PbCl2 PbCl2 + Ba(NO3)2 + Ba(NO3)2Pb2+ + 2Cl-  3PbCl2 3PbCl2 выпал белый осадок Б) 1)Na2SO4 + BaCl2  BaSO4 BaSO4 + 2NaCl + 2NaClBa2+ + SO42-  BaSO4 BaSO4 белый осадок 2)Cr2(SO4)3 + 3BaCl2  3BaSO4 3BaSO4 + CrCl3 + CrCl3Ba2+ + SO42-  Ba2SO4 Ba2SO4 белый быстрорастворимый осадок Вывод: реакции идут, т.к. образуются малорастворимые в воде вещества. Опыт 4. Изучение свойств амфотерных гидроксидов. Растворение соляной кислотой: 1)ZnSO4 + 2 NaOH  Zn(OH)2 Zn(OH)2 +3Na2SO4 +3Na2SO4Zn2+ + 2OH-  Zn(OH)2 Zn(OH)2 появился белый осадок 2)Zn(OH)2  +2HCl +2HCl  ZnCl2 +2H2O ZnCl2 +2H2OZn(OH)2  +2H+ +2H+  Zn2+ 2H2O Zn2+ 2H2Oосадок исчез Растворение едким натром: 1)ZnSO4 + 2 NaOH  Zn(OH)2 Zn(OH)2 +3Na2SO4 +3Na2SO4Zn(OH)2  + 2 NaOH(в избытке) + 2 NaOH(в избытке)  Na2[Zn(OH)4] Na2[Zn(OH)4]Zn(OH)2  + 2OH- + 2OH-  [Zn(OH)4]2- [Zn(OH)4]2-выпал белый осадок 2)Al2 (SO4)3 + 6NaOH  2Al(OH)3 2Al(OH)3 + 3Na2SO4 + 3Na2SO43Al3+ + 3OH-  Al(OH)3 Al(OH)3 появился белый осадок Добавляем соляную кислоту: Al(OH)3  + 3HCl + 3HCl  AlCl3 + 3 H2O AlCl3 + 3 H2OAl(OH)3  + 3H+ + 3H+  Al3+ + 3H2O Al3+ + 3H2OДобавляем едкий натр: 1)Al(OH)3  + 3NaOH (в избытке) + 3NaOH (в избытке)  Na3 [Al (OH)6] Na3 [Al (OH)6]Al(OH)3  + 3OH- + 3OH-  [Al (OH)6]3- [Al (OH)6]3- появляется белый осадок 2)Сr2 (SO4)3 + NaOH  2Сr(OH)3 2Сr(OH)3 + 3Na2SO4 + 3Na2SO4Cr3+ + 3OH-  Cr(OH)3 Cr(OH)3 выпал белый осадок Добавляем соляную кислоту: Cr(OH)3  + 3HCl + 3HCl  CrCl3 + 3H2O CrCl3 + 3H2OCr(OH)3  + 3H+ + 3H+  Cr3+ + 3H2O Cr3+ + 3H2Oполучаем светло-синий раствор Добавляем едкий натр: Cr(OH)3  + 3NaOH(избыток) + 3NaOH(избыток)  Na3[Cr(OH)6] Na3[Cr(OH)6] Cr (OH)3  + 3OH- + 3OH- [Cr(OH)6]3- [Cr(OH)6]3-зелёноватый раствор Вывод: в кислой среде амфотерный гидроксид реагирует как основание, а в щелочной как кислота.Опыт 5. Образование малодиссоциированных соединений. NH4Cl + NaOH  NH4OH + NaCl NH4OH + NaCl/ \ NH3 H2O NH4+ + OH-  NH4OH NH4OH NH3 + H2O NH3 + H2Oпрозрачный раствор, с резким запахом аммиака Вывод: реакция идёт, т.к. образуется вода и выделяется газ - аммиак в результате разложения гидроксида аммония. Опыт 6. Образование комплексов. CuSO4 + NH4  [Cu(NH3)4]SO4 [Cu(NH3)4]SO4получился темно-синий раствор Вывод: реакция идёт, т.к. образуется малодиссоциированное соединение – комплексные ионы в растворе. Опыт 7. Образование газов. 1)Na2CO3 + H2SO4  Na2SO4 + H2O + CO2 Na2SO4 + H2O + CO2CO32-+2H+ = CO2 + H2O бесцветный раствор, активное выделение углекислого газа 2)Na2S + H2SO4  H2S + Na2SO4 H2S + Na2SO4S2- + 2H+  H2S H2Sвыпал белый осадок, появился неприятный запах несвежих яиц Вывод:неустойчиво, т.к. образуется слабый электролит. Вывод:благодаря выполненной работе познакомились с практическими выводами теории электролитической диссоциации, с реакциями в растворах малорастворимых оснований, изучили свойства амфотерных гидроксидов, образование малодиссоциированных соединений, комплексных соединений и газов. |
