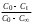Отчет по лабораторной работе Исследование кинетики молекулярной адсорбции. отчет адсорбция. Исследование кинетики молекулярной адсорбции
 Скачать 72.99 Kb. Скачать 72.99 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и физической химии Лабораторная работа №8 По дисциплине: Химия, часть 2 Тема: Исследование кинетики молекулярной адсорбции Выполнил: студент гр. ГРП-21.. Саржевский Д.М. (подпись) (Ф.И.О.) Оценка: Дата: Проверил: доцент /Берлинский И.В./ (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2023 РЕФЕРАТ Теоретические сведения Адсорбция – это процесс сорбции, поглощения, которое происходит в поверхностном слое вещества, обычно – твердого микропористого материала. Основное уравнение титрметрии – уравнение, основанное на законе эквивалентов, которое определяет способ получения концентрации аналита по известной концентрации титранта 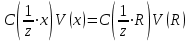 где С( 1/z х) - нормальная концентрация определяемого раствора (концентрация, которую необходимо определить); V(x) объем анализируемого раствора (известная величина); С(1/z R)– нормальная концентрация титранта (известная величина); V(R) - объем титранта (измеряемая величина). Константа скорости – это скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л. Зависит от природы реагирующих веществ и температуры, но не зависит от концентрации. Константа скорости определяется по формуле. Изотерма сорбции — зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ Эквивалент – это количество вещества, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентная концентрация — это отношение числа эквивалентов растворённого вещества к объёму раствора. Титрование – это процесс определения вещества, при котором к нему постепенно прибавляют небольшие порции реагирующего с ним другого вещества до того момента, пока всё определяемое вещество не вступит в реакцию. Молекулярная адсорбция – это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твѐрдого тела в виде молекул. Адсорбент (поглотитель) – вещество, на поверхности которого идет адсорбция. Адсорбат – вещество, которое адсорбируется на поверхности адсорбента. Адсорбтив – вещество, находящееся в объемной фазе, способное к адсорбции. Лимитирующая стадия стадия, которая определяет общую скорость процесса, лимитирующую стадию определяют сопоставлением скоростей стадий. ОСНОВНАЯ ЧАСТЬ Цель работы Установить продолжительность контакта фаз, достаточную для получения изотермы сорбции. Используемое оборудование Перемешивающее устройство (шейкер); бюретка объемом 25 мл – 1 шт.; мерный цилиндр объемом 250 мл – 1 шт.; мерная пипетка объемом 5 мл – 1 шт.; колба круглая объемом 500 мл – 1 шт.; колбы конические объемом 100 мл – 10 шт.; стакан химический объемом 150 мл – 1 шт.; стакан химический объемом 50 мл – 1 шт.; стакан химический объемом 250 – 300 мл – 1 шт.; гидроксид натрия – 0,1 н. раствор; фенолфталеин; растворы карбоновых кислот (муравьиной, уксусной). Ход эксперимента 1. Отмерили 250 мл раствора уксусной кислоты с помощью мерного цилиндра. 2. Отмеренную уксусную кислоту перелили в круглую колбу, объемом 500 мл, после чего отобрали пробу кислоты в мерную пипетку. 3. В пробу из пипетки перелили в коническую колбу. 4. 15 г активированного угля были отмерены на весах. 5. Бюретка была заполнена гидроксидом натрия до отметки «0». 5. Круглая колба с раствором уксусной кислоты была переставлена на мешалку, после чего в нее был пересыпан активированный уголь, с последующим включением перемешивания на 3 минуты. 6. Было произведено титрование первой пробы (без угля), объем титранта был записан в протокол лабораторной работы. 7. После трех минут перемешивания была взята проба из круглой колбы. 8. Было произведено титрование второй пробы (без угля), объем титранта был записан в протокол лабораторной работы. 9. Было включено перемешивания еще на 3 минуты. 10. Пункты 7-9 выполнялись для оставшихся восьми проб. Содержание протокола
Таблица 1 – экспериментальные данные
Обработка результатов 1. Концентрацию кислоты была вычислена по формуле из основного уравнения титрометрии 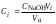 Пример вычисления 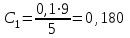 моль/л моль/лТаблица 2 – Изменение концентрации карбоновой кислоты в зависимость от продолжительности перемешивания
2. Была построена зависимость концентрации раствора карбоновой кислоты от продолжительности перемешивания, с аппроксимированными данными для выявления продолжительности контакта фаз. 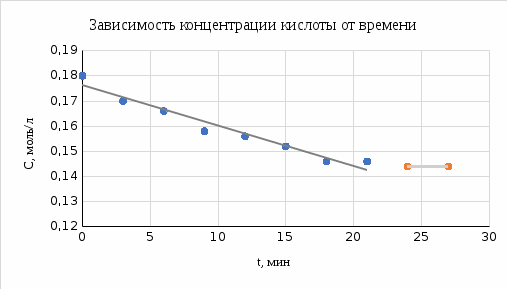 Рисунок 1 – зависимость концентрации от времени Как видно из графика, продолжительность контакта фаз в опыте составила приблизительно 20 минут. Диапазон данных от начала процесса до времени, соответствующему отсутствию зависимости концентрации от времени составляет 0 до 21 минуты. 3. Была заполнена следующая таблица Таблица 3
где Сz – текущая концентрация кислоты в растворе, моль/л; С0 – исходная концентрация кислоты в растворе, моль/л (0,180 моль/л). Концентрации Сz вычисляется по формуле: 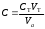 , ,где СТ – концентрация гидроксида натрия (0,1 экв/л); VТ – эквивалентный объем гидроксида натрия, мл; Va – объем пробы, взятый для анализа, мл, Va = 5 мл. Пример вычисления см. пункт 1. Сt − текущая концентрация, приведенная к исходному объему, моль/л, которую вычисляют по формуле: 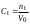 , ,Пример вычисления 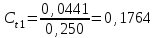 моль/л моль/лгде nt – количество вещества, оставшееся в растворе на текущий момент времени, nt рассчитывается по формуле: 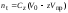 , ,где Vпр – объем пробы, отобранный для последующего определения концентрации, Vпр = 5 мл; z – номер пробы. Пример вычислений 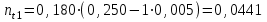 моль мольC∞ - величина равновесной концентрации кислоты в растворе, которую вычисляют по формуле 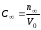 ; ;где 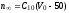 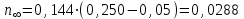 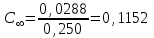 моль/л моль/л4. Была построена зависимость ln(C0/Ct) = f(t), и проведена для нее линия тренда 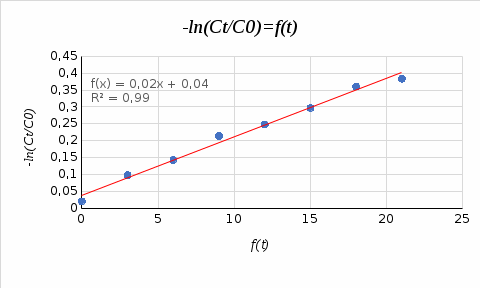 Рисунок 2 – линейная зависимость «1» Также была построена зависимость 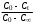 от от 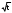 , и проведена для нее линия тренда , и проведена для нее линия тренда Рисунок 3 – линейная зависимость «2» При линейной зависимости ln(C0/Cτ) = f(t) стадией, определяющей скорость процесса, является внешняя диффузия. При линейной зависимости 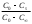 = f(√t) стадией, определяющей скорость процесса, является внутренняя диффузия. = f(√t) стадией, определяющей скорость процесса, является внутренняя диффузия.Сопоставляя величины R2 для зависимостей рисунков один и два, выбираем вариант с R2 более близким к 1. Ближе к 1 аппроксимация на первом рисунке, соответственно лимитирующей стадией является процесс внешней диффузии. Для выбранного варианта лимитирующей стадии, по значению углового коэффициента уравнения линии тренда была определена величина константы скорости процесса, k = 0,0173 (1/c). ВЫВОД Были получены навыки определения лимитирующей стадии и расчета константы скорости процесса адсорбции. Метод титрования проб раствора с адсорбентом через равные промежутки времени позволяет достаточно точно определить продолжительность контакта фаз необходимую для построения изотерм сорбции. С помощью данного метода была определена продолжительность контакта фаз – 20 минут, лимитирующая стадия адсорбции –внешняя диффузия, а также по угловому коэффициенту зависимости концентрации от времени была посчитана константа скорости адсорбции k = 0,0173 1/с. |